基于网络药理学探析白芍-甘草治疗强直性脊柱炎作用机制*
2022-08-02胡倩李丽梅王兴强王为张春燕汤小虎
胡倩 李丽梅 王兴强 王为 张春燕 汤小虎,**
(1.云南中医药大学,云南 昆明 650500;2.云南中医药大学第一附属医院,云南 昆明 650032)
强直性脊柱炎(ankylosing spondylitis,AS)是一种主要侵犯骶髂关节、脊柱骨突、脊柱旁软组织及外周关节,并与人类白细胞抗原B27(HLA-B27)密切相关的全身性、慢性炎症性疾病,影响着全球近0.1~0.5%的人口,由其引发的相关疼痛症状及韧带骨化造成不可逆的功能障碍严重影响患者的工作和生活[1-2]。
目前西医治疗以减少炎症反应、防止或降低结构破坏,改善功能为主[3]。临床上使用非甾体抗炎药物、糖皮质激素、生物制剂等治疗,虽取得一定的疗效,其胃肠道反应和潜在的毒副作用亦不容忽视,影响患者长期用药[4]。中医药以其独特的疗效,在减轻疼痛、调节免疫、改善机体整体状况等方面对AS有着积极的治疗作用。
中医历代文献并无“强直性脊柱炎”的病名,但根据类似AS的临床症状、晚期表现为驼背畸形等特点,大部分医家将AS冠以“痹证”“大偻”等名称,认为肾阳、督脉亏虚,外邪痹阻经络为其主要病因病机[5]。但不乏有医家主张肝血不足,筋脉失其濡养、以致拘挛疼痛,在治疗上强调舒筋通络、解痉止痛[6]。
白芍-甘草是中医缓急止痛的经典配伍,最早见于张仲景《伤寒杂病论》[7]芍药甘草汤,第26条:“伤寒脉浮,自汗出,小便数,心烦,微恶寒,脚挛急……更作芍药甘草汤与之,其脚即伸。”该方药简力专由白芍和炙甘草构成,白芍酸苦微寒,益阴养血;炙甘草甘温,补中缓急。二药合用酸甘化阴,有滋阴养血、缓挛急、止疼痛的作用[8]。现代研究和临床实践也证实,芍药甘草汤具有显著的解痉[9]、抗炎[10]、镇痛[11]、保护跟腱组织[12]、免疫调节[13]等作用,对多种痉挛、疼痛、炎症性疾病等都有显著的治疗作用[14]。在临床研究中含有白芍-甘草药对的乌头汤、独活寄生汤等在治疗AS上取得了较好的疗效[15-16]。但目前对白芍-甘草治疗AS的有效作用是基于哪些主要成分及分子作用机制尚未见系统描述。
网络药理学是基于人工智能和大数据时代药物系统性研究的新兴、交叉、前沿学科,其具有的整体性、系统性和综合性的特点与中药的多成分、多靶点、整体性高度相似,近年来运用网络药理学研究中药作用的分子机制已经成为常用手段,为中药复杂体系研究提供了新思路,为临床合理用药、新药研发等提供了新的科技支撑[17-18]。
本文通过网络药理学的方法探寻白芍-甘草治疗AS可能的作用靶点及其作用机制,以期为临床应用提供理论依据。
1 材料与方法
1.1药物化学成分及其相关靶点的获取 基于中药系统药理学数据库与分析平台(TCMSP),分别检索白芍和甘草的所有活性成分,并根据中药成分的 ADME(药代动力学),设置过滤条件[19]:具有较高口服生物利用度即OB (Oral bioavailability)>30% 的分子和具有较好的类药性即DL(Drug-likeness) >0.18 的分子。并在“Related Targets”栏目检索并筛选白芍和甘草有效活性成分的作用靶点。
1.2AS疾病靶点及其与药物交集靶点的获取 通过人类基因数据库(GeneCards)、在线人类孟德尔遗传数据库(OMIM)、治疗靶标数据库(TTD)、DrugBank数据库,遗传药理学与药物基因组学数据库(PharmGKb),以“Ankylosing spondylitis”为关键词搜集疾病靶点。得到疾病相关的基因信息并删除重复的靶点。将药物和疾病靶点经过Uniport数据库标准化,统一为蛋白质ID格式后将其进行对比匹配,获得与白芍-甘草治疗AS疾病相关的潜在作用靶点。
1.3核心靶点图的构建 将化合物和疾病的共同靶点导入STRING 11.0 在线平台(https://string-db.org),设置物种为人类(“Homo sapiens”),最小交互值(“minimum required interaction score”) > 0.700。得到核心靶点数据、导出为TSV格式,并利用R软件绘制条形图,进行结果的可视化。
1.4GO生物功能及KEGG信号通路富集分析 运用Bioconductor平台和R语言,对得到的药物-疾病共同靶点进行GO(Gene Ontology)和KEGG(Kyoto Encyclopedia of Genes and Genomes)富集分析,说明其在基因功能中的作用,并将其结果进行可视化。
2 结果
2.1白芍-甘草化合物及其相关靶点 初步筛选出药物已知成分共365种,其中通过过滤条件,计105个,其中白芍13 个,甘草 92 个。整合TCMSP 数据库预测,以及通过 Uniprot 数据库标准化,删除重复值后共获得 214 个化合物相关潜在靶点。
2.2疾病靶点搜索结果 共获得疾病靶点2519个,其中TTD数据库11个,PharmGKb数据库3个,OMIM数据库103个,GeneCards数据库2011个,DrugBank数据库391,删除重复值,最终获得AS疾病靶点共2137个。与白芍-甘草药物活性成分潜在靶点对比匹配,共获得TNF、IL6、CD14、PTGS1、PTGS2等80个交集靶点,韦恩图(见图1)。通过与白芍-甘草105个活性成分匹配后,得到87个具有治疗AS作用的活性成分。
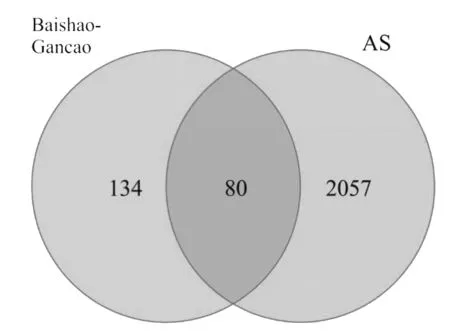
图1 交集靶点
2.3中药-化合物-靶点网络图的构建 将87个活性成分及80个交集靶点数据导入Cytoscape 3.7.2软件,构建中药-化合物-靶点网络图,具体见图2,图中红色为白芍的化合物,绿色为甘草的化合物,黄色为靶点,并对该网络图中的化合物节点的度值(Degree)进行分析,Degree在活性成分节点表示该活性成分所对应的靶点个数,意味着度值越大,该活性成分在治疗AS的过程中所发挥的作用也越大,可得出前5位关键化合物为槲皮素(quercetin)、山柰酚(kaempferol)、柚皮素(naringenin)、钩藤酮a(licochalcone a)、7-甲氧基-2-甲基异黄酮(7-Methoxy-2-methyl isoflavone)分别能与55、23、19、15、12个关键靶点连接,对治疗AS具有重要的意义,具体见表1,选取度值 > 10的活性成分进行展示。

图2 中药-化合物-靶点网络图

表1 “白芍-甘草”治疗AS的主要活性成分
2.4核心靶点网络图 将80个共同靶基因导入至STRING,利用R软件绘制条形图,展示Degree排名前30的靶点,见图3,其中Degree值较高的为核心基因,由图可见白细胞介素-6(IL6)、肿瘤坏死因子(TNF)、前列腺素内过氧化物合酶2(PTGS2)、血管内皮生长因子-A(VEGFA)、丝裂原活化蛋白激酶-3(MAPK3)、白细胞介素1B(IL-1B)等基因排名靠前,其中TNF(Degree54)和IL6(Degree59)和为白芍-甘草治疗AS最相关的候选靶点。
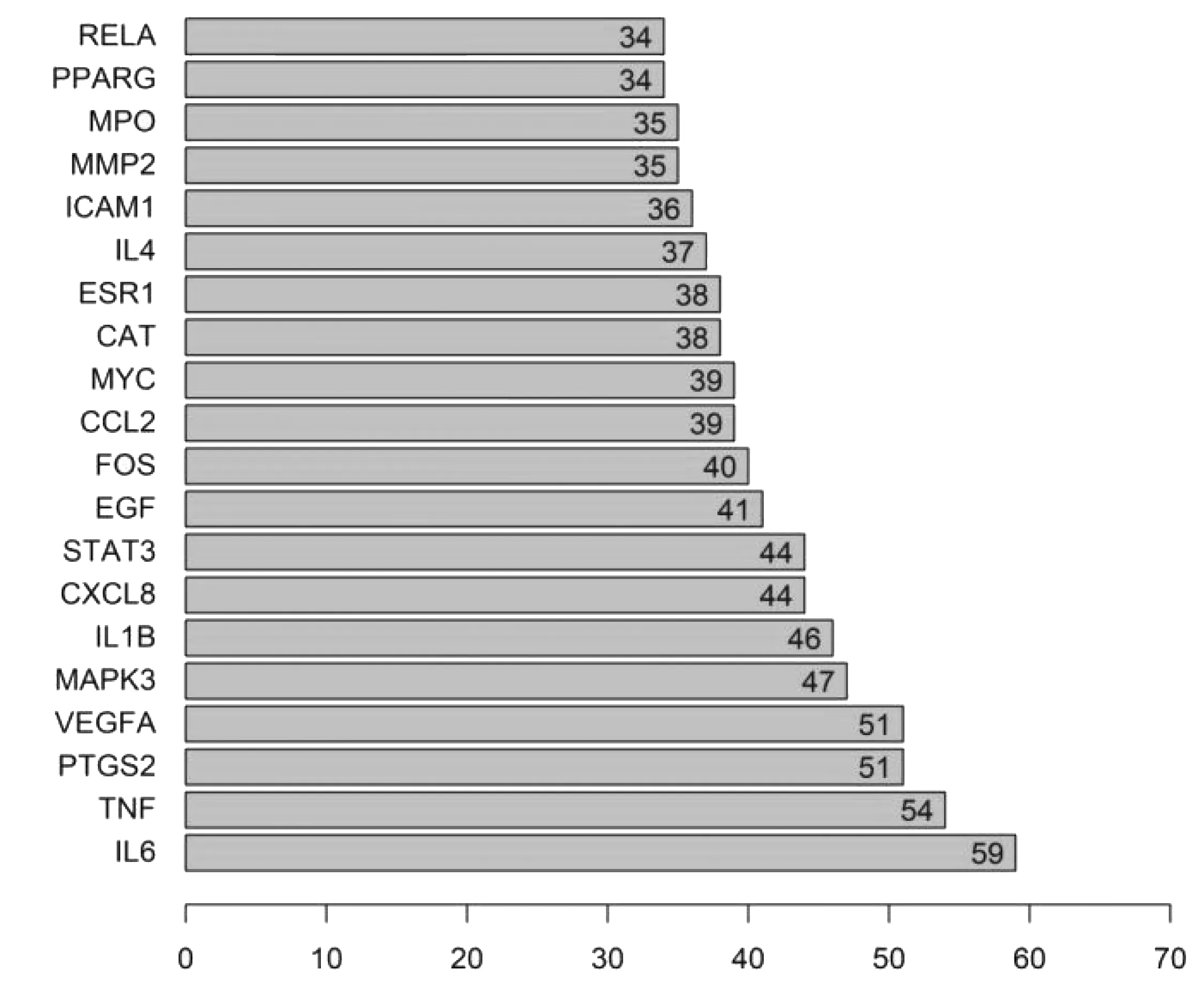
图3 PPI中的核心基因(前20)
2.5靶点功能与通路的富集分析 使用R软件对80个共同靶点进行富集分析,设置阈值P<0.05,对P值排序后进行分析并对其结果进行可视化,由结果可见白芍-甘草参与的通路主要有IL-17信号通路(IL-17 signaling pathway)、TNF信号通路(TNF signaling pathway)、NF-κB信号通路(NF-kappa B signaling pathway)、Toll样受体信号通路(Toll-like receptor signaling pathway)等,见图4。其中生物学过程(Biological Process)1820条,分子功能(Molecular Function)119条,细胞组成(Cellular Component)25条。参与生物过程包括脂多糖应答(response to lipopolysaccharide)、对细菌来源的分子反应(response to molecule of bacterial origin)、类固醇代谢过程(steroid metabolic process)、对有毒物质的应答(response to toxic substance)、对生物刺激的细胞免疫应答(cellular response to biotic stimulus)等。分子功能中与核受体活性配体激活(nuclear receptor activity ligand-activated)、DNA转录因子结合和转录因子活性(transcription factor activity DNA-binding transcription factor binding)、细胞因子活性(cytokine activity)等密切相关。在细胞组成中细胞膜膜筏(membrane raft)、膜微区(membrane microdomain)、膜区(membrane region)、质膜外侧面(external side of plasma membrane)比例最大。见图5。
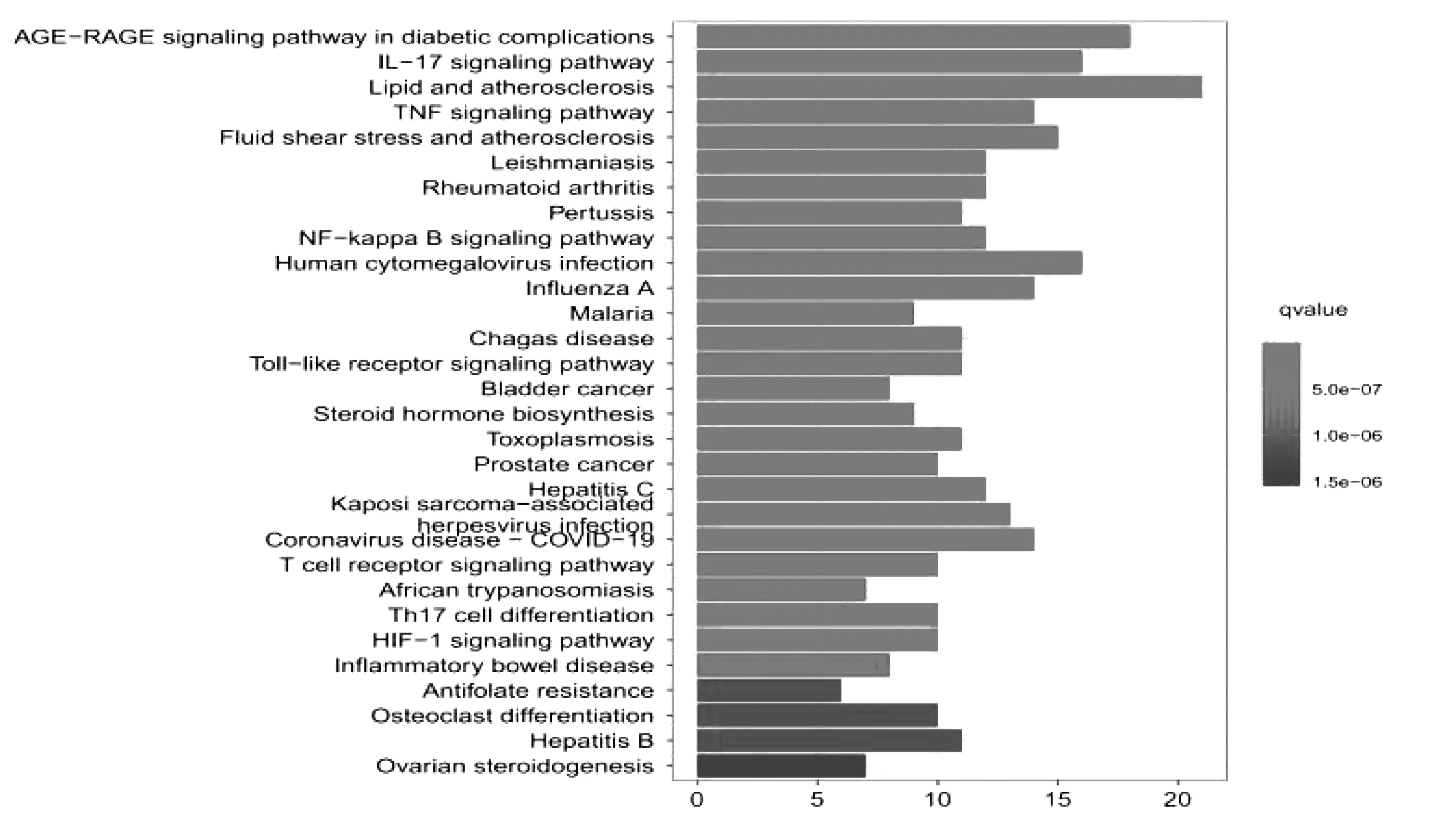
图4 KEGG通路富集分析
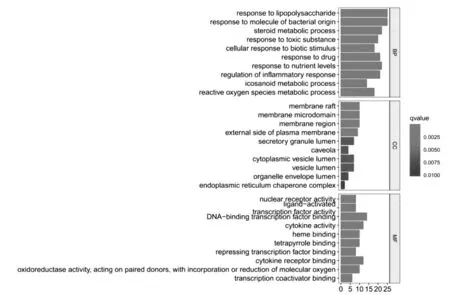
图5 BP、CC、MF分析柱状图
3 讨论
本文通过网络药理学的方法发现白芍-甘草治疗AS最主要的成分为槲皮素、山柰酚,其中山柰酚为白芍-甘草共同的成分,槲皮素为甘草的主要成分,两者均为黄酮类化合物。近年来黄酮类化合物被认为是天然药物中最有效的成分,在体内外均有改善炎症的作用[20]。其中山奈酚通过抑制环氧合酶(COX)通路的活性来抑制花生四烯酸转化为前列腺素,进而减轻炎症反应,达到较好的抗炎镇痛作用[21]。在临床研究中发现其能显著降低炎症生物标志物C反应蛋白(CRP)和炎症因子IL-6、TNF的表达[22]。槲皮素具有抗炎、抗感染、抗氧化、神经保护等药理活性[23]。研究发现槲皮素可能通过减弱由吲哚美辛诱导的核因子κB(NF-κB)的活化及白细胞介素-8(IL-8)的产生从而抑制胃肠道黏膜黏附分子表达和中性粒细胞浸润、达到预防或治疗非甾体抗炎药关于胃肠道的副作用,同时不影响TNF-α介导的前列腺素E2的抑制作用,能在一定程度上增强非甾体抗炎药物的抗炎活性[24]。
AS导致患者关节结构改变的病理过程可分为炎症、骨侵蚀、新骨形成三个阶段,每个阶段的效应通路都可能与TNF有关,有研究表明TNF对于骨稳态的作用可能与其局部浓度有关,低浓度下通过上调Runx2、骨钙素和碱性磷酸酶水平来增加成骨分化,触发骨增殖和新骨形成[25]。
通过网络药理学的方法发现TNF、IL-6和PTGS2为白芍-甘草治疗AS最相关的靶点。早期使用肿瘤坏死因子抑制剂(TNFi)如阿达木单抗(ADA)等,可以减轻患者外周关节滑膜的组织病理学改变、减少AS患者髋关节放射学进展[26-27]。IL-6是处于TNF下游的促炎细胞因子,参与着促炎和抗炎通路、代谢控制、骨代谢、神经修复和再生过程,在多种恶性肿瘤的调节和生长中发挥重要作用[28-29]。既往研究表明TNF-α、IL-1β和IL-6在AS患者血清中明显上调,这些炎症因子的释放加速了强直性脊柱炎的发展[30-31]。环氧合酶-2(Cyclooxygenase,COX2)是诱导型酶,由PTGS2基因编码,是AS炎症通路启动的关键酶,主要参与前列腺素和血栓素的生物合成,并将花生四烯酸转化为前列腺素H2,通过降低相关炎症因子的表达、阻断前列腺素的产生,可减轻炎症反应、缓解临床症状[32-33]。
KEGG富集分析结果显示,白芍-甘草治疗AS可能通过IL-17、TNF、NF-κB、Toll样受体等信号通路发挥作用,其中IL-17信号通路被认为参与了AS发病的炎症和新骨形成过程[34]。AS的发病机制涉及单核细胞、巨噬细胞、树突状细胞、T淋巴细胞等多种免疫细胞[35-36]。其中由T细胞产生的IL-17细胞因子水平在AS患者的关节组织中明显升高,且通过抗IL-17抗体阻断IL-17A的功能,可阻止SKG(自发型类风湿关节炎)小鼠脊柱中AS样特征的发展[37-38]。IL-17可靶向多种细胞,如内皮细胞、成纤维细胞和巨噬细胞,导致炎症细胞因子如IL-6、TNF-α、基质金属蛋白酶(MMPs)的表达,从而造成关节炎症的发生[39-40],这些细胞因子一方面扩大了滑膜的炎症,另一方面也激发了骨的过度修复反应,造成了新骨的形成。已有研究证明IL-17可能通过激活巨噬细胞产生的MMPs和成骨细胞呈现的NF-κB配体受体激活剂(RANKL)来影响骨代谢[41]。
综上所述,白芍-甘草可能通过多成分多靶点多通路抑制新骨形成、降低炎症反应和炎症因子等作用,从而延缓病情发展及改善患者生活质量。但由于网络药理学研究方法存在一定的局限性,白芍-甘草基于中医理论柔肝缓急、以助舒筋,对于其是否具有缓解韧带骨化方面还需进一步研究证明。通过本文的研究提示:具有柔肝缓急的白芍-甘草的配伍结构,在防治AS患者韧带骨化方面提供了思路。
