连续性肾脏替代治疗在经导管主动脉瓣置换术术前准备中的作用
——附10例临床病例研究
2022-08-02徐臣年翟蒙恩金振晓
金 屏,徐臣年,翟蒙恩,金振晓,郭 红,乔 锐,刘 洋,杨 剑
(1空军军医大学西京医院心血管外科,陕西 西安 710032; 2解放军北部战区总医院干部病房一科,辽宁 沈阳 110016)
经导管主动脉瓣置换术(transcatheter aortic valve replacement,TAVR)是一种针对高危主动脉瓣膜病患者的非体外循环治疗方式,术后并发症可能对手术效果产生重大影响。TAVR后急性肾损伤(acute kidney injury,AKI)的预后较差,AKI可由多种原因引起,如术前合并肾功能不全、快速起搏时血流动力学不稳定、输血、围术期栓塞和造影剂等[1-2]。TAVR后发生AKI的患者,30 d和1年死亡率均增加,住院时间和住院费用也相应增加[3]。关于其预防方法已有相关报道,如围术期水化治疗、谨慎使用造影剂、防栓塞器械植入等,但其应用效果有限,尤其是对于术前合并有肾功能不全的瓣膜病患者,是否适合行TAVR治疗以及手术时机的选择仍存在争议[4-5],预计未来TAVR的手术量会越来越多。本文回顾性总结肾功能不全患者行连续性肾脏替代治疗(continuous renal replacement therapy,CRRT)后接受TAVR的可行性及安全性经验,以期减少手术并发症,改善患者预后。
1 对象与方法
1.1 对象
10例拟行TAVR的肾功能不全患者,其中男6例,女4例,平均年龄(66.5±11.3)岁,主动脉瓣狭窄(aortic stenosis,AS)3例,主动脉瓣关闭不全(aortic insufficiency,AI)6例,AS伴AI患者1例。术前心功能按照美国纽约心脏病学会(New York Heart Association,NYHA)分级:Ⅲ级5例,Ⅳ级5例。合并肾性高血压5例,冠心病3例,慢性支气管炎1例,升主动脉瘤样扩张1例。全组患者术前均进行了经胸超声心动图及经食道超声心动图进行明确诊断(图1),多排CT及3D打印技术辅助术前评估及手术模拟。术前肾功能指标:肌酐(creatinine,Cr)(22.91±11.90)μmol/L、尿素氮(urea nitrogen, UN)(703.33±316.48)mmol/L、尿酸(uric acid, UA)(367.33±87.19)μmol/L、血清钾(K+)(4.45±0.90)mmol/L。

A: 主动脉瓣狭窄伴关闭不全;B: 彩色血流显示血流反流。图1 术前超声影像学评估结果
1.2 方法
1.2.1 完善术前检查及多模态影像学评估 所有患者完善术前常规检查,超声及CTA影像学评估患者主动脉瓣膜情况,利用CT数据进行3D打印的计算机模拟重建及实物模型重建,体外个体化可视化评估患者主动脉根部解剖及辅助手术方案制定(图2)。评估患者肾功能,并请肾脏内科辅助CRRT改善肾功能。

A:主动脉瓣瓣环长短径测量;B:瓣膜钙化分布评估;C:冠脉开口距瓣环平面距离测量;D:股动脉入路重建;E:计算机模拟重建主动脉根部及瓣膜植入;F:3D打印模型模拟主动脉根部解剖及瓣膜植入。图2 3mensio软件分析术前CTA影像及3D打印评估
1.2.2 术前CRRT 10名患者CRRT方案均使用Prismaflex系统(Gambro)或Dipact机(Braun)进行治疗,分别配备Multiflow-100(0.9 m2,AN69膜)和AV600(1.4 m2,Fresenius)中空纤维过滤器。经颈静脉插入13.5 F双腔导管建立血管通路。换血前、后分别按50%血浆置换量的比例输注,即换血率为50%血浆置换量。根据患者血气分析结果,以适当速率分别注入预滤器中的碳酸氢钠缓冲液。CRRT的剂量范围为25~35 mL/(kg·h),根据患者的血流动力学监测指标和病因进行调整。抗凝方案须临床医生根据凝血功能和出血风险来决定。在CRRT开始后2 h和之后每4 h监测动脉和滤后钙离子浓度,治疗期间每隔4 h进行 1次动脉血气分析和血清电解质监测,停机后,按TAVR方案进行术前准备。
1.2.3 TAVR过程 经心尖途径:全麻后行气管插管,术中监测采用经食道超声心动图。穿刺右侧股动脉处行穿刺并置入6F猪尾导管,送至主动脉根部。经心尖途径切口定位于第五肋间,逐层切开,暴露心包腔,心尖部血管裸区处缝荷包并穿刺,以14F 鞘管扩张心尖穿刺处,调整角度, 并送入J-Valve 瓣膜输送系统,到达患者主动脉瓣瓣环处。逐步释放瓣膜系统,经食道超声心动图术中监测。完全释放瓣膜后撤出输送系统,心尖荷包打结。仔细检查出血情况,逐层闭合胸腔,缝合,拔除股动脉鞘管,闭合股动脉穿刺处。密切检测患者生命体征,平稳后转至监护室观察,病情平稳后转回普通病房[6]。
经股动脉途径:全麻及肝素化后,ACT≥480 s后开始手术,保温并监测凝血情况。穿刺右侧股动脉并置入6F股鞘,穿刺右侧桡动脉并置入5F桡鞘管置入5F导管并造影,右侧颈静脉置入6F起搏导管鞘及导管,调试起搏导管至右心室心尖处。以泥鳅导丝引导AL2导管至主动脉根部,置换260 cm直头泥鳅导丝过瓣口。置入20F主动脉鞘管,置入lunderquist导丝到达左心室,撤出AL2导管,造影及经食管超声监测心功能以及显示术中瓣膜情况。根据术前影像学评估及3D打印评估选择合适型号Venus-A或VitaFlow瓣膜,沿lunderquist导丝将输送系统送至瓣环水平,造影确定释放位置。起搏、调整并释放瓣膜,造影评估释放情况。瓣膜完全释放后撤出输送系统。密切检测患者生命体征,平稳后转至监护室观察,病情平稳后转回普通病房(图3),具体手术过程参见文献[7-8]。

A:主动脉根部造影;B:直头导丝跨过主动脉瓣;C:置换带弯lunderquist导丝;D:球囊扩张狭窄主动脉瓣膜;E:瓣膜输送系统到达瓣环平面,调整角度后,释放瓣膜;F:瓣膜完全释放后造影,确定瓣膜位置良好后,撤出输送系统。图3 术中DSA造影
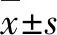
2 结果
10例患者成功接受TAVR,植入介入瓣膜10枚,其中J-Valve瓣膜(中国苏州杰成公司)5枚,Venus-A瓣膜(中国杭州启明公司)3枚,VitaFlow瓣膜(中国上海微创公司)2枚。平均手术时间(107.43±42.58)min,DSA照射时间(33.92±7.94)min,围手术期患者血流动力学稳定。CTA显示瓣膜位置良好,无并发症(图4)。术后EF值(41.67±13.54)%,患者术后心功能分级(NYHA分级)均为III级,患者住院时间(7.17±1.60)d。
患者肾功能指标Cre [(15.44±6.89)μmol/Lvs(22.91±11.90)μmol/L,P>0.05],K+[(4.08±0.41)mmol/Lvs(4.45±0.90)mmol/L,P>0.05]未见明显变化,而UN[(539.00±341.40)mmol/Lvs(703.33±316.48)mmol/L,P<0.05],UA[(218.33±94.66)μmol/Lvs(367.33±87.19)μmol/L,P<0.05]相对术前检测水平降低。目前10位患者定期随访中。

图4 术后CTA显示瓣膜位置良好,无并发症
3 讨论
20世纪60年代以来,外科主动脉瓣置换术(surgical aortic valve replacement, SAVR)仍然是治疗严重AS的金标准。专业水平较高的中心SAVR并发症发生率较低,但约有30%的患者由于潜在的疾病,该类患者不能够接受SAVR[9-11]。在过去10年中, TAVR已成为瓣膜病患者的一种替代疗法。TAVR历史上有里程碑意义的临床试验(PARTNER trial)显示高危或不能手术的患者的预后得到改善[12-14]。尽管最初TAVR的构想是通过微创方法来降低患者的发病率和死亡率,在权衡风险和益处时,TAVR需要仔细考虑有关并发症。潜在的主要并发症包括卒中、心脏传导阻滞、主动脉瓣瓣周漏和AKI。考虑到接受TAVR的患者一般都是老年人,并且通常有慢性肾脏病(chronic kidney disease,CKD),术后AKI的影响可能是显著的,由于肾小球滤过率(glomerular filtration rate,GFR)降低与死亡率的增加有关[15]。在过去几年中,支持TAVR的研究及报道大量增加,越来越多中等风险患者接受TAVR,探讨TAVR后的AKI的患病率、危险因素和预后意义的研究也越来越多[16-17]。
TAVR是一种对于不能手术的、患有严重症状性主动脉狭窄的中高危患者进行安全有效的治疗方法,TAVR目前已经被指南推荐作为AS患者的治疗方法,对于AI患者TAVR治疗虽然也有许多报道,但是需要前瞻性研究的作证以及研发相应的适用器械。由于术中均需要使用造影剂等原因,对于术前合并有肾功能不全的瓣膜病患者行TAVR后的获益仍存在不确定性。有研究表明CKD患者术前GFR<60是TAVR后短期和长期预后较差的有力预测因子,应采取积极措施减轻患者术后并发症风险[18]。保守治疗可能对于合并有肾衰竭等病症的患者造成预后较差,术前合并有CKD患者接受SAVR与预后不良正相关。然而,目前TAVR研究没有排除晚期CKD患者,而CKD相关TAVR的研究结果有限[5]。此外,有关CKD对TAVR术后预后的影响的研究结果也出现相互矛盾的情况。因而研究肾功能不全患者接受TAVR治疗的获益情况非常值得探讨,这可能需要术前合并有肾功能不全患者行TAVR治疗的随机对照试验加以佐证。一方面,肾功能不全患者行TAVR治疗长期随访数据将更清楚地说明TAVR介入瓣膜的可靠性和耐久性。另一方面,严重主动脉狭窄和合并症包括CKD的老年患者,如果在没有充分评估的状况下行TAVR治疗,将导致再次住院,可能给患者和家庭带来很高的医疗和经济负担[19]。
研究表明,TAVR术后AKI相关的患者因素包括术前存在CKD(基线Cr升高或GFR降低)、高血压、胸外科医师学会或欧洲评分风险评分、糖尿病和外周动脉疾病或慢性阻塞性肺疾病。文献回顾显示,基线GFR与AKI风险呈负相关[5]。此外,最新一项来自主动脉瓣置换临床试验注册研究的结果显示,在基线检查时,损伤后GFR恶化者1年的全因死亡率增加[19]。然而,76%患者在TAVR治疗后,大多数患者的基线肾功能损害没有恶化。此外,随着更先进的器械及保护措施的研发与应用,TAVR后发生AKI可能减少。高危患者造影剂肾病预防措施的前瞻性随机试验结果表明,增加尿量被认为是保护性对抗造影剂引起的肾损伤的有效措施[2]。CRRT是目前改善患者肾功能的有效血液置换方法之一,本研究中10例患者术前合并有肾功能不全,在行CRRT后行TAVR治疗,术后随访结果较好,肾功能无严重损害,部分肾功能指标改变,可能与手术过程本身以及造影剂有关,从随访结果来看,CRRT改善肾功能、增加了TAVR患者肾脏耐受力,辅助TAVR成功进行。
综上所述,术前合并肾功能不全拟行TAVR患者,行CRRT后再行TAVR具备安全性及可行性。本研究也存在一定的局限性,TAVR技术在国内为新型技术,临床应用均为起步阶段,其在国内有适应证问题的限制,且本研究的病例数有限,术前合并肾功能不全都是高危患者,未来需要更多临床病例的积累以及不同肾功能分期行TAVR评价的前瞻性临床研究。
