基于SEER数据库建立并验证混合型肝癌的预后评价模型
2022-08-02王大林田济铭闫泽宇安家泽
王大林,田济铭,闫泽宇,安家泽
( 1空军军医大学西京医院肝胆外科,陕西 西安 710032; 2兰州大学第一临床医学院妇产科,甘肃 兰州 730099; 3空军军医大学唐都医院普外科,陕西 西安 710038)
混合型肝癌(combined hepatocellular cholangio-carcinoma,cHCC-CC)是一类兼具肝细胞肝癌和胆管细胞癌分化特点的原发性肝癌。流行病学调查研究显示cHCC-CC发病率占所有原发性肝癌的0.4%~14.2%,且伴有增长趋势[1-2]。目前尚无针对cHCC-CC的有效药物,临床治疗多以手术切除为主,然而术后平均复发时间仅5.4个月,5年生存率为23%,均低于肝细胞肝癌和胆管细胞癌[3]。因此,有效评估cHCC-CC患者预后具有重要意义。然而由于细胞异质性强、诊断标准不易把控、发病率低、样本收集困难等原因,cHCC-CC的治疗和预后多局限于小规模研究,且临床缺乏有效的预后评估模型[4-5]。列线图是针对单个患者的预后预测模型[6]。研究表明,列线图预测癌症患者预后的效果优于传统临床分期的预测效果[7]。近年来列线图已经用于各类癌症并成为可靠的预后预测工具[8-10]。本研究基于监测、流行病学和最终结果(Surveillance, Epidemiology, and End Results, SEER)数据库系统规范的临床相关信息,评估多种临床及病理相关指标对预测cHCC-CC患者预后的价值,进一步构建并验证列线图模型,这将有助于指导患者预后评估及临床干预措施。
1 对象与方法
1.1 对象
通过SEER*Stat软件获取SEER数据库中2004—2015年cHCC-CC患者临床资料。入组标准:①诊断方式为病理学确认;②病理学类型为cHCC-CC;③随访类型为积极随访。剔除标准:①缺乏年龄、性别、种族等基本信息;②缺少手术相关资料以及肿瘤临床分期、病理分级等信息;③随访信息不全。最终纳入研究267例。
1.2 方法
1.2.1 确定截断值 使用耶鲁大学开发的“X-Tile”软件确定连续性变量的最佳截断值,将年龄、肿瘤大小转换为二分类变量[11]。
1.2.2 预后评估模型的构建 基于R软件(版本4.1.1),通过使用“rms”“foreign”“survival”包进行单因素和多因素Cox回归分析。将患者的性别、年龄、种族、分化程度、美国癌症联合委员会(American Joint Committee on Cancer,AJCC)TNM分期(第八版)、肿瘤大小、术前甲胎蛋白(α-fetoprotein,AFP)水平、Ishak肝纤维化评分、治疗方式等11个变量纳入单因素Cox回归分析,根据结果进一步选择P<0.05的变量进行多因素Cox回归分析。针对多因素Cox回归分析中P<0.05的变量,利用“nomogram”函数构建列线图模型。
1.2.3 预后评估模型的评价 基于R软件,通过“survival ROC”包来绘制预测1、3、5年总生存率的受试者工作特征 (receiver operator characteristic,ROC)曲线,通过“calibrate”函数来绘制预测1、3、5年总生存率的校准曲线(通过bootstrap法循环1 000次)。
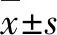
2 结果
2.1 患者临床资料特征及生存情况
2004—2015年SEER数据库中收纳825例cHCC-CC患者,根据入组和剔除标准剔除558例,最终纳入267例进行分析。依据比例7∶3将患者随机分为训练集(188例)和验证集(79例)。整体而言,男性186例(69.66%)、女性81例(30.34%);年龄14~85(61.40±10.50)岁;肿瘤直径0.3~30.0(6.54±4.37)cm;AFP>15 μg/L的患者136例(50.94%);接受外科手术的患者166例(62.17%),接受放疗的患者9例(3.37%),接受化疗的患者100例(37.45%),其中同时接受手术治疗和化疗的患者53例(19.85%),同时接受手术治疗和放疗的患者8例(3.00%),同时接受手术治疗、放疗及化疗的患者7例(2.62%)。针对连续性变量,通过使用X-Tile软件确定最佳截断值并将其转变为二分类变量。其中,年龄的最佳截断值为53岁,肿瘤直径的最佳截断值为5.7 cm(图1)。训练集和验证集的具体临床信息见表1。
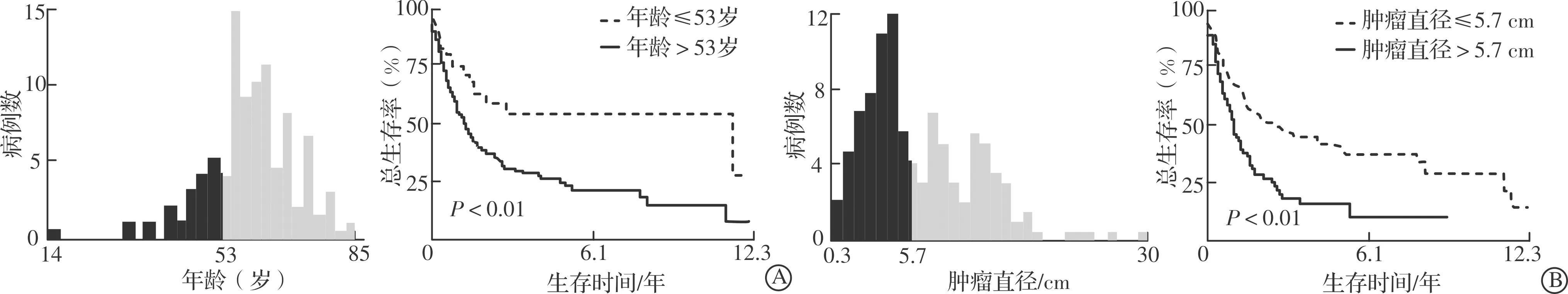
图1 X-Tile 软件计算训练集患者年龄(A)及肿瘤直径(B)的最佳截断值及相应的生存曲线
表1 训练集和验证集中cHCC-CC患者临床资料特征 [n (%)]
截至随访时间,训练集死亡133例,存活55例,中位总生存期(overall survival,OS)为14个月,1、3、5年总生存率分别为54.79%、35.64%、32.45%;验证集死亡60例,存活19例,中位OS为12个月,1、3、5年总生存率分别为49.37%、26.58%、25.32%。训练集和验证集的生存曲线及95%CI见图2。
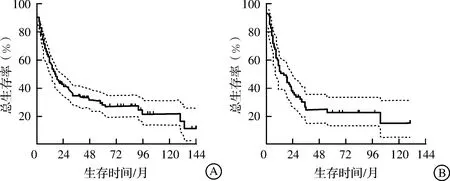
图2 训练集(A)和验证集(B)中cHCC-CC患者生存曲线
2.2 预后影响因素分析
单因素Cox回归分析提示年龄>53岁、分化程度低、TNM高分期、肿瘤直径>5.7 cm、未行手术治疗均与cHCC-CC患者预后不良相关(P<0.05,表2)。进一步将有意义的危险因素纳入多因素Cox回归分析中。同时,考虑到肝纤维化是肝癌进展及预后的重要影响因素[12],因此将肝纤维化Ishak评分也纳入多因素回归分析。结果显示以上指标均是影响cHCC-CC患者预后的独立危险因素(P<0.05,表2)。
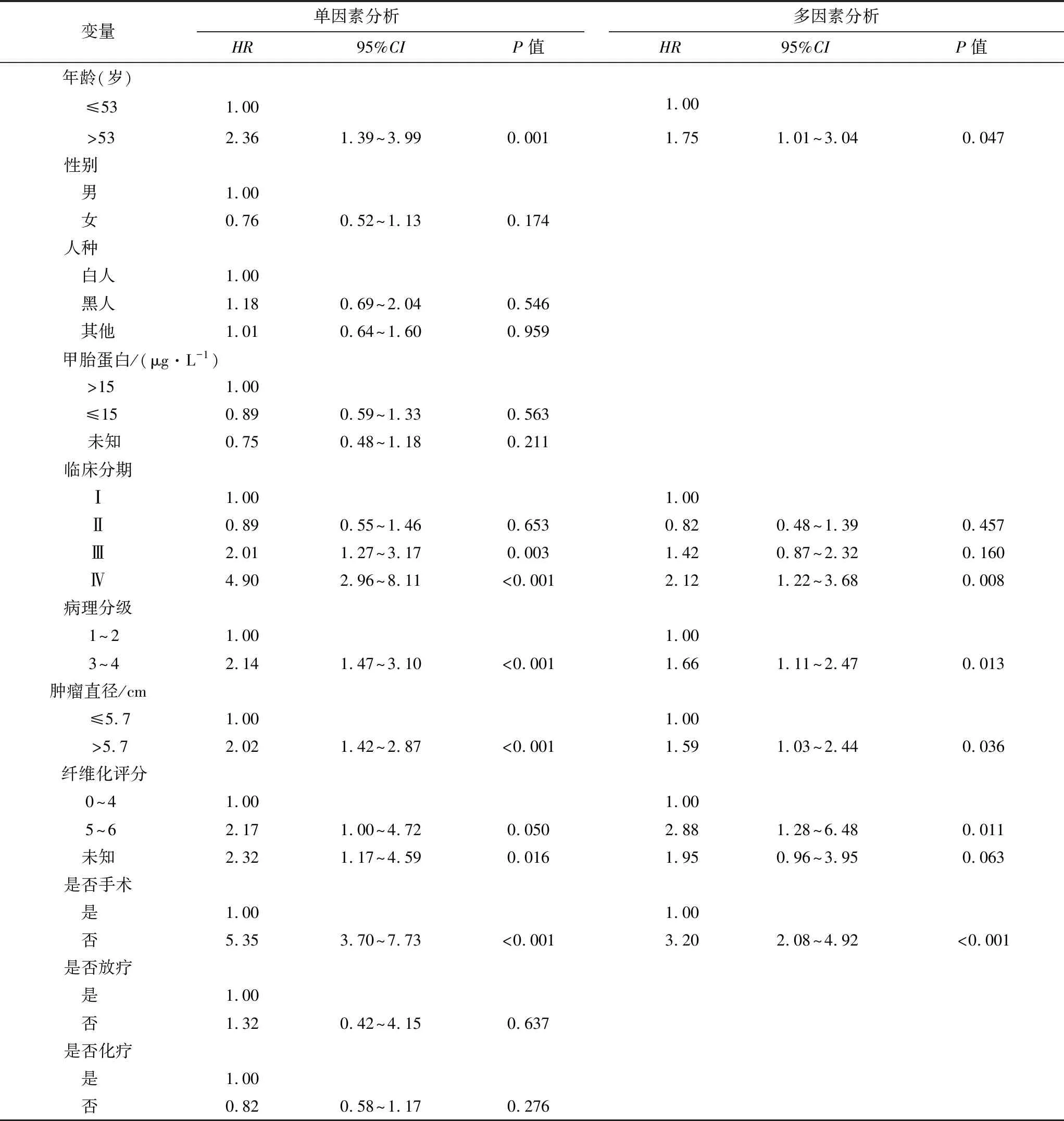
表2 训练集中cHCC-CC患者预后相关因素的Cox比例风险回归分析
2.3 列线图预后模型的构建
基于患者年龄、肿瘤大小、分化程度、TNM分期、纤维化评分和手术情况6个cHCC-CC预后独立影响因素,构建患者总生存率的列线图预后评估模型。通过列线图可明确患者各项预后指标对应的分数值,这6个分数值之和为总分,对应患者1、3、5年总生存率的预测值(图3)。
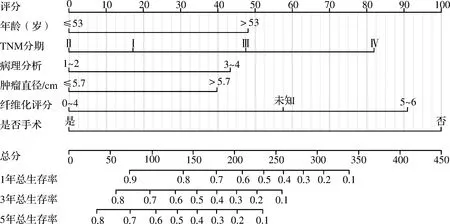
图3 预测cHCC-CC患者总生存率的列线图模型
2.4 列线图预后模型的效能评估
列线图在训练集和验证集中的C指数分别为0.778和0.765。在训练集中,预测1、3、5年总生存率的ROC曲线下面积分别为0.846、0.874、0.893;在验证集中,预测1、3、5年总生存率的ROC曲线下面积分别为0.843、0.781、0.755(图4)。以上结果表明该列线图对于cHCC-CC患者的预后具有较好的预测能力。同时,训练集和验证集中1、3、5年的校准曲线提示,该列线图的预测生存率与实际生存率的拟合度较好,表明该预后评估模型具有较好的校准度(图5)。此外,基于列线图将267例患者通过风险评分的中位数分为高风险和低风险两组,结果显示高风险组预后更差(图6)。
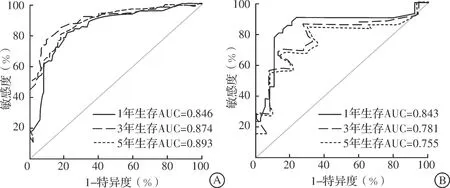
图4 列线图模型预测训练集(A)和验证集(B)患者1、3、5年总生存率的ROC曲线
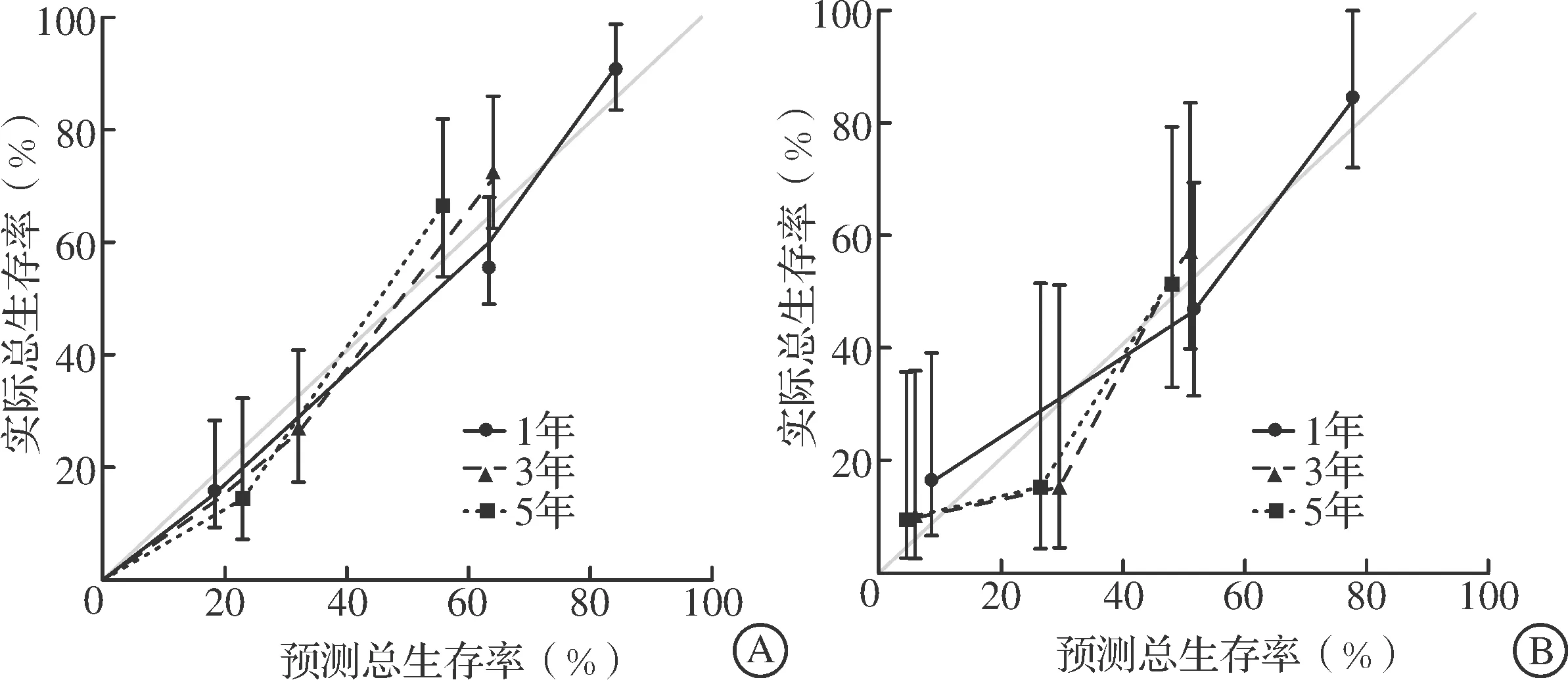
图5 列线图模型预测训练集(A)和验证集(B)患者1、3、5年总生存率的校准曲线
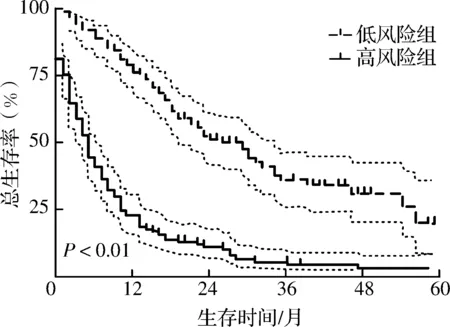
图6 整体队列中基于风险评分的生存分析
3 讨论
作为肝癌患病大国,我国肝癌新发病例占全球肝癌新发病例近半数。尽管cHCC-CC是一类少见的原发性肝癌,但我国患者的绝对数量不容忽视。此外,根据《AJCC癌症分期手册》第八版,cHCC-CC目前参考胆管细胞癌的TNM标准进行临床分期[12-13]。然而,cHCC-CC作为一种高度异质性的实体瘤明显不同于肝细胞肝癌或胆管细胞癌,这种分期策略很可能在cHCC-CC预后预测和临床决策指导方面存在不足。
为了更好地评估cHCC-CC患者预后情况,本研究基于SEER数据库收集包括TNM分期在内的cHCC-CC患者相关临床信息,并进行预后因素分析及预后模型构建。本研究发现cHCC-CC好发于老年男性、多呈低分化,且5年总生存率不足30%,预后较差,这与既往报道基本一致[14]。此外,多因素Cox比例风险回归分析结果显示,年龄大于53岁、肿瘤低分化、TNM高分期、肿瘤直径大于5.7 cm、重度纤维化、未行手术治疗是影响cHCC-CC患者预后的独立危险因素。其中,临床分期Ⅲ、Ⅳ期患者较Ⅰ期患者预后明显更差,且Ⅳ期较Ⅰ期而言是患者预后的独立危险因素,提示TNM高分期是影响cHCC-CC预后的重要因素,且远处转移是影响cHCC-CC患者预后的独立危险因素。TNM分期系统作为最常用的肿瘤分期系统之一,被证明和cHCC-CC预后息息相关[15]。肿瘤转移往往是临床治疗失败的主要原因,同时也被认为是cHCC-CC预后的独立危险因素[16]。与此同时,肿瘤大小不仅能反映肿瘤的发展程度,也能够显著影响cHCC-CC预后[17]。本研究还观察到,重度肝纤维化患者(Ishak 评分5~6分)相较于轻中度肝纤维化患者(Ishak评分0~4分)总生存率明显更差,这可能是由于肝脏纤维化能够通过调控肿瘤微环境进而影响肝癌的进展[18]。此外,外科手术作为普遍认可且有效的基本治疗手段[19],是最为显著的预后影响因素,其中接受手术的cHCC-CC患者的5年总生存率达到50%,而未接受手术治疗的患者仅为4.17%。综上所述,在肝纤维化等疾病的基础上,如果高龄患者的肿瘤越大、分期越高、分化越差,同时还未行手术治疗,那么预后会更差。因此,应提倡定期体检,尽量做到早诊早治,还应强调手术治疗时应尽可能达到根治性切除的目的,避免不必要的肿瘤复发和转移。
既往有关cHCC-CC预后的研究大多局限于小队列小范围内研究,并且很少构建预后评估模型。ZHOU等[20]通过研究磁共振相关影像学指标和cHCC-CC患者预后的相关性时发现,动脉期外周增强是影响cHCC-CC患者预后的独立危险因素。YAMASHITA等[21]发现脱-γ-羧基凝血酶原、CA19-9和肿瘤分化程度均为cHCC-CC患者术后早期复发的独立影响因素。尽管有研究曾基于SEER数据库对cHCC-CC患者预后影响因素进行过分析,但并未构建预后模型[5]。HE等[22]则进一步构建了cHCC-CC患者术后的预后评估模型,但纳入的研究变量较少,并没有血清AFP、肝纤维化评分等指标。在本研究中,我们通过纳入多种变量构建了一个预测cHCC-CC患者预后的列线图模型,并在验证集中进行了效能验证,C指数、ROC曲线下面积和校准曲线均提示列线图模型在预后预测方面表现良好。该研究发现肝纤维化评分作为之前未曾报道过的指标,是cHCC-CC患者的预后独立影响因素。该列线图模型为有效评估cHCC-CC患者的总生存率提供了一种简便途径,同时对于指导临床治疗具有一定参考价值。诚然,这项研究也有其局限性。首先,该研究并未包含所有风险因素。SEER数据库缺少一些重要的肿瘤生物标志物(如CA19-9)检测结果和一些临床预后指标(如手术切缘状态和血管侵犯等)。纳入更多的研究指标可能会提高预后模型的预测效果。此外,SEER数据库主要涵盖美国境内的患者信息,考虑到人群特征和医疗环境与我国存在差别,研究结果是否适用于我国患者,仍需外部队列研究进一步验证。
