游泳运动预处理抑制钙蛋白酶活性减轻心肌细胞膜的缺血-再灌注损伤
2022-08-02曹梦舒赵霆延孙君志周京军
鲁 涛,曹梦舒,郑 云,赵霆延,孙君志,周京军
(1成都体育学院运动医学与健康研究所,四川 成都 610041;空军军医大学: 2基础医学院生理与病理生理学教研室, 3西京医院心血管外科,陕西 西安 710032)
缺血-再灌注是心脏体外循环手术过程中的必经阶段,尽管已有HTK液、GIK液以及利尿剂的使用在一定程度上减轻了缺血-再灌注损伤,但对于高龄、术前射血分数低下等高危患者,心肌缺血-再灌注损伤仍是影响术后心功能、多器官功能衰竭和死亡率的关键因素[1]。
细胞膜是维持细胞内环境稳态的屏障,参与细胞同周围环境进行信息与物质交换。细胞膜的质量还决定着心肌兴奋-收缩耦联的效能。细胞膜通透性增大是心肌缺血-再灌注早期损伤的标志[2],前期研究表明,缺血-再灌注激活钙蛋白酶,造成膜通透性增大、膜蛋白丢失,引发心肌损伤[3]。因此寻找干预钙蛋白酶、提升细胞膜抗损伤能力的策略尤为重要。大量研究证实,有氧运动预处理产生心肌保护作用,可拮抗细胞内钙稳态紊乱,减轻自由基损伤,降低炎症反应程度,改善microRNA水平等[4-5]。本研究以游泳运动为干预模式,探讨有氧运动预处理对缺血-再灌注心肌细胞膜通透性的影响,以及钙蛋白酶在此过程中的作用。
1 材料与方法
1.1 材料
雄性Sprague-Dawley大鼠由空军军医大学实验动物中心提供。动物饲养温度控制在20~25 ℃之间,12 h白天/12 h黑夜循环环境喂养,自由进食与饮水,保持良好的通风与湿度条件。所有动物实验均经空军军医大学动物伦理委员会批准(许可证号:IACUC-20200850)。
1.2 方法
1.2.1 实验方案 大鼠(200~250 g,6周龄)适应性喂养1周后,随机分为对照组(30只)和运动预处理组(10只)。运动预处理组大鼠首先进行1周的无负重适应性运动,第1~2日每日游泳30 min,第3~4日每日游泳60 min,第5日开始每日游泳90 min。第3周后进行为期8周运动干预,每日固定进行90 min的游泳运动干预,每周运动5 d(周一至周五)。运动预处理结束后,休息2 d,然后施行心肌缺血-再灌注实验[6]。游泳器具为圆形游泳池,内壁光滑,直径60 cm,水深45~50 cm,水浴温度33~37 ℃。对照组大鼠按常规进行喂养,不加运动干预。
1.2.2 心肌缺血-再灌注损伤 腹腔注射30 g/L戊巴比妥钠(30 mg/kg)麻醉大鼠,并将其固定于恒温手术台上,标准Ⅱ导联记录心电图(成都仪器厂,中国)。颈正中剪开皮肤,止血钳钝性分离,暴露气管,行气管插管,并连接呼吸机(成都泰盟公司,中国),潮气量8 mL,频率为80次/min,吸呼时比2∶1,进行机械通气。之后,胸骨左侧做一切口,第3与4肋间打开胸腔,眼科镊划开心包膜,于左心耳距主动脉根部约2 mm处,用带线缝合针(5-0)穿过约2 mm宽的心肌束(包含冠状动脉左前降支),将缝合线穿过一硅胶管,并利用止血钳将缝合线结扎于硅胶管,造成局部缺血,40 min后松开结扎线,抽出硅胶管,恢复冠状动脉灌注2 h。实验中,采用随机原则再次将对照组大鼠分为假手术组、缺血-再灌注组和MDL28170干预组,每组8只。假手术组只开胸、穿线,但不结扎[7]。MDL28170是钙蛋白酶的常用抑制剂,于缺血前5 min以3 mg/kg的剂量经尾静脉给药。
1.2.3 动脉血压测量与心功能评定 分离右侧颈总动脉,剪口并插入PE-50管,连接压力换能器,RM6240软件采集血压曲线(成都仪器厂,中国)并计算平均动脉压。之后,继续向前推送PE-50管,通过主动脉瓣进入左心室,描记心室内压力。通过软件分析得到左心室收缩压峰值和左心室最大收缩与舒张速率,以此反映左心室功能[7]。
1.2.4 免疫荧光染色 实验结束后,剪取结扎区周边组织,常规方法固定与包埋,制备厚度为4 μm的切片,脱蜡并复水,抗原修复,用含0.5 mL/L Triton X-100的PBS对组织进行破膜处理15 min,50 mL/L驴血清室温封闭1 h,分别滴加钙蛋白酶(1∶150,CST)、抗肌萎缩蛋白(1∶200,Abcam,美国)抗体50 μL,4 ℃冰箱孵育过夜,滴加荧光二抗(1∶400)50 μL,室温孵育2 h,DAPI复染细胞核15 min。实验流程中,每次于下一步骤前,用PBS洗3次,每次5 min。最后,500 mL/L甘油封片,激光共聚焦显微镜(FV10-ASW,日本)镜下观察,Olympus FV1000软件采集图像[3,8]。每张切片于600倍下采集5个视野,采用Image J软件进行统计学分析。
1.2.5 心肌细胞膜通透性检测 大鼠麻醉后于尾静脉注射含10 g/L伊文思蓝的生理盐水1 mL,再灌注结束后剪取缺血区周边组织,液氮速冻组织10~20 s,将组织块平放于涂有OCT包埋胶的样品托上5~10 min,OCT胶浸透组织后置入恒冷箱切片机冰冻切片。丙酮液固定切片15 min,PBS洗3次,每次5 min,500 mL/L甘油封片。双盲法于激光共聚焦显微镜下采集图像、评分。以红色阳性区/总视野区的面积百分比反映膜通透性的状态[9]。
1.2.6 Western blotting检测 制备总蛋白时,称取组织100 mg,按1∶5比例加入裂解液并匀浆,裂解液的成分为:Tris HCl 50 mmol/L(pH=7.4),NaCl 150 mmol/L,乙二胺四乙酸5 mmol/L,二硫苏糖醇1 mmol/L,脱氧胆酸钠10 mmol/L,Triton X-100 10 mL/L,苯甲基磺酰氟1 mmol/L,抑肽酶5 mg/L,亮胰酶肽5 mg/L。12 000 r/min离心30 min,收集上清,分装冻存。制备膜蛋白时,称取100 mg组织,按1∶5比例加入裂解液,剪碎组织,于玻璃匀浆器中匀浆,裂解液成分为:Tris HCl 50 mmol/L(pH=7.4),蔗糖250 mmol/L,乙二胺四乙酸1 mmol/L,二硫苏糖醇1 mmol/L,苯甲基磺酰氟1 mmol/L,抑肽酶5 mg/L,亮胰酶肽5 mg/L。1 000 r/min离心10 min,取上清转移到新的EP管中,12 000 r/min离心30 min,吸弃上清,沉淀中加生理盐水、振荡,再次12 000 r/min离心30 min。纯化的沉淀物中加入含10 mL/L Triton X-100并超声裂解,12 000 r/min离心30 min,收集上清冻存。BCA法进行蛋白浓度测定,聚丙烯酰胺凝胶电泳、转膜,50 g/L脱脂奶粉封闭1 h,calpain1、α-胞衬蛋白(Enzo,美国)、GAPDH、NHE(Abcam,美国)抗体孵育过夜(4 ℃),抗体滴度为1∶1 000,二抗常温孵育2 h,化学发光法显影,ChemiScope 6100化学发光成像系统(上海勤翔科学仪器有限公司,中国)获得目的蛋白印迹图像。使用Image-pro Plus 6.0软件测量荧光强度[3,8]。
1.2.7 统计学分析 实验数值以¯x±s表示,利用GraphPad Prism 5.0进行统计学分析与作图。多组间比较采用单因素方差分析(one-way ANOVA),若方差齐性,则用Turkey检验法进行两组间比较,以P<0.05表示数据具有统计学差异。
2 结果
2.1 游泳运动预处理改善缺血再灌注后大鼠心功能
血流动力学和心功能结果显示:与假手术组相比,缺血-再灌注组左心室收缩压峰值、左心室最大收缩速率和最大舒张速率显著降低,平均动脉压明显下降(图1~2)。MDL28170是钙蛋白酶的抑制剂,给予MDL28170后,上述指标明显改善(图1~2),表明缺血-再灌注激活钙蛋白酶,造成心肌损伤。尤为重要的是,游泳运动预处理后,心功能和动脉血压明显好转,表现为左心室收缩压峰值、左心室最大收缩速率、左心室最大舒张速率显著降低以及平均动脉压均回升(图1~2)。以上提示,运动预处理减弱钙蛋白酶活性,减轻缺血-再灌注心肌损伤。
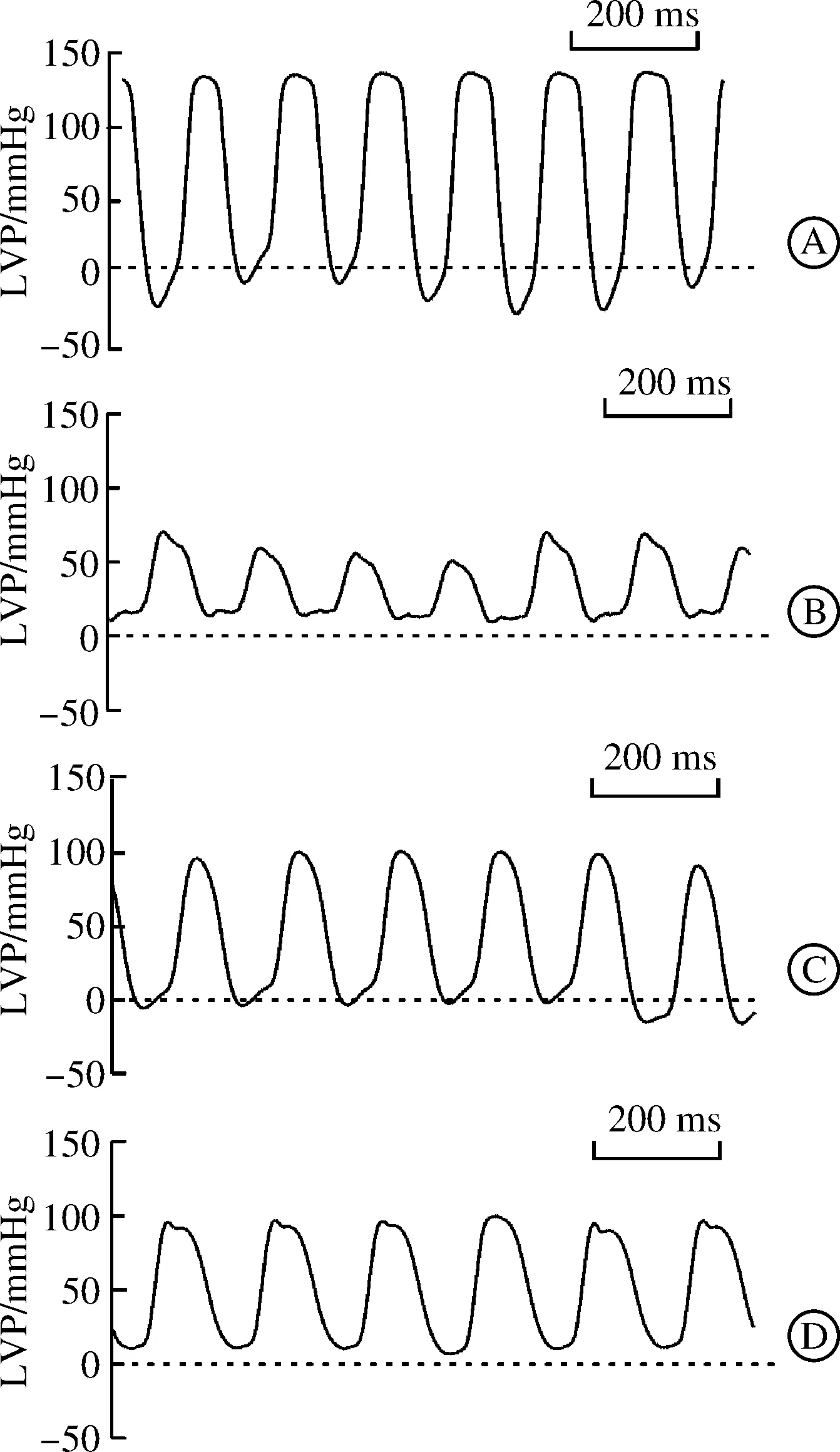
A:假手术组;B:缺血-再灌注组;C:MDL28170处理组;D:运动预处理组。LVP:左心室内压力。图1 大鼠左心室内压力曲线

Sham:假手术组;IR:缺血-再灌注组;M+IR:MDL28170处理组;E+IR:运动预处理组。LVSPmax:左心室收缩压峰值;+dp/dtmax:左心室最大收缩速率;-dp/dtmax:左心室最大舒张速率;MAP:平均动脉压。实验数值以¯呈现,n=8。采用单因素方差分析和Turkey检验法进行组间比较, aP<0.05 vs IR组, bP<0.01 vs Sham组。图2 大鼠心功能与动脉血压的统计结果
2.2 游泳运动预处理减弱缺血再灌注心肌钙蛋白酶活性
再灌注5 min剪取心肌组织,免疫荧光实验结果可见,与假手术组相比,缺血-再灌注显著增加细胞膜上钙蛋白酶催化亚基calpain1的含量(图3~4)的同时,并未明显增加总钙蛋白酶表达水平(图4)。膜骨架分子α-胞衬蛋白是钙蛋白酶的水解底物,可被特异性分解为Mr 150 000水解片段,结果可见,缺血-再灌注增加α-胞衬蛋白的水解(图4),表明钙蛋白酶引发缺血-再灌注心肌损伤,且细胞膜或是钙蛋白酶的损伤位点。实验中还检测到,无论是给予钙蛋白酶抑制剂MDL28170,还是游泳运动预处理,均减少缺血-再灌注心肌细胞膜calpain1的含量以及α-胞衬蛋白的水解(图4),表明减弱钙蛋白酶活性是游泳运动预处理抗心肌缺血-再灌注损伤的重要机制。
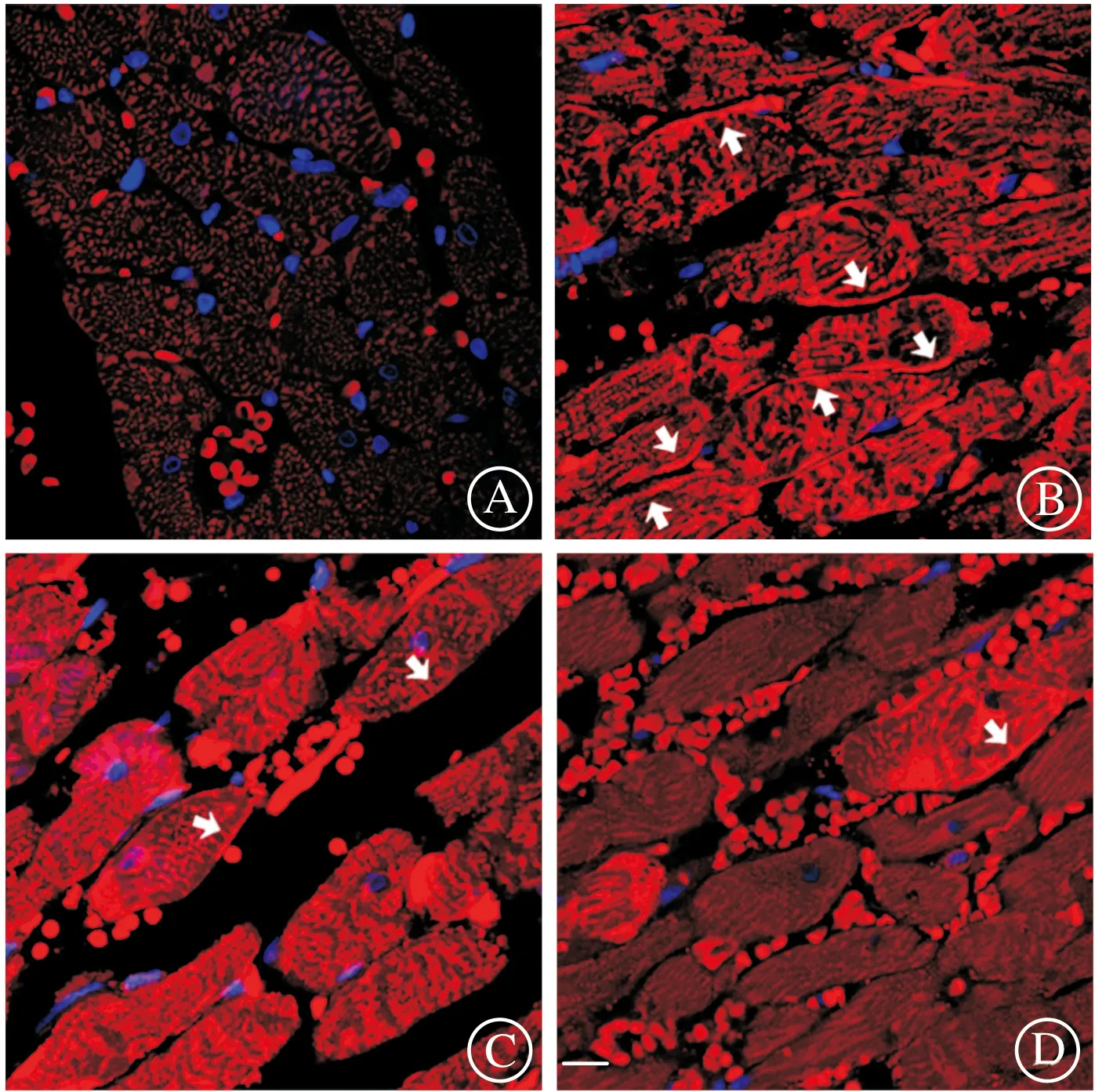
A:假手术组;B:缺血-再灌注组;C:MDL28170处理组;D:运动预处理组。箭头所示为calpain1阳性细胞。标尺为10 μm。图3 钙蛋白酶催化亚基calpain1的免疫荧光染色
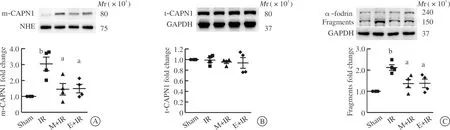
A:心肌细胞膜calpain1(m-CAPN1)的免疫印迹结果;B:细胞总calpain1(t-CAPN1)的免疫印迹结果;C:心肌α-胞衬蛋白(α-fodrin)的免疫印迹结果。NHE(钠-氢交换体)和GAPDH作为上样内参,以示蛋白上样量一致性。Sham:假手术组;IR:缺血-再灌注组;M+IR:MDL28170处理组;E+IR:运动预处理组。实验数值以¯呈现,n=4。采用单因素方差分析和Turkey检验法进行组间比较, aP<0.05 vs IR组, bP<0.01 vs Sham组。图4 钙蛋白酶活性检测
2.3 游泳运动预处理保护缺血再灌注心肌细胞膜
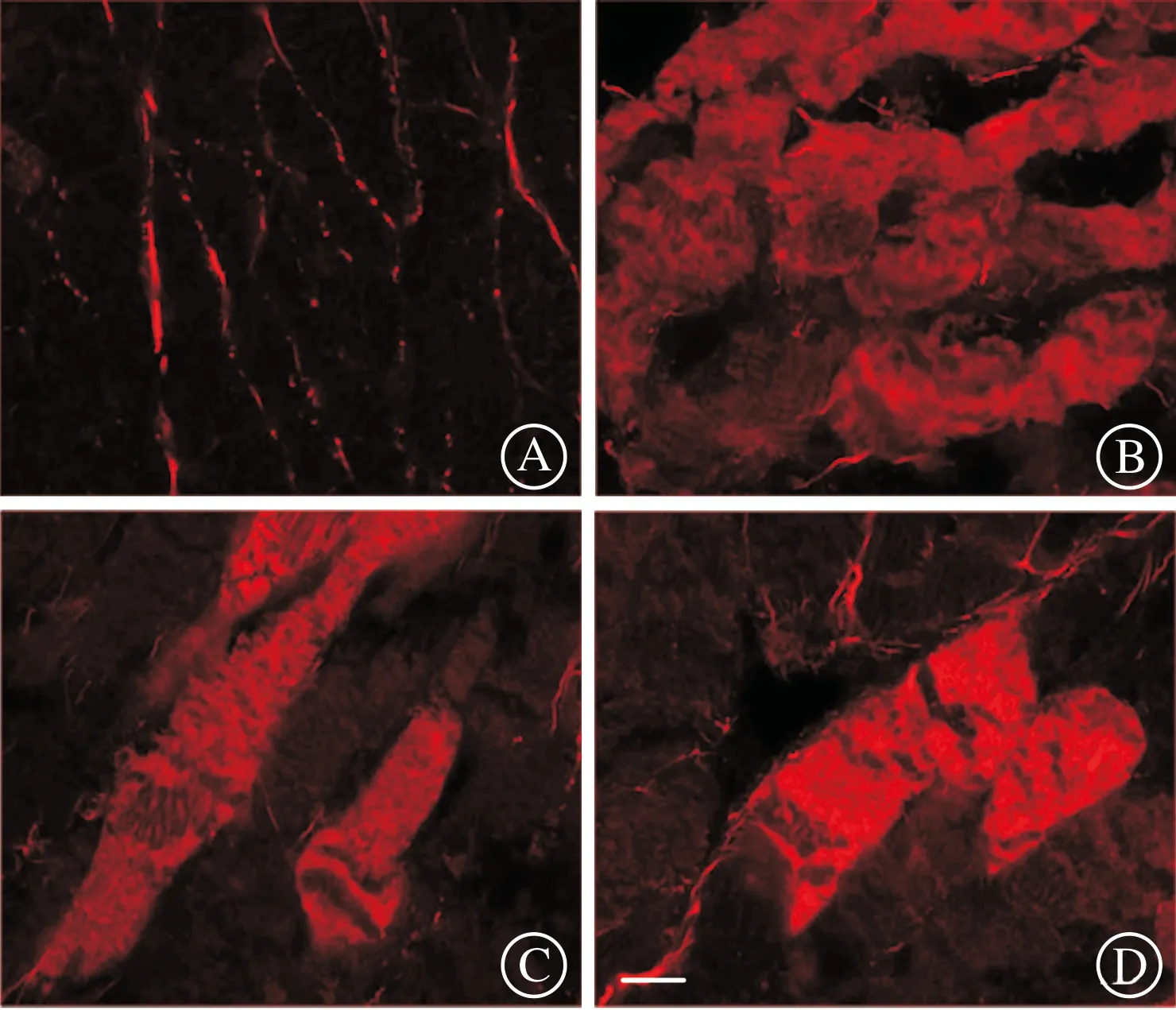
为明确钙蛋白酶对细胞膜通透性的影响,实验评价了不同组间心肌细胞的伊文思蓝蓄积程度。再灌注2 h剪取心肌组织,结果显示:与假手术组相比,缺血-再灌注组蓄积伊文思蓝的心肌细胞数量显著增加,MDL28170和游泳运动预处理均减少伊文思蓝的蓄积(图5~6)。实验还观察了再灌注2 h膜骨架分子肌萎缩蛋白的分布,可见缺血-再灌注组存在膜肌萎缩蛋白的丢失,MDL28170和游泳运动预处理则逆转这一损伤效应,心肌细胞膜表达肌萎缩蛋白趋于完整、清晰(图7~8)。游泳运动预处理减弱钙蛋白酶对心肌细胞膜的破坏作用。
3 讨论
运动作为非药物干预手段的心肌保护作用已得到广泛证实。研究表明,运动预处理上调过氧化物酶体增殖物激活受体ϒ辅激活因子PGC-1α的表达,通过结合并激活过氧化物酶体增殖物激活受体α、雌激素相关受体和核受体因子,促进基因转录,加速线粒体能量代谢[10-11]。运动预处理下调CCAAT增强子结合蛋白β的表达,并伴随羧基末端富含Glu/Asp的转录辅助因子(与转录因子CBP/p300的相互作用)的高表达,同时还激活胰岛素样生长因子和神经调节素-PI3K-Akt1信号通路,促进生理性心肌肥大并产生抗凋亡作用[11-12]。近年来的研究表明,运动增加miR-17-3p、miR-222的表达,延缓缺血后病理性心肌重构[13-14]。游泳是一项常见的有氧运动方式,本实验观察到,游泳运动减少心肌细胞内伊文思蓝的蓄积以及细胞膜肌萎缩蛋白的丢失。结果表明,有氧运动预处理是改善细胞膜质量的有效举措。
A:假手术组;B:缺血-再灌注组;C:MDL28170处理组;D:运动预处理组。激光共聚焦显微镜下结果,红色区代表细胞伊文思蓝蓄积。标尺为20 μm。图5 心肌细胞内伊文思蓝蓄积的检测
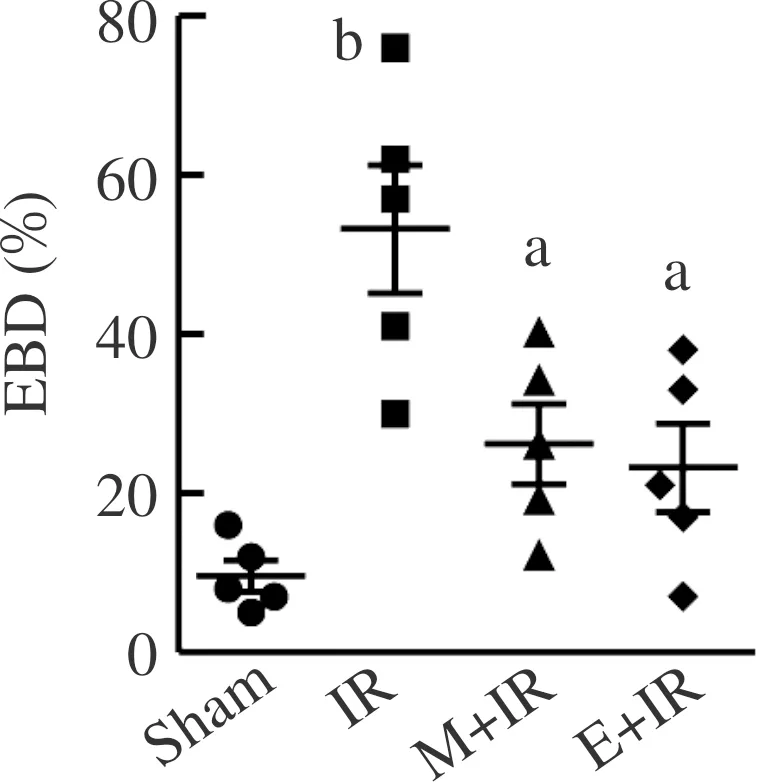
Sham:假手术组;IR:缺血-再灌注组;M+IR:MDL28170处理组;E+IR:运动预处理组;EBD:伊文思蓝染料的阳性面积。实验数值以¯呈现,n=5。采用单因素方差分析和Turkey检验法进行组间比较, aP<0.05 vs IR组, bP<0.01 vs Sham组。图6 各组伊文思蓝染料的阳性面积百分比
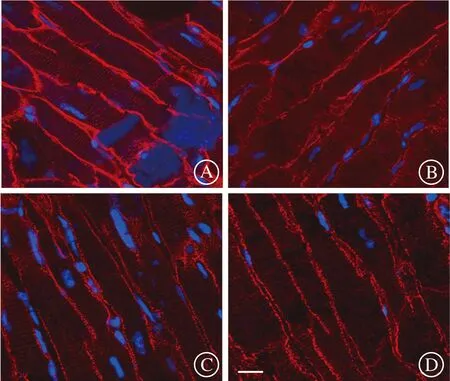
A:假手术组;B:缺血-再灌注组;C:MDL28170处理组;D:运动预处理组。标尺为10 μm。图7 心肌细胞肌萎缩蛋白免疫荧光染色
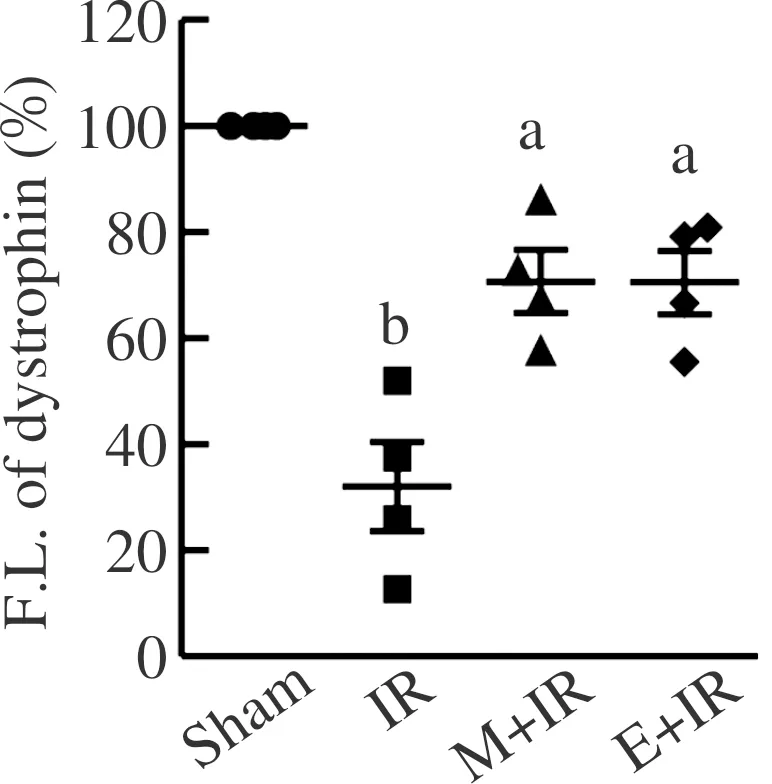
Sham:假手术组;IR:缺血-再灌注组;M+IR:MDL28170处理组;E+IR:运动预处理组;F.L. of dystrophin:膜肌萎缩蛋白荧光强度。实验数值以¯呈现,n=4。采用单因素方差分析和Turkey检验法进行组间比较, aP<0.05 vs IR组, bP<0.01 vs Sham组。图8 膜肌萎缩蛋白荧光强度的统计结果
钙蛋白酶是一类钙依赖的非溶酶体类半胱氨酸蛋白酶家族分子。心肌钙蛋白酶主要由催化亚基calpain1和小调节亚基构成。尽管钙蛋白酶的生理学作用不甚清楚,但过度活化的钙蛋白酶可水解Bid、AIF等线粒体凋亡相关分子,诱导细胞凋亡[15]。钙蛋白酶水解titin、desmin、cTnT、cTnI等肌纤维蛋白,造成收缩功能障碍[16]。α-胞衬蛋白是钙蛋白酶的特异性底物,实验中检测到,缺血-再灌注增加Mr 150 000的水解片段,表明钙蛋白酶过度活化引发心肌损伤。实验观察到,缺血-再灌注增加胞膜钙蛋白酶含量,而游泳运动拮抗这一现象。又由于缺血-再灌注并未增加总的钙蛋白酶水平,我们认为,运动预处理的膜保护作用与抑制钙蛋白酶膜转位有关。不言而喻,寻找替代药物是研究运动预处理心肌保护机制的重要方向,我们前期研究表明,钙/钙调素依赖的蛋白激酶II促进钙蛋白酶的膜转运[8],运动预处理抑制钙蛋白酶的作用是否与钙/钙调素依赖的蛋白激酶II有关还有待深入探讨。钙蛋白酶不仅表达于心肌细胞,也见于中性粒细胞和单核-巨噬细胞等炎性细胞[17-18],免疫荧光结果还显示存在炎性细胞内钙蛋白酶的活化,提示这一现象或参与缺血-再灌注心肌损伤。
总之,我们的实验结果表明,运动预处理减轻缺血-再灌注心肌的细胞膜损伤,其作用与抑制钙蛋白酶活性有关。所获结果为探讨运动预处理的膜保护机制奠定了基础,为寻求心肌保护策略提供了新方向。
