安罗替尼一线治疗不耐受或拒绝化疗的驱动基因阴性的晚期NSCLC患者:一项多中心、前瞻性研究*
2022-08-02梁丹农先胜李彬宁瑞玲陆群英
梁丹,农先胜,李彬,宁瑞玲,陆群英
530001 南宁,广西壮族自治区民族医院/广西医科大学附属民族医院 肿瘤科(梁丹、农先胜、李彬);530021南宁,广西医科大学附属肿瘤医院 呼吸肿瘤内科(宁瑞玲);532500广西 崇左,广西壮族自治区崇左市宁明县人民医院 肿瘤科(陆群英)
恶性肿瘤已成为威胁我国居民身体健康的重大公共卫生问题。根据最新的流行病学数据,2015年全国新发恶性肿瘤392.9万例,死亡约233.8万例,其中肺癌位居我国恶性肿瘤发病首位,2015年新发肺癌病例约73.3万,其中男性约50.9万,60~74岁者23.2万,占45.6%,而75岁及以上者13.8万,占27.1%;女性约22.4万,60~74岁者9.1万,占40.6%,而75岁及以上者6.7万,占29.9%[1],提示肺癌患者中老年患者比例较高。根据国内指南,无论是初治人群或经治患者,化疗仍然是治疗的基石。但是驱动基因阴性的老年患者一般身体状态和器官功能下降,且多合并基础疾病,对化疗的耐受性较差[2-3],故而治疗手段仍然有限,单药化疗仍是老年患者首选治疗方案[4]。除此之外,仍然有部分患者抗拒使用细胞毒性药物,而主动选择放弃治疗或者去寻求“偏方”等治疗手段,给这些患者的生存和生活质量带来严重威胁。虽然国内免疫制剂的可及性大大加强,但不可忽视的毒副反应及高昂的医疗支出也限制了临床应用。因此,寻求一种有效、安全、便利的治疗药物来替代传统的化疗药物刻不容缓。
盐酸安罗替尼胶囊是我国拥有自主知识产权的多靶点小分子酪氨酸激酶抑制剂,主要靶向血管内皮生长因子受体(vascular epidemal growth factor receptor,VEGFR)/血小板衍生生长因子受体(platelet-derived growth factor receptor,PDGFR)/成纤维细胞生长因子(fibroblast growth factor,FGFR)和c-kit原癌基因 (c-kit proto-oncogene protein,C-Kit)等,通过抑制肿瘤血管新生和肿瘤细胞达到抗肿瘤作用。在一项由上海交通大学附属胸科医院的牵头的III期随机、双盲、注册临床研究中(ALTER0303)发现,安罗替尼能显著延长肺癌患者的PFS和OS,且不良反应均为轻度或中度且可控[5]。2018年5月国家食品药品监督管理局批准安罗替尼用晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)的三线及以上治疗的适应症。考虑到安罗替尼胶囊口服方便,疗效明确,毒副作用可耐受,临床已广泛应用,且目前不耐受化疗或拒绝化疗的晚期NSCLC患者治疗手段有限,本研究前瞻性地探索安罗替尼用于初始治疗不耐受化疗或拒绝化疗的晚期NSCLC人群的疗效和安全性,旨在为该人群提供更多的治疗选择。
1 资料及方法
1.1 一般方法
选取广西医科大学附属民族医院、广西医科大学附属肿瘤医院和崇左市宁明县人民医院三家中心2018年12月至2021年1月收治的晚期非小细胞肺癌患者,入选标准:年龄为18~85岁;未接受化疗、免疫检查点抑制剂或其他抗肿瘤治疗;患者的体能状态(performance status,PS)为 ECOG(Eastern Cooperative Oncology Group) 0~2分且拒绝细胞毒药物化疗者;ECOG 3~4分且不耐受细胞毒药物化疗者;经病理学确诊的IIIB (不适合放疗的)、IV期非小细胞肺癌;无EGFR、ALK、ROS1基因突变;至少存在1处按照实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST)1.1版本标准可测量的靶病灶[6]。排除标准:正在使用两种或两种以上降压药联合治疗但控制不理想的高血压(收缩压≥140 mmHg或舒张压≥90 mmHg)患者;每日咯血量达两茶匙或以上,或具有明确的出血倾向,如消化道出血、出血性胃溃疡、大便潜血++及以上;影像学(CT或MRI)显示肿瘤病灶距大血管≤5 mm、或存在侵入局部大血管的中心型肿瘤,或显示存在明显肺部空洞性或坏死性肿瘤;凝血功能异常国际标准化比值(international normalized ratio,INR)>1.5或凝血酶原时间(Prothrombin time,PT)>ULN+4秒或活化部分凝血活酶时间(activated partial thromboplastin time,APTT)>1.5 ULN,具有出血倾向或正在接受溶栓或抗凝治疗; 重度肝肾功能不全患者。研究经本院伦理委员会批准(审批号:桂民医伦审通字[2018]16号),所有入组患者签署知情同意书。
1.2 方法
对于未经过系统治疗且不耐受化疗或拒绝化疗的晚期非小细胞肺癌患者,无论是腺癌还是鳞癌,均采用安罗替尼单药进行治疗(生产厂家:正大天晴药业集团股份有限公司;批准文号:H20180004),每次12 mg,一日1次,清晨空腹服用,21天为1个周期,若不耐受可下调剂量(10/8 mg),直至出现不能耐受的不良反应或病情进展。
1.3 评估指标
根据RECIST 1.1版本对患者临床疾病控制疗效进行评定。完全缓解(complete remission,CR):所有已知病灶消失,无新病灶出现至少维持4周;部分缓解(partial remission,PR):患者所有可测量的病灶,其最大病灶单径总和缩小至30%,并无产生新病灶,且至少维持现状达4周以内;稳定疾病(stable remission,SD):病灶未达部分缓解或完全缓解、疾病进展标准,无新病灶出现至少维持6~8周;疾病进展(progressive disease,PD):病灶增大20%,出现新的病灶。客观有效率(objective response rate,ORR)=(完全缓解人数+部分缓解人数)/患者总人数,临床疾病控制率(disease control rate,DCR)=(完全缓解人数+部分缓解人数+疾病稳定人数)/患者总人数。无疾病进展生存期(progression free survival,PFS):在患者首次用药治疗开始,有证据客观证实患者疾病无进展之间的间隔。总生存期(overall survival,OS):患者首次用药到由于任何原因死亡时间。对患者在治疗后随访,分析患者主要毒副反应发生情况,观察患者有无产生皮疹、腹泻、出血反应等。
1.4 随访
仍在用药的患者均通过门诊或住院检查随访, 停止用药的患者则由训练有素的医生进行电话随访,每月1次,末次随访时间是2021年9月。
1.5 统计学方法
对至少服用1个周期研究药物的所有患者进行疗效和安全性评估。数据采用描述性统计分析。连续数据表示为平均值或中位数,四分位范围视情况而定。分类数据以数字和百分比表示。ORR和DCR用相应的双侧95%置信区间(cofidence interval,CI)计算。采用Kaplan-Meier法分析PFS和OS。所有数据分析均采用统计分析软件SPSS 25.0处理数据。以P<0.05为差异有统计学意义。
2 结 果
2.1 基线特征
三家中心2018年12月至2021年1月期间共入组27例符合标准的晚期非小细胞肺癌患者,其中男性19例,女性8例;年龄47~85岁,中位年龄63岁;19例患者为腺癌,8例患者为鳞癌及其他病理类型8例;16例患者有吸烟史;4例患者为IIIB期,23例患者为IVa/IVb期;PS评分3~4分者10例,1~2分者17例;拒绝化疗的患者11例(拒绝化疗的原因均为担心化疗相关毒性,经过主管医师解释化疗的利弊后仍无法取得患者的同意),不耐受化疗的患者16例(其中10例患者为体能状况PS评分3~4分,3例患者合并慢性阻塞性肺疾病肺功能不全,1例患者合并骨髓功能异常,1例患者合并获得性免疫缺陷综合征,1例患者合并精神分裂症),具体基线特征见表1。

表1 患者基线特征
所有患者均接受过至少1个周期的安罗替尼单药方案的治疗。安罗替尼起始剂量均为12 mg,其中8例因不良反应减量到10 mg,其中3例继续下调至8 mg。截止到随访日期,患者的中位用药时间为5周期(范围:1~36周期),最长服用时间为36周期。在PS=3/4分的人群中,平均用药周期数为5周期,最长的服用周期为18周期,使用周期中位数为3周期(范围:1~18周期)(图1)。
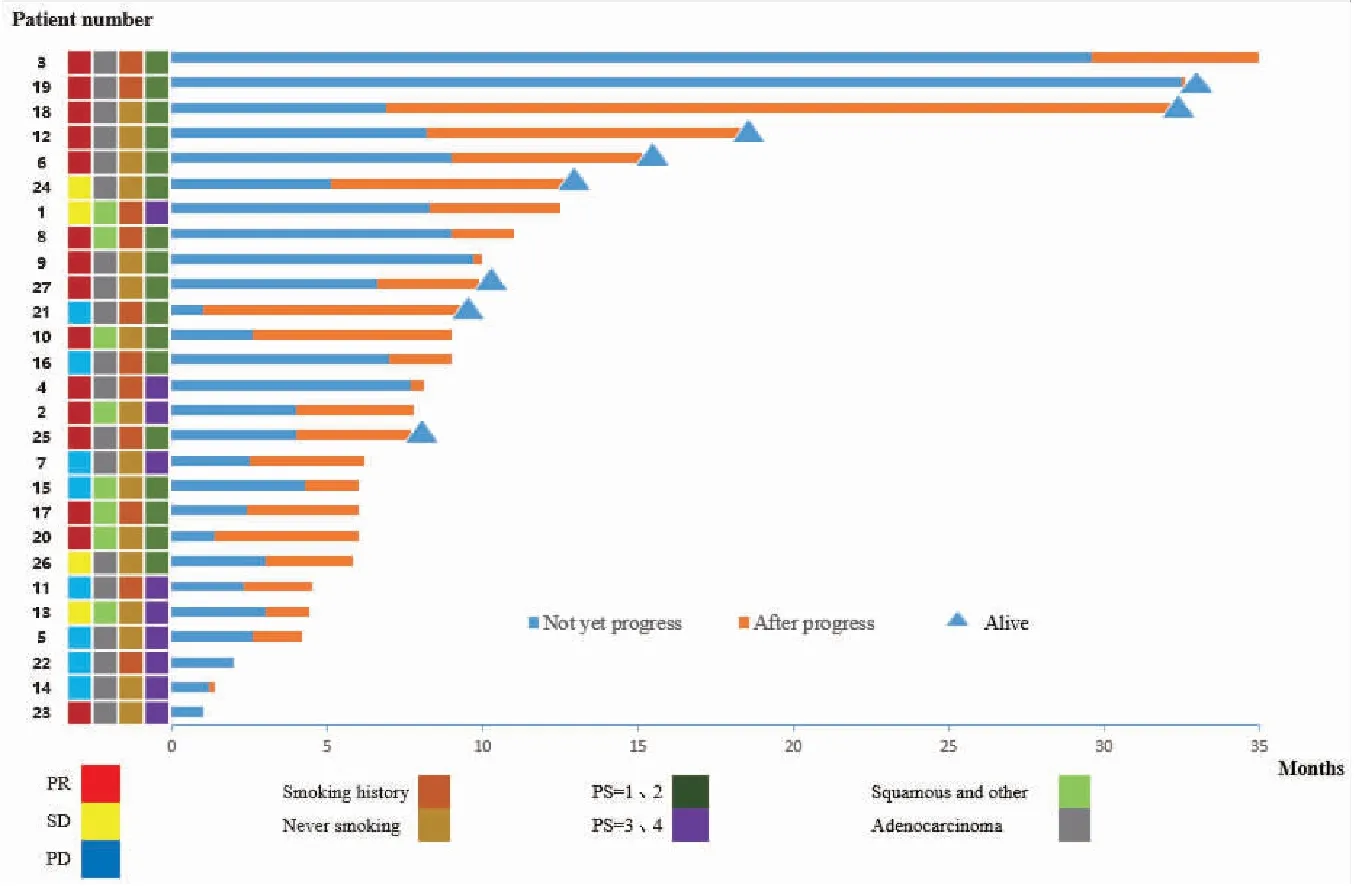
图1 整体人群的泳道图
2.2 疗效分析
所有患者在随访期间均出现了PD,其中15例患者曾达到了PR,4例患者曾达到了SD,总体ORR为56%, DCR为70%(表2)。

表2 患者疗效结果
随访截止时,8例患者仍存活。整体人群中位PFS为4.0个月(范围:1.8~6.2个月),中位OS为9.0个月(范围:7.0~10.9个月)。与鳞癌及其他病理类型的患者相比,腺癌患者的中位PFS较短(4.00个月vs4.15个月,P=0.729),中位OS较长(10.00个月vs6.90个月,P=0.120),差异均无统计学意义;与PS为3/4分的患者相比,PS为1/2分的患者中位PFS(6.60个月vs2.55个月,P=0.026)和中位OS(11.00个月vs4.50个月,P<0.001)均显著更长,差异有统计学意义;与有吸烟史的患者,无吸烟史的患者中位PFS较长(4.15个月vs4.00个月,P=0.298),中位OS较短(7.0个月vs11.0个月,P=0.600),差异均无统计学意义(图2、3)。

图2 无进展生存期分析

图3 生存期分析
2.3 安全性分析
总体不良反应的发生率为93%,最常见的不良反应为手足皮肤毒性(52%)、乏力(26%)和高血压(22%),多为1~2级,其中3级及以上不良反应为手足综合征(26%)、口腔溃疡(7%)和高血压(4%),未见其他非预期的不良反应(表3)。

表3 安罗替尼相关的不良反应
3 讨 论
在临床实践中,不耐受化疗或者拒绝化疗的人群通常为老年人,但本研究入组的人群中含主观拒绝化疗的患者及因骨髓异常、免疫缺陷、精神异常而无法耐受化疗的患者,该部分患者相对较为年轻,整体中位年龄仅有63岁。2017年,美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)报道了两项针对老年NSCLC患者(≥70岁)的III期研究MILES3和MILES4,患者分为单药组(吉西他滨或培美曲塞)和双药组(顺铂联合吉西他滨或培美曲塞),结果显示mOS分别为7.5个月和9.6个月(P=0.136),mPFS分别为3.0个月和4.6个月(P=0.005),ORR分别为8.5%和15.5%,DCR分别为32.7%和40.3%,且双药组不良事件发生率明显高于单药组,提示双药化疗延长无进展生存期,但并不延长总生存期,且增加治疗毒性反应[7]。因此,对于老年晚期NSCLC患者,单药治疗是值得考虑的备选方案。另外,虽然近年来免疫治疗改变了肺癌的治疗格局,但考虑到老年患者存在器官衰老与免疫系统功能下降,免疫治疗的益处可能较小[8]。有研究对多个PD-1/PD-L1药物研究的老年亚组进行汇总分析[9-10],发现无论是免疫单药还是联合化疗方案,均未能证明免疫检查抑制剂比单纯化疗更有效。因此,有必要进一步探讨老年NSCLC患者中单药治疗的疗效与安全性。
本研究材料安罗替尼单药治疗不耐受或拒绝细胞毒药物的晚期NSCLC患者, 总体ORR为56%, DCR为70%。亚组分析发现,在鳞癌及其他病理类型的患者中安罗替尼单药疗效稍好,ORR为62.5%,DCR为78.5%;PS 1/2分的患者的中位OS和中位PFS均优于PS 3/4分的患者,提示PS评分较好的患者接受安罗替尼单药治疗的疗效更好,但PS 3/4分的患者中,ORR仍可达33%,DCR达50%,提示PS较差的患者或许仍能从安罗替尼单药治疗中获益。安罗替尼不仅具有多靶点的抗血管生成作用[11],还可以抑制多种肿瘤驱动基因,例如c-Kit、c-MET等[12],抑制肿瘤增殖和迁移,从而具有短期缩瘤效果。对于整体人群,安罗替尼单药治疗的中位PFS为4.0个月,中位OS为9.0个月,与MILES3和MILES4报道的化疗方案[7]生存获益相似。从病理分型、吸烟状态和PS评分进行亚组分析,仅PS评分亚组达到了统计学差异。对于PS评分为1/2的人群,主要因拒绝化疗入组,其中位PFS为6.60个月,中位OS为11.0个月,与常规一线含铂双药化疗方案[13-14]获益相似,但劣于免疫联合化疗的生存获益[15]。对于PS评分3/4的患者,首选的治疗方式为支持治疗,本研究中经安罗替尼单药治疗后,中位PFS达到2.55个月,中位OS达到4.5个月,同样带来了生存获益。
安全性是不耐受化疗的患者方案选择时重要的考量因素。本研究中,安罗替尼起始剂量为12 mg,中位用药周期为5周期(范围:1~36周期),最长的服用周期为36周期。在PS 3/4分的10位患者中,用药周期中位数为3周期(范围:1~18周期),最长的用药周期为18周期。整体人群最常见的不良反应为手足皮肤毒性、乏力和高血压,多为1~2级,对于PS评分为3/4的10例患者,并未出现非预期的不良反应,整体安全可控。ALTER0303亚组分析[16]表明高血压或手足综合症与良好的临床预后有关,可通过预防措施、剂量调整及早期干预进行管理,坚持用药可能会实现患者疗效获益的最大化。研究中有8例患者因不良反应降低了剂量(10 mg),而中位PFS仍达到了8.0个月(范围:3~32.5个月),其中3例再次降到了8 mg,PFS分别为8.3个月、29.6个月、32.5个月,提示在条件许可范围内坚持用药或可带来进一步的生存获益。
综上,安罗替尼单药一线治疗不耐受或拒绝细胞毒药物驱动基因阴性的晚期NSCLC患者,有较好的临床疗效,整体人群的中位PFS为4.0个月,中位OS为9.0个月,ORR为56%,DCR为70%,最常见的不良反应为手足皮肤毒性(52%)、乏力(26%)和高血压(22%),多为1~2级,不良反应可耐受;PS评分较好的患者或许更能从安罗替尼单药治疗中获益。无论是拒绝化疗还是不耐受化疗,安罗替尼单药均可作为候选的治疗方案,但对于拒绝化疗的患者应该积极引导,在身体条件允许的情况下接受最适合的治疗方案。由于本研究样本量较少且非随机对照,有待临床进一步验证,以明确安罗替尼在不耐受化疗或拒绝化疗晚期NSCLC患者中的一线应用。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
