石松生物碱化学成分和生物活性研究进展
2022-08-02郑东昆谢新华
谢 振,郑东昆,王 强,谢新华,刘 阳*
石松生物碱化学成分和生物活性研究进展
谢 振1,郑东昆2#,王 强2,谢新华1,刘 阳1*
1. 赣南医学院心脑血管疾病防治教育部重点实验室,江西 赣州 341000 2. 赣南医学院药学院,江西 赣州 341000
石松生物碱是指从石松科(Lycopodiaceae)、石杉科(Huperziaceae)及其近缘亲属植物中分离得到的一类具有生源相同、结构相似且骨架丰富多样的生物碱。目前已有600余个石松生物碱被报道,其根据化学结构特征可划分为4大基本骨架类型,分别为lycopodine、lycodine、fawcettidane和miseelaneous型。miseelaneous型骨架多变,主要以phlegmarine型为主,也有少量cernuane型。部分此类化合物在胆碱酯酶抑制、神经保护和细胞毒等方面表现出良好的活性。对2015年8月—2022年1月报道的161个石松生物碱的化学结构、植物来源和生物活性进行总结,以期为该类成分的后续研究提供参考。
石松科;石杉科;石松生物碱;胆碱酯酶抑制活性;神经保护作用;细胞毒活性
石松生物碱(alkaloids,LAs)指从石松科(Lycopodiaceae)、石杉科(Huperziaceae)及其近缘亲属植物中分离得到的一类具有生源相同、结构相似且骨架丰富多样的生物碱,其基本骨架结构一般由16个碳原子的吡啶环或吡啶酮环构成,少量由22、27个碳原子或低于16个碳原子组成的新颖骨架结构。LAs因其丰富多样的化学结构和潜在的生物活性一直备受各国科学家的关注,其首次报道可追溯至19世纪末期,Karl[1]从扁枝石松L.中分离出第1个LAs,即lycopodine。1967年,Dugas等[2]对(±)-12--lycopodine进行化学合成,得到首个人工合成的LAs。随后,科学家通过同位素标记方法研究了LAs的生物合成途径[3-6]。随着研究技术的发展,大量结构新颖的LAs被陆续报道。其中,最令人兴奋的是明星分子石杉碱甲的发现。石杉碱甲首次由中国科学家从民间药用植物蛇足石杉(Thunb. ex Murray) Trev.中分离得到[7],由于其表现出强效、可逆的乙酰胆碱酯酶(acetylcholin esterase,AChE)抑制活性,石杉碱甲被美国食品药品监督管理局批准为改善记忆力的膳食补充剂,国内已用于重症肌无力和中轻度阿尔茨海默症(Alzheimer’s disease,AD)患者的临床治疗,是目前公认最有前景的AD治疗药物。石杉碱甲的发现无疑是生物碱研究历史上的里程碑,极大地激发了各国科学家从药用植物中寻找高活性LAs的热情。为了寻找结构新颖且活性更强的LAs,国内外学者正在对石松科和石杉科及其近缘亲属植物进行深入系统地研究,这也使LAs成为了科学界经久不衰的研究热点之一。
目前已有600余种LAs被报道,其中加拿大科学家Aver等[8]综述了1993年1月以前报道的120个LAs,Ma等[9]综述了2004年8月前报道的83个LAs,陈业高等[10]综述了2010年6月前报道的84个LAs,王义坤等[11]综述了2015年8月前报道的88个LAs。本文在回顾前人总结的基础上,对2015年8月—2022年1月所报道的161个LAs进行总结,综述其化学结构和生物活性研究现状,以期为LAs的后续深入研究提供参考。
1 植物来源
石松科植物已被鉴定为史前蕨类植物的残留物,其早期化石可追溯至5亿年前的寒武纪。石松科植物可分为3个亚科,共16属,388种,为温带和亚热带气候特有植物,大量存在于针叶林、山区和沼泽地[12]。在我国有6属,分别为石松属L.、藤石松属Holub ex Dixit、扁枝石松属Holub、垂穗石松属Franca et Vase. ex Vasc. et Franco、小石松属Holub和拟小石松属Holub,共14种[13]。《中国药典》2020年版收录1种石松(伸筋草)Thunb. ex Murray,民间药用植物包括藤石松(舒筋草)(Spring) Holub ex Dixit、垂穗石松(灯笼草)(L.) Vasc. et Franco、扁枝石松(过山龙)、玉柏石松(玉柏)L.和多穗石松L.等共8种[14]。石杉科植物分为2属,约350种,分布极为广泛。其中,石杉属Holub植物约100种,我国现知25种1变种。马尾杉属Holub植物全球约250种,我国现知21种[12]。石松目植物治疗范围大致相同,主要用于驱风活络、镇痛消肿、跌打损伤的治疗,这可能与它们之间存在相同类型的活性成分有关。
2 化学成分
LAs是一类骨架结构多变的氮杂环类化合物,该类生物碱基本骨架一般由C16N或C16N2构成(三元环或四元环)。其基本骨架含有较多手性中心,且容易产生裂环、闭环、水解、氧化、聚合等复杂反应,LAs也出现少量C11N、C15N、C15N2、C17N、C19N、C22N2、C27N3、C34N4、C38N4等骨架。1994年,加拿大科学家Aver等[8]将报道的120个LAs根据化学结构特征划分为4种类型:lycopodine、lycodine、fawcettidane和miseelaneous型,该分类方法沿用至今。其中,miseelaneous型骨架多变,主要以phlegmarine型为主,也有少量cernuane型。这4种类型的代表化合物分别为lycopodine、lycodine、fawcettimine和phlegmarine,具体化学结构见图1。由于LAs化学结构奇特多变,因此出现新颖化合物的种类较多。2015年8月—2022年1月石松科和石杉科及其近缘亲属植物化学成分研究中发现新颖LAs共161个,其中新骨架14个,lycopodine型40个,lycodine型64个,fawcettidane型28个和miseelaneous型15个。

图1 LAs的4种主要结构类型
Fig. 1 Four major structural types of LAs
2.1 新骨架LAs
LAs骨架结构丰富多样,除上述4种类型外,也出现新奇骨架的生物碱。2015年至今发现新LAs共161个,其中新骨架LAs 14个,其结构基本都是通过核磁共振、质谱、圆二色谱法、计算化学和X射线单晶衍射等技术确定。
2016年,椭圆马尾杉(Baker) Ching中分离出2个具有罕见C19N骨架的的5/5/6/6的四环稠合LAs,1--malycorin A(1)和1--17-hydroxymalycorin A(2)均由1个含有1,2-丙二醇结构单元的serratiine骨架组成[15]。金丝条马尾杉(Herter) Ching中分离得到另一种新颖的6/7/6/6四环LAs phlefargesiine A(3),为首次报道的C-4与C-14连接成七元环(B环)LAs[16]。除上述报道的四环LAs外,从石松科和石杉科植物中还鉴定出五环或七环稠合的新奇骨架LAs。如玉柏石松中分离得到的obscurumine H(4)和obscurumine I(5),是通过C-9和N-2′通过相连形成一个嘧啶环的6/5/5/6/6五环稠合的生物碱[17]。东北石松L.中分离得到的lycoclavatumide(6)为首个C-4和C-7相连的新颖骨架LAs,该结构可能由fawcettimine环化和重排所得[18]。杉形马尾杉(Hayata) Ching中分离得到罕见的具有C38N4结构的七环生物碱hupercumine A(7),该生物碱由2个八氢喹啉、1个十氢喹啉和1个哌啶通过亚甲基单元相互连接组成[19]。粗糙马尾杉(Forst.) L. Love et D. Love中分离得到首个具有6/5/7三环螺环系统的LAs squarrosinoxide(8)[20]。马尾杉(L.) Holub中分离得到的phlegmadine A(9)为一种具有独特环丁烷环和复杂的四环[4.2.2.03,8.03,10]癸烷桥系统的LAs,是在新骨架lobscurinol的基础上进行分子内[2+2]光环化反应的产物[21]。phlegmadine B(10)和phlegmadine C(11)则是从马尾杉中分离得到2个首次报道的6/5/5/5/7五环稠合的C16N2型LAs,可能由lobscurunol或epilobscurinol氧化并引入亚氨基后C-9和C-13之间发生环化反应所得[22]。蛇足石杉中首次报道了2种具有新奇的氮杂二环十六烷骨架结构和肟官能团的LAs,命名为huperserratine A(12)和huperserratine B(13)[23]。近年,扁枝石松中还分离出一种seco-complanadine A类型的二聚体生物碱complanadine F(14),由一分子lycodine和一分子芳香化的phlegmarane骨架经C-1和C-2′相连组成[24]。新骨架LAs的化学结构见图2,相关信息见表1。
2.2 lycopodine型LAs
lycopodine型是发现最早的一类LAs,以C-4与C-13相连且含6/6/6/6/四环稠的喹诺里嗪环为基本骨架,其结构变化主要发生在C-5、C-6、C-8、C-10、C-11、C-12及D环上。2015年8月至今共发现40个新颖lycopodine型LAs。化合物(15~18、23、24、31)分别是从石松、扁枝石松、玉柏石松、垂穗石松和龙骨马尾杉(Desv.) Ching中分离得到的一类C环上氮原子被氧化的lycopodine型生物碱[25-30]。palhicerine F(25)为垂穗石松中分离得到的A环为罕见的船式构型LAs[29]。lycopocarinamines A~C(26~28)均为C-5位上的羟基与苯丙酸酯化后的产物[30]。多穗石松中分离出annotinolide F(32)和lycoannotines A~C(33~35),其中annotinolide F为C-8位上羧基与C-5位上羟基形成内酯环后的lycopodine型LAs,而lycoannotines A~C为D环断裂后的lycopodine型LAs[31]。12--lycopodine(39)[32]、acetyllycophlegmarianol(42)[20]和phlenumdine D(44)[33]为一类罕见的哌啶环(C环)为椅式构型的lycopodine型LAs。2020年,粗糙马尾杉中分离得到8个新lycopodine型LAs,lycosquarrines A~H(47~54)。其中,lycosquarrine A(47)为首次报道从天然产物中鉴定出H-4具有β取向的lycopodine型LAs,lycosquarrine D(50)和lycosquarrine E(51)分别为5,12-环氧和5,11-环氧LAs的首例,其生物合成关键步骤为环氧化物的开环环化反应[34]。lycopodine型LAs化合物的化学结构见图3,相关信息见表2。

图2 新骨架LAs的化学结构

表1 新骨架LAs

图3 lycopodine型生物碱的化学结构

表2 lycopodine型LAs
2.3 lycodine型LAs
lycodine型LAs一般由4个六元环构成,骨架与lycopodine型相似,其A环裂环后只与B环稠合重排成吡啶环或吡啶酮环。此外,C环也可以通过裂环成开环的lycodine型生物碱。2015年8月以来共发现64个新的lycodine型LAs。藤石松中分离出44个,占比达到68%,是新颖lycodine型LAs的主要植物来源。藤石松中分离出的新lycodine型LAs包括lycocasuarine A(56)、lycocasuarine B(57)、lycocasuarinine C(67)、casuarinosides A~H(74~81)等。其中,lycocasuarine A(56)为首次报道的六元环(C环)上C-8与C-15解离后C-7与C-15相连接并重排成五元环(C环)的lycodine型LAs。lycocasuarine B(57)是首个被发现具有额外的碳(C-17)与C-8直接结合的lycodine型LAs,从生物遗传学的观点来看并不寻常[37]。lycocasuarinine C(67)为首个C环裂环,且C-13位连接不含氮原子的lycodine型LAs[38]。casuarinosides A~H(74~81)为8个罕见的lycodine型生物碱苷[39]。此外,马尾杉属也是lycodine型LAs的重要来源,如粗糙马尾杉中分离出lycosquarrines I~O(112~118)[34]。lycodine型Las的化学结构见图4,相关信息见表3。
2.4 fawcettimine型LAs
fawcettimine型LAs与lycopodine型生物碱结构颇为相似,不同之处在于fawcettimine型为C-4与C-12键相连接,lycopodine型为C-4与C-12键断裂后再与C-13键相连接。从生物合成途径上可看成fawcettimine型为lycopodine型氧化和骨架重排后的产物。fawcettimine型又可分为醇-胺型和酮-胺型2类。醇-胺型为C-13被氧化后连羟基。酮-胺型为C-13-N之间断裂后,C-13上的羟基转变成酮羰基。2015年8月—2022年1月共报道了28种fawcettimine型LAs。obscurumine N(123)[17]和palhicerines A~C(124~126)[29]为罕见的C/D环反式稠合的fawcettimine型LAs。lycoannotine I(128)为自然界中首次报道C-9-N键发生裂解的fwcettimine型LAs[31]。2022年,从石松中鉴定出japonisine A(144),为1种C-6处连接1个2-氧代丙基的LAs,该结构在fawcettimine型生物碱中极为罕见,可能由lycoflexine衍生而来[49]。fawcettimine型LAs的化学结构见图5,相关信息见表4。
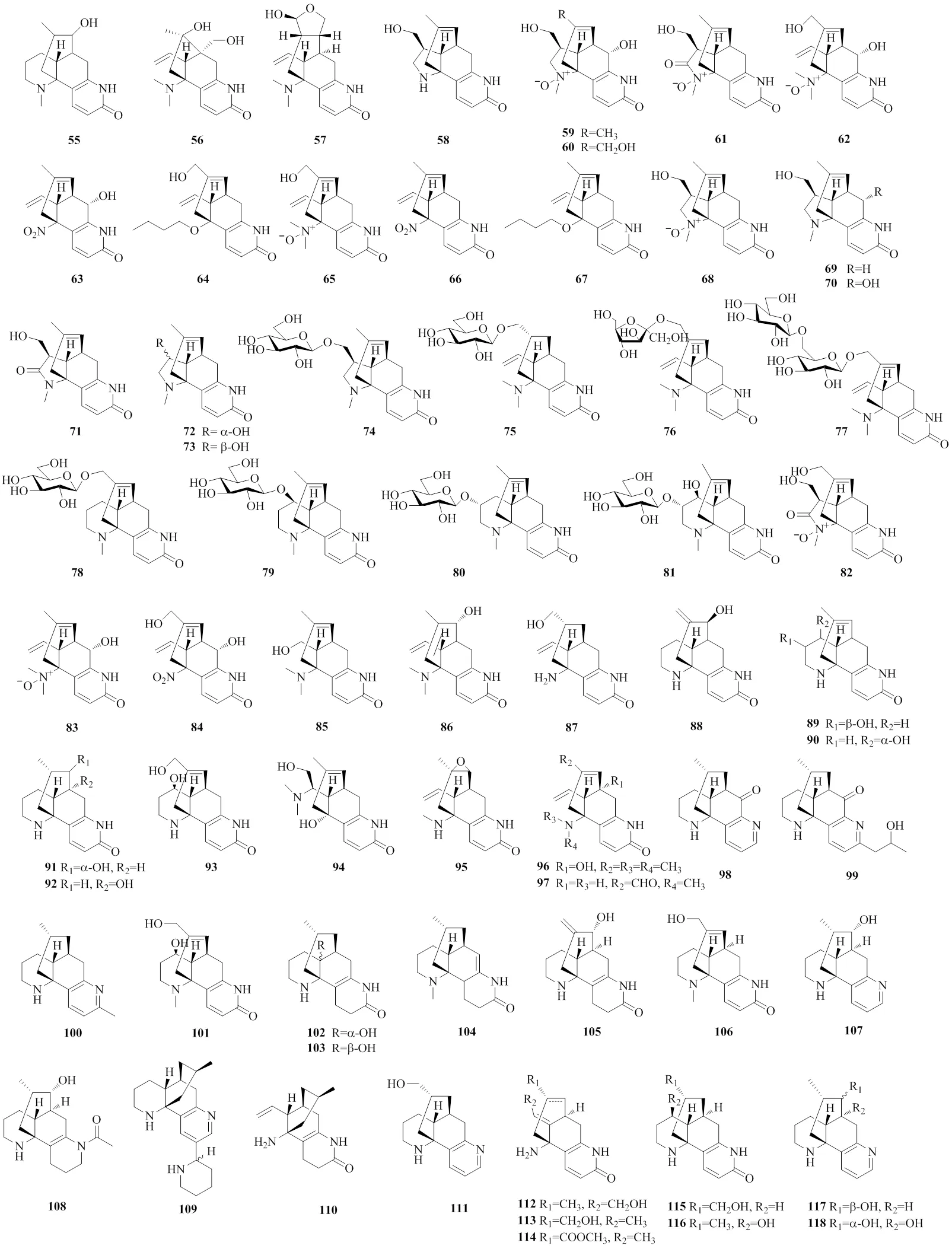
图4 lycodine型LAs的化学结构

表3 lycodine型LAs
2.5 miseelaneous型生物碱
miscellaneous型LAs骨架结构多变,以phlegmarine型为代表,少部分为lyconadin型和cernuane型。phlegmarine型是LAs生物合成途径中常见的中间体,由lycodine型通过B环C-4-C-13键之间断裂所得。2015年8月—2022年1月共报道15个miseelaneous型LAs。其中,lycocernuskines A(154)、lycocernuskines B(155)[39]为首次报道的C-12位连羟基并在喹啉环处带有1个硝酮基的phlegmarine型LAs。lycofargesiine F(157)是首个含有2个硝酮基的phlegmarine型LAs[36]。miscellaneous型LAs的化学结构见图6,相关信息见表5。
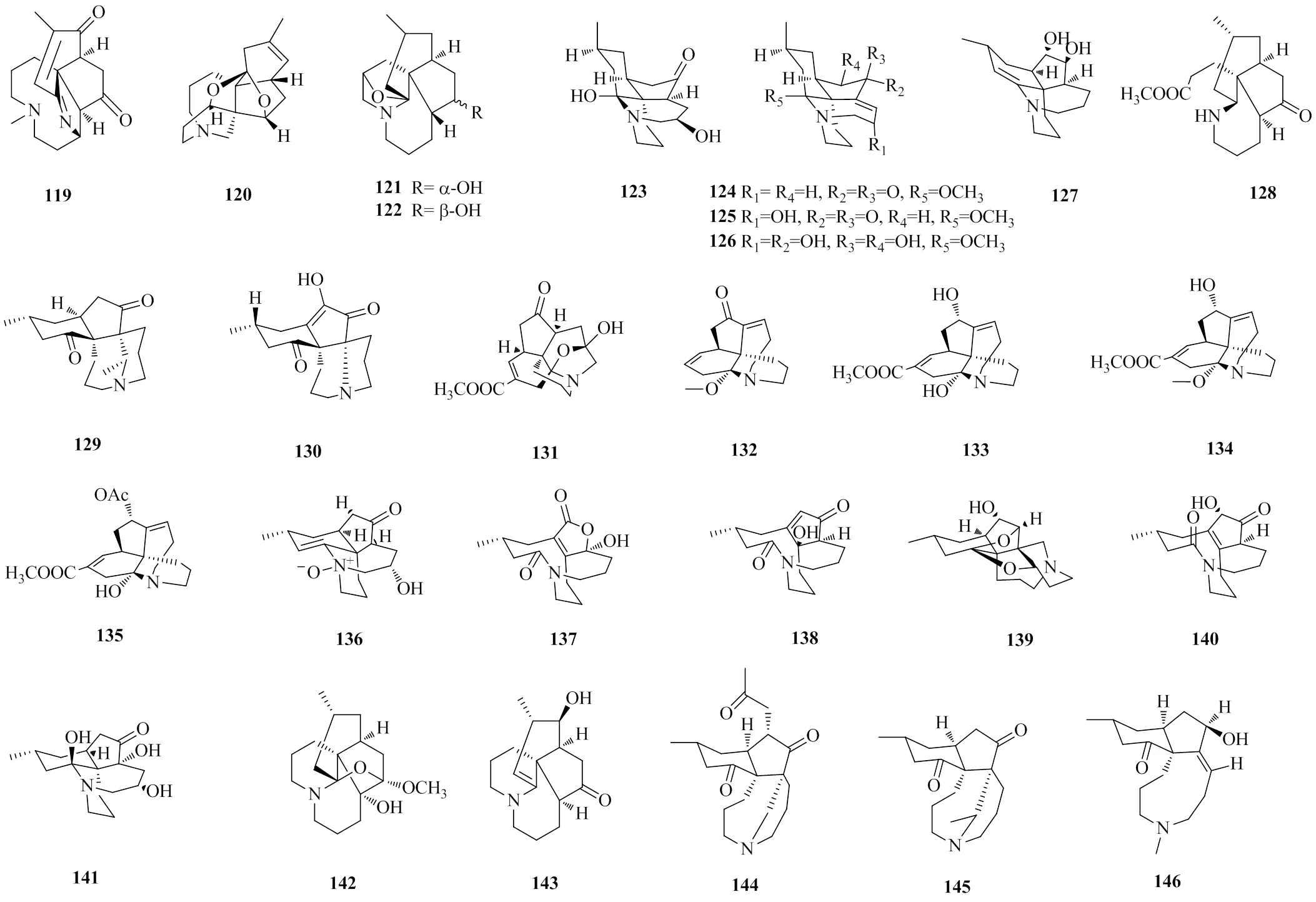
图5 fawcettimine型LAs的化学结构

表4 fawcettimine型LAs

图6 miscellaneous型LAs的化学结构

表5 miscellaneous型LAs
3 生物活性
石杉碱甲是具有显著的AChE抑制作用的LAs,其发现激发了各国对天然产物尤其是对LAs的研究热情。越来越多的LAs被陆续报道,并对其进行了大量的生物活性筛选实验。其中以AChE抑制活性实验为主,也包括丁胆酰胆碱酯酶(butyrylcholinesterase,BChE)、神经保护作用、细胞毒活性等研究。
3.1 抑制胆碱酯酶
lycodine型生物碱石杉碱甲作为高效、低毒、高选择性的第2代AChE抑制剂,一直受到各国科学家的高度重视,目前所报道的具有显著AChE抑制活性的LAs也多属于此类。lycocasuarine A(59)和lycocasuarine C(61)[41]具有显著的胆碱酯酶抑制活性,对AChE的半数抑制浓度(half maximal inhibitory concentration,IC50)值分别为(0.94±0.15)、(0.24±0.03)μmol/L,对BChE的IC50值分别为(1.82±0.12)、(7.31±0.42)μmol/L。lycocasuarinine D(68)也表现出显著的AChE抑制活性,IC50值为(0.22±0.02)μmol/L[38]。目前所报道的LAs大多数无AChE抑制活性或微弱的AChE抑制活性,少量有活性的LAs也均低于石杉碱甲,因此,还有待进一步从LAs中探寻高效胆碱酯酶抑制剂。
3.2 神经保护
目前,科学家通过H2O2建立人神经母细胞瘤SH-SY5Y诱导损伤模型,对金丝条马尾杉中分离的多个LAs进行了神经保护活性研究。结果显示phlefargesiine A(3)[16]、dehydroisofawcettiine-oxide(18)[27]、lycofargesiine E(46)、lycofargesiines A~D(105~108)及lycofargesiine F(157)[36]均无明显神经保护作用。仅phlegmadines B(10)[22]对大鼠肾上腺嗜铬细胞瘤PC12细胞表现出中等的神经营养活性。
3.3 细胞毒性
抗肿瘤研究一直是众多生物活性研究中的热点之一,以往报道的LAs也表现出良好的细胞毒活性。因此,科学家基于不同肿瘤细胞对这些LAs进行了细胞毒活性研究。其中,lycocasuarine A(59)、lycocasuarine C(61)对人恶性黑色素瘤A-375细胞、人皮肤癌HS-4细胞、人皮肤癌黑色素瘤SK-MEL-1、WM278和451Lu细胞表现中等抑制活性,IC50值均小于10 μmol/L[41];16-hydroxy-9-oxo-lycocasuarinine D(82)对肺癌细胞株A549、ATCC、H446和H292显示显著细胞毒性,但效果均远低于阳性对照药阿霉素[42]。
3.4 其他
研究表明,obscurumine O(40)[17]对血凝素和醋酸佛波肌肽刺激Jurkat细胞分泌白细胞介素-2具有中等抑制作用,表现出免疫抑制活性,其IC50值为17.2 μmol/L。预防泡沫细胞形成被认为是治疗动脉粥样硬化的主要靶点之一。serralongamine B(149)、serralongamine D(151)[54]对人泡沫细胞的形成具有明显的抑制作用,是潜在的动脉粥样硬化治疗药物。huperserratines A(12)[23]表现出中等抗HIV-1活性,IC50为52.91 μg/mL,治疗指数大于3.78。此外,科学家还对acetylfawcettine-oxide(16)、fawcettine-oxide(17)和15--6-hydroxy-6,7-dehydro-8-deoxy-13-dehydroserratinine(130)进行钙离子通道抑制实验,但这些化合物对钙离子通道无抑制作用[26]。
4 生源途径
19世纪70年代,Aver等[8]利用同位素标记的手段证实LAs的生源合成途径是从赖氨酸(-lysine)开始。赖氨酸经脱羧酶A,再经酶B转化为piperideine。2分子的丙二酰辅酶A在酶C作用下进行缩合再与piperideine发生偶联,生成4PAA或4PAA-CoA,4PAA-CoA脱羧生成第1个中间体pelletierine,其与4PAA或4PAA-CoA脱羧转化为第2个中间体phlegmarine,其通过去氨基氧化和骨架重排,生成系列lycopodine、lycodine和fawcettimine骨架类型的LAs。研究表明,phlefargesiine A(3)可能有2种生源途径,一种途径通过lycodine型骨架氧化和脱水,再经Wagner-Meerwein重排反应,然后再氧化后获得;另一种途径则通过phlegmarine型骨架的C-4和C-14进行连接成[6/7/6/6]四环骨架后经氧化获得,具体生源途径见图7。squarrosinoxide(8)为phlegmarine型骨架在C-4和C-12连接后经C-8羟基化和C-9/C-10处烯胺异构化后,使得C-8和C10相接连形成关键中间体,并在C-7/C-8处的键断裂将产生氮杂螺环[3.2.2]壬二烯,进一步的转氨、氧化和酯化反应获得[20]。phlegmadine B(10)则由酮胺型fawcettimine骨架经氧化、氨基化、氢化、再氧化后得到中间体i,再经Polonovski反应得到中间体ii,中间体ii的C-9和C-13之间发生环化反应,最终生成化合物phlegmadine A(9)。由此可见,这些新骨架类型LAs均以4种经典骨架为基础,通过发生裂环、重排、水解、氧化、还原、聚合和异构化等较复杂的反应获得。LAs生源途径的探索将有助于理解不同骨架类型分子之间的联系与差异,进一步为合成化学和生物学的研究工作提供重要的指导意义。

图7 LAs经典骨架类型及化合物3的生源合成途径
5 结语
从LAs的首次发现,到结构分类和人工合成,再到生源途径和生物活性的探索,短短100多年时间里,科学家对LAs有了较为系统的了解。由于石松科和石杉科及其近缘亲属植物为多年生草本植物,人工栽培周期较长,难度较大且成本较高,目前这类植物基本来自野外采摘,导致了一定程度的植物资源消耗。LAs骨架多变且含有较多的手性中心,虽具有部分LAs的合成报道,但合成步骤繁琐且收率不高,如何减少简化合成步骤、提高收率也是有待解决的问题;LAs大多是简单的生物活性实验,罕见深入的药理活性及机制研究;石松类植物作为我国传统中草药对肿胀、劳损、挫伤和风湿具有良好的疗效,而传统药用以水煎剂为主,对大极性部位化学成分及生物活性研究较少。上述问题一定程度上限制了石松类植物化学成分(LAs)的研究进展,但随着对生物研究领域的不断深入,相关合成基因、酶及植物内生菌的发现为今后LAs的研究注入了新的动力。本文对LAs的化学结构、植物来源和药理活性等研究现状进行了较为全面总结,旨在为LAs的进一步开发与利用提供科学依据。
利益冲突 所有作者均声明不存在利益冲突
[1] Karl B. Lycopodin, das erste alkaloïd der gefässkryptogamen [J]., 1881, 208(3): 363-367.
[2] Dugas H, Hazenberg M E, Valenta Z,. Synthesis in the series ofalkaloids. VII. the synthesis of 12-epi-lycopodine [J]., 1967, 8(49): 4931-4936.
[3] Marshall W D, Nguyen T T, MacLean D B,. Biosynthesis of lycopodine. the question of the intermediacy of piperidine-2-acetic acid [J]., 1975, 53(1): 41-50.
[4] Braekman J C, Gupta R N, MacLean D B,. Biosynthesis of lycopodine. pelletierine as an obligatory intermediate [J]., 1972, 50(16): 2591-2602.
[5] Castillo M, Gupta R N, MacLean D B,. Biosynthesis of lycopodine from lysine and acetate. The pelletierine hypothesis [J]., 1970, 48(12): 1893-1903.
[6] Hemscheidt T, Spenser I D. A classical paradigm of alkaloid biogenesis revisited: Acetonedicarboxylic acid as a biosynthetic precursor of lycopodine [J]., 1996, 118(7): 1799-1800.
[7] Liu J S, Zhu Y L, Yu C M,. The structures of huperzine A and B, two new alkaloids exhibiting marked anticholinesterase activity [J]., 1986, 64(4): 837-839.
[8] Aver W A, Trifonov L S.[M]. Amsterdam: Elsevier, 1994: 233-266.
[9] Ma X Q, Gang D R. Thealkaloids [J]., 2004, 21(6): 752.
[10] 陈业高, 刘怡君, 蒋金和, 等. 石松类生物碱成分研究的新进展 [J]. 云南师范大学学报: 自然科学版, 2010, 30(6): 12-24.
[11] 王义坤, 李静, 翁俨玫, 等. 石松生物碱研究最新进展 [J]. 中南药学, 2017, 15(4): 459-466.
[12] Ppg i. A community-derived classification for extant lycophytes and ferns [J]., 2016, 54(6): 563-603.
[13] 中国科学院中国植物志编辑委员会. 中国植物志(第六卷第三分册) [M]. 北京: 科学出版社, 2004: 55-83.
[14] 马丽莎. 四川石松科植物资源及其利用 [J]. 四川林业科技, 2003, 24(2): 63-66.
[15] Liu Y C, Su J, Wu X D,. Five newalkaloids from the aerial parts of[J]., 2016, 115: 148-154.
[16] Meng W J, Xiong J, Wang W X,. Phlefargesiine A, a C16N2alkaloid with an unprecedented [6/7/6/6]-tetracyclic skeleton from[J]., 2016, 57(29): 3218-3221.
[17] Jiang W W, Liu Y C, Zhang Z J,. Obscurumines H-P, newalkaloids from the club moss[J]., 2016, 109: 155-161.
[18] Pongpamorn P, Wan-erlor S, Ruchirawat S,. Lycoclavatumide and 8β,11α-dihydroxylycopodine, a new fawcettimine and lycopodine-type alkaloid from[J]., 2016, 72(44): 7065-7069.
[19] Hirasawa Y, Mitsui C, Uchiyama N,. Hupercumines A and B,alkaloids from, inhibiting acetylcholinesterase [J]., 2018, 20(5): 1384-1387.
[20] Nilsu T, Thaisaeng W, Thamnarak W,. Threealkaloids from Thai club mosses [J]., 2018, 156: 83-88.
[21] Zhang Z J, Wang C, Wu X D,. Phlegmadine A: Aalkaloid with a unique cyclobutane ring from[J]., 2019, 84(17): 11301-11305.
[22] Zhang Z J, Zhu Q F, Wu X D,. Phlegmadines B and C, twoalkaloids with 6/5/5/5/7 pentacyclic skeleton from[J]., 2020, 61(2): 151381.
[23] Wu X D, Li X N, Peng L Y,. Huperserratines A and B, two macrocyclicalkaloids with an unusual skeleton from[J]., 2020, 85(10): 6803-6807.
[24] Hirasawa Y, Agawa-Kakimoto M, Zaima K,. Complanadine F, a novel dimeric alkaloid from[J]., 2021, 75(2): 403-407.
[25] Yang Q, Zhu Y Q, Peng W,. A new lycopodine-type alkaloid from[J]., 2016, 30(19): 2220-2224.
[26] Zhu Y, Dong L B, Zhang Z J,. Three newalkaloids from[J]., 2019, 21(1): 17-24.
[27] Tang Y, Xiong J, Hu J F.alkaloids from[J]., 2015, 10(12): 2091-2094.
[28] Wang L J, Xiong J, Wang W,.alkaloids fromL. f. strictum [J]., 2016, 15: 260-264.
[29] Tang Y, Xiong J, Zou Y K,. Palhicerines A-F,alkaloids from the club moss[J]., 2016, 131: 130-139.
[30] Kogure N, Maruyama M, Wongseripipatana S,. New lycopodine-type alkaloids from[J]., 2016, 64(7): 793-799.
[31] Tang Y, Xiong J, Zou Y K,. Annotinolide F and lycoannotines A-I, furtheralkaloids from[J]., 2017, 143: 1-11.
[32] Ishiuchi K, Hirose D, Suzuki T,. Identification ofalkaloids produced by an ultraviolet-irradiated strain of, an endophytic fungus fromvar.[J]., 2018, 81(5): 1143-1147.
[33] Nakayama W, Fujiwara Y, Kosuge Y,. Phlenumdines D and E, newalkaloids from, and their regulatory effects on macrophage differentiation during tumor development [J]., 2019, 29: 98-103.
[34] Zhu X L, Xia D, Zhou Z B,. Lycosquarrines A-R,alkaloids from[J]., 2020, 83(10): 2831-2843.
[35] Zhang Z J, Zhu Q F, Su J,. Lycoplanines B-D, threealkaloids from[J]., 2018, 8(3): 177-182.
[36] Xiong J, Meng W J, Zhang H Y,. Lycofargesiines A-F, furtheralkaloids from the club moss[J]., 2019, 162: 183-192.
[37] Wang L L, Zhou Z B, Zhu X L,. Lycocasuarines A-C,alkaloids from[J]., 2017, 58(52): 4827-4831.
[38] Liu Y, Xu P S, Ren Q,. Lycodine-type alkaloids fromand their cholinesterase inhibitory activities [J]., 2018, 130: 203-209.
[39] Wang L L, Hao L J, Zhou Z B,. Lycodine-type alkaloids and their glycosides from[J]., 2018, 154: 63-72.
[40] Shan S M, Luo J G, Pan K,. Rapid screening and identification of lycodine-type alkaloids in Lycopodiaceae and Huperziaceae plants by ultra-performance liquid chromatography coupled with quadrupole time-of-flight mass spectrometry [J]., 2016, 30(11): 1861-1872.
[41] Qu S M, Shan B H, Wang H T,. Lycodine type alkaloids fromwith cytotoxic and cholinesterase inhibitory activities [J]., 2018, 131: 86-90.
[42] Zhang H B, Hu J, Li J X,. Cytotoxic lycodine alkaloids from the aerial parts of[J]., 2020, 22(3): 217-224.
[43] Zhu X L, Wang L L, Shi Z H,. Lycocasuarines I-Q, newalkaloids isolated from[J]., 2019, 134: 474-480.
[44] Feng Z L, Chen S X, Wang W,. Lycodine-type alkaloids fromand their acetylcholinesterase inhibitory activity [J]., 2019, 139: 104378.
[45] Liu Y C, Zhang Z J, Su J,. Lycodine-typealkaloids from the whole plants of[J]., 2017, 7(5): 405-411.
[46] Vallejo M G, Corzo M E, Ortega M G,. 12α-hydroxy--demethyl-sauroxine, a lycodane type alkaloid from[J]., 2020, 34(9): 1270-1275.
[47] 王海英, 杨继, 刘新, 等. 石松的化学成分研究 [J]. 中国现代应用药学, 2018, 35(12): 1859-1864.
[48] Yeap J S Y, Lim K H, Yong K T,.alkaloids: Lycoplatyrine A, an unusual lycodine-piperidine adduct fromand the absolute configurations of lycoplanine D and lycogladine H [J]., 2019, 82(2): 324-329.
[49] Wang X, Wang F Q, Wu J,. Japonisine A, a fawcettimine-typealkaloid with an unusual skeleton fromThunb [J]., 2022, 156: 105069.
[50] Yang Q, Zhu Y Q, Zhan R,. A new fawcettimine-related alkaloid from[J]., 2018, 54(4): 729-731.
[51] Zhang Z J, Qi Y Y, Wu X D,. Lycogladines A-H, fawcettimine-typealkaloids fromvar.Ching [J]., 2018, 74(14): 1692-1697.
[52] Jiang F F, Qi B W, Ding N,.alkaloids from[J]., 2019, 137(2): 104277.
[53] Cheng J T, Zhang Z J, Li X N,. Lyconadins G and H, two rare lyconadin-typealkaloids from[J]., 2016, 6(6): 279-284.
[54] Ishiuchi K, Jiang W P, Fujiwara Y,. Serralongamines B-D, three newalkaloids fromvar., and their inhibitory effects on foam cell formation in macrophages [J]., 2016, 26(11): 2636-2640.
[55] Wang Z, Wu J, Zhao N,. Two new Lycopodium alkaloids from(L.) Holub [J]., 2016, 30(2): 241-245.
[56] Tang Y, Li N, Zou Y K,. LC-MS guided isolation and dereplication ofalkaloids fromvar.of different geographical origins [J]., 2019, 160: 25-30.
Research progress on chemical constituents and biological activities of
XIE Zhen1, ZHENG Dong-kun2, WANG Qiang2, XIE Xin-hua1, LIU Yang1
1. Key Laboratory of Prevention and Treatment of Cardiovascular and Cerebrovascular Diseases of Ministry of Education, Gannan Medical University, Ganzhou 341000, China 2. School of Pharmacy, Gannan Medical University, Ganzhou 341000, China
alkaloids, a class of alkaloids with the same biological source, similar structure, and diverse skeletons, isolated from Lycopodiaceae and Huperziaceae and their close relatives. To date, more than 600alkaloids have been reported, which are divided into four types: lycopodine type, lycodine type, fawcettidane type and miseelaneous type. The miseelaneous type skeleton is changeable, mainly with phlegmarine type, but also with a few of cernuane type. Some compounds show good activities in cholinesterase inhibition, neuroprotection, and cytotoxicity, etc. Chemical constituents, systematic classification, and biological activities of 161alkaloids reported in the literature from August, 2015 to January, 2022 were reviewed in this paper, in order to provide reference for further studies ofalkaloids.
Lycopodiaceae; Huperziaceae;alkaloids; cholinesterase inhibition; neuroprotection; cytotoxicity
R282.710.5
A
0253 - 2670(2022)15 - 4862 - 13
10.7501/j.issn.0253-2670.2022.15.030
2022-02-25
江西省教育厅科学技术研究项目(GJJ211540);江西省教育厅科学技术研究项目(GJJ211547);江西省中医药管理局科技计划一般项目(2021A325)
谢 振,助理实验师,主要从事天然产物化学和生物学研究。E-mail: xiezhen@gmu.edu.cn
通信作者:刘 阳,讲师,主要从事天然产物化学研究。E-mail: liuyang@gmu.edu.cn
#共同第一作者:郑东昆,助教,主要从事中药药物分析与质量标准研究。E-mail: zhengdongkun@gmu.edu.cn
[责任编辑 崔艳丽]
