超滤-固体膜萃取-反萃取技术制备异甘草苷工艺研究
2022-08-02刘梅清孙晓燕王继龙冯晓莉万玲娟魏舒畅
刘梅清,段 瑞,孙晓燕,王继龙, 2,冯晓莉, 2,万玲娟,魏舒畅, 2*
超滤-固体膜萃取-反萃取技术制备异甘草苷工艺研究
刘梅清1,段 瑞3,孙晓燕1,王继龙1, 2,冯晓莉1, 2,万玲娟1,魏舒畅1, 2*
1. 甘肃中医药大学,甘肃 兰州 730000 2. 甘肃省中药制药工艺工程研究中心,甘肃 兰州 730000 3. 沈阳市食品药品检验所,辽宁 沈阳 110122
采用固体膜萃取技术制备甘草超滤液中的异甘草苷,以期得到该技术分离异甘草苷的工艺条件。以异甘草苷的萃取和反萃取率为指标,考察膜萃取过程中三相体积流量及反萃取温度对异甘草苷萃取效果的影响。最佳固体膜萃取条件为甘草超滤液体积流量94 mL/min、萃取剂体积流量188 mL/min、反萃取剂体积流量188 mL/min,反萃取温度35 ℃。在此条件下,异甘草苷的平均萃取率可达到97.15%,反萃取率达到80.41%,最终异甘草苷的转移率达到78.12%。作为中药有效成分分离的一种新型技术,固体膜萃取技术具有高效、简单、萃取剂可循环利用等诸多优点,可为异甘草苷的分离制备提供一种新的适用技术。
异甘草苷;超滤;固体膜;萃取;反萃取;甘草
甘草为我国传统常用中药材,在制药、食品、化工和印染等方面都有广泛应用[1]。《中国药典》2020年版收载的有甘草Fisch.、胀果甘草Bat.和光果甘草L. 3个品种[2],以甘草分布最广、产量最高。甘草主要含黄酮、三萜、苯丙素、多糖等类化学成分[3],其中黄酮类包括黄酮醇、二氢黄酮、异黄酮、查耳酮等化合物及其苷类[4]。异甘草苷属于查耳酮类化合物,具有抗溃疡、抗炎[5]、抗氧化[6]、抑制脂质过氧化[7]、抗肿瘤血管新生、解毒[8]等作用。
本课题组前期已经对甘草超滤液中的主要有效成分进行了络合萃取研究[9-11],本实验在此基础上,进一步利用固体膜萃取技术对甘草超滤液中异甘草苷的分离制备工艺进行了研究。将固体膜萃取技术直接应用于中药有效成分的分离会导致膜污染。鉴于此,先将甘草水提液进行超滤处理,在目标成分得到有效保留的情况下,可以除去其中大量的水溶性大分子杂质,使料液黏度显著降低,保证后期膜萃取过程的顺利高效进行,膜萃取过程使用的萃取剂可再生循环利用,得到的目标产品无有机溶剂残留。该技术操作简单、适合批量制备。
1 仪器与试药
Agilent-1100型液相色谱仪,美国Agilgent公司;Hypersil BDS-C18分析柱(250 mm×4.6 mm,5 μm),赛默飞世尔科技有限公司;ABT-100-5M-型分析天平,十万分之一,德国KERN公司;聚醚砜(PES)膜组件(孔径0.45 μm),浙江东大水业集团有限公司;输送泵,保定兰格恒流泵有限公司。
三烷基氧化膦(TRPO),质量分数>93.0%,溧阳市凯信化工有限公司;磺化煤油(260#),广东正茂石化有限公司;乙腈为色谱纯,氢氧化钠、磷酸为分析纯、水为超纯水。
甘草饮片购于兰州市黄河药材市场,经甘肃中医药大学药学院魏舒畅教授鉴定为豆科植物甘草Fisch.的干燥根及根茎;对照品异甘草苷(批号5041-81-6)购自北京北纳创联生物技术研究院,质量分数≥98%,供药品检验用。
2 方法与结果
2.1 甘草的提取、超滤工艺
取甘草饮片,用24倍量稀氨水回流提取3次,每次1 h,提取液用10 nm无机陶瓷膜超滤,得甘草超滤液,将超滤液浓缩至含生药1 g/mL,备用[12]。
2.2 串级固体膜萃取-反萃取方法
取甘草超滤液(稀释至0.05 g/mL)3000 mL、萃取剂13% TRPO+87%磺化煤油1000 mL、反萃取剂0.26% NaOH水溶液3000 mL,置于相应的储液罐中,按照图1固体膜萃取-反萃取实验装置进行实验操作:设置3个泵的体积流量,实验开始后,将超滤液和反萃取剂注入膜组件的管程,萃取剂注入壳程,待甘草超滤液、萃取剂、反萃取剂3相体系均运行稳定后,开始记录萃取-反萃取时间,分别在不同时间点取样,甘草超滤液经萃取后为萃余液,测定不同时间点萃余液和反萃取液中异甘草苷的质量浓度。
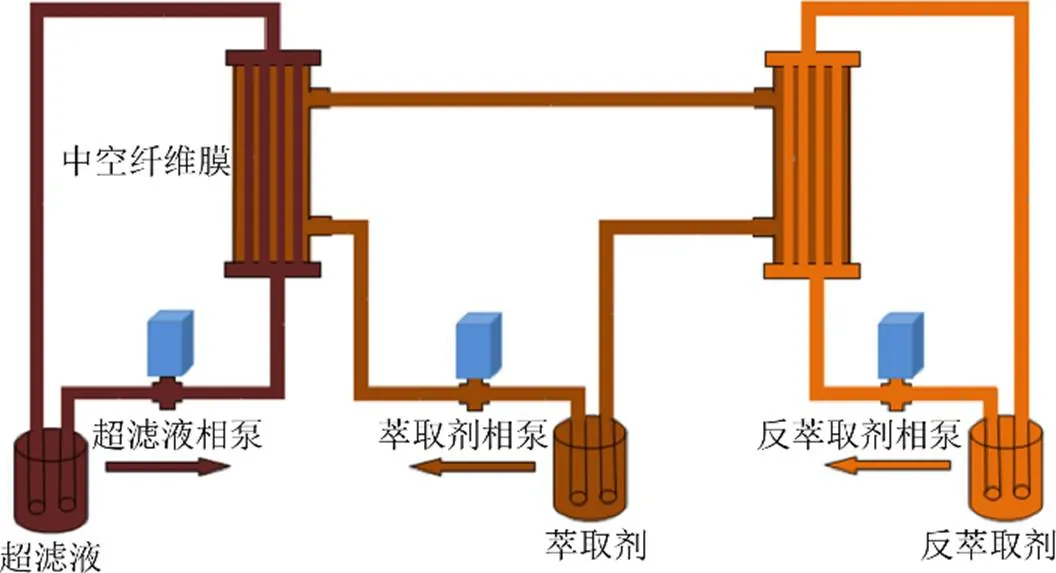
图1 固体膜萃取-反萃取实验装置流程图
2.3 异甘草苷的含量测定
2.3.1 对照品溶液的制备 精密称取异甘草苷对照品适量,加70%乙醇制成质量浓度为8.24 μg/mL的对照品溶液,备用。
2.3.2 供试品溶液的制备 准确量取0.05 g/mL的甘草超滤液、固体膜络合萃取后的萃余液、反萃取液各1 mL于25 mL量瓶中,加70%乙醇定容至刻度,摇匀,经0.45 μm微孔滤膜滤过,取续滤液,即得。
2.3.3 色谱条件 色谱柱为Hypersil BDS-C18柱(250 mm×4.6 mm,5 μm);流动相为0.05%磷酸水溶液-乙腈;梯度洗脱:0~8 min,19%乙腈;8~35 min,19%~50%乙腈;35~36 min,50%~100%乙腈;36~40 min,100%~19%乙腈;检测波长为360 nm;柱温26 ℃;体积流量1.0 mL/min;进样量10 μL;理论塔板数按异甘草苷峰计算不低于 30 000。色谱图见图2。
2.3.4 线性关系考察 分别精密吸取异甘草苷对照品溶液0.5、1、5、7、9、15 mL,置25 mL量瓶中,用70%乙醇定容并摇匀,精密吸取上述各对照品溶液10 μL,注入高效液相色谱仪测定。以峰面积值为纵坐标(),进样量为横坐标()进行线性回归,得回归方程为=3 974.9+0.246 6,=0.999 9,线性范围为0.082 0~74.044 5 μg。
2.3.5 精密度试验 精密量取异甘草苷对照品溶液适量,按“2.3.3”项下色谱条件连续进样6次。结果异甘草苷峰面积的RSD为1.31%,表明仪器精密度良好。

A-异甘草苷对照品 B-甘草超滤液 C-固体膜萃余液 D-固体膜反萃取液
2.3.6 重复性试验 按“2.3.2”项下方法平行制备6份反萃取液,按“2.3.3”项下色谱条件进样测定。结果异甘草苷质量浓度的RSD为1.98%,表明该方法重复性良好。
2.3.7 稳定性试验 取同一份供试品溶液,于0、1、2、4、8、12、24 h进样测定。结果异甘草苷峰面积的RSD为1.47%,表明供试品溶液在24 h内稳定性良好。
2.3.8 加样回收率试验 取同一批已测定异甘草苷含量的反萃取液6份,每份精密量取10 mL,分别加入异甘草苷对照品溶液1.5 mL,按“2.3.3”项下色谱条件进样测定,记录峰面积并计算加样回收率。结果异甘草苷的平均加样回收率为101.46%,其RSD为1.83%,表明该方法的准确度较好。
2.4 萃取率及反萃取率的计算
按照以下公式分别计算异甘草苷的萃取率和反萃取率。
萃取率=(超滤液中异甘草苷的质量浓度-萃余液中异甘草苷的质量浓度)/超滤液中异甘草苷的质量浓度
反萃取率=反萃取液中异甘草苷的质量浓度/(超滤液中异甘草苷的质量浓度-萃余液中异甘草苷的质量浓度)
2.5 串级膜萃取过程中不同因素对异甘草苷萃取率及反萃取率的影响
2.5.1 甘草超滤液、萃取剂、反萃取剂3相体积流量对异甘草苷萃取率及反萃取率的影响 考察甘草超滤液、萃取剂、反萃取剂3相体积流量对甘草超滤液中异甘草苷萃取及反萃取率的影响,实验运行36 h后取样,测定样品中异甘草苷的含量,并按照“2.4”项下公式计算异甘草苷的萃取率和反萃取率,结果见表1。膜萃取过程中甘草超滤液与萃取剂的体积流量对异甘草苷的萃取率有影响,萃取剂与反萃取剂的体积流量对异甘草苷的反萃取率无影响。

表1 3相体积流量对异甘草苷萃取率及反萃取率的影响
异甘草苷的萃取率随着甘草超滤液体积流量的减小而增大,随着萃取剂体积流量的增大而增大,故本实验初步选择串级固体膜萃取反萃取异甘草苷时3相体积流量为甘草超滤液94 mL/min、萃取剂188 mL/min、反萃取剂188 mL/min,在此条件下实验36 h后,异甘草苷的萃取率为97.82%,反萃取率为62.06%。
2.5.2 反萃取温度对异甘草苷反萃取率的影响 从前面实验结果可知,异甘草苷反萃取率较低,有研究表明,反萃取过程为吸热过程[13],升高反萃取过程的温度能提高反萃取率。考虑到后期工业化操作及经济效益问题,本实验水浴加热反萃取剂不超过35 ℃,甘草超滤液体积流量为94 mL/min;萃取剂体积流量为188 mL/min;反萃取剂体积流量为188 mL/min,在此条件下分别考察了反萃取剂温度在25、35 ℃时异甘草苷的反萃取率随时间的变化。结果见表2。由表2结果可知,随着时间的延长,反萃取率在不断的增大,将反萃取剂储液罐置于水浴锅中,在设定温度下操作并保持不变,35 ℃时异甘草苷的反萃取率明显高于25 ℃,35 ℃条件下,膜反萃取36 h后,异甘草苷的反萃取率为80.37%,故本实验选择反萃取过程中的温度为35 ℃。
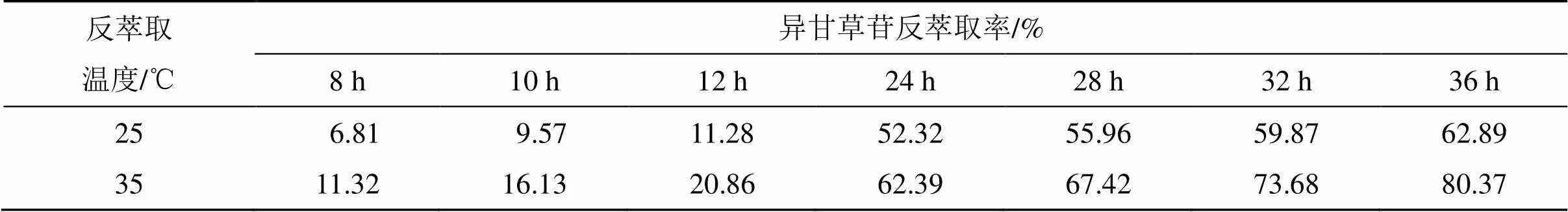
表2 反萃取温度对异甘草苷的反萃取率的影响
2.6 串级固体膜萃取反萃取异甘草苷的工艺条件验证
取同一批甘草超滤液3份,每份0.05 g/mL甘草超滤液3000 mL与13% TRPO+87%磺化煤油1000 mL、0.26% NaOH水溶液3000 mL进行串级固体膜萃取及反萃取实验。将配制好的3相溶液置相应的储液罐中,甘草超滤液体积流量为94 mL/min、萃取剂体积流量为188 mL/min、反萃取剂体积流量为188 mL/min,并将反萃取剂储液罐置于水浴锅中保持35 ℃不变,按照固体膜萃取方法进行操作,实验运行时间为36 h,HPLC法测定样品中异甘草苷的含量,结果见表3,RSD均小于3%,说明该工艺重复性较好。

表3 工艺条件验证试验结果
2.7 萃取剂的循环利用对异甘草苷萃取效果的影响
萃取剂的循环使用可以在很大程度上节约成本,减小环境污染,已经使用过的萃取剂还是有少量黄酮类物质残留,故将已经使用的萃取剂再生循环利用。
2.7.1 萃取剂的再生 将已经使用过的萃取剂(13% TRPO+87%磺化煤油)中加入相同体积的1% NaOH水溶液充分摇匀,然后静置分层,将分层出来的萃取剂按照相同方法进行再生,重复4次。
2.7.2 再生萃取剂的萃取能力考察 取0.05 g/mL的甘草超滤液10 mL与再生的萃取剂10 mL(该萃取剂已经循环使用3次)加入60 mL离心管中,密封并置于旋转混匀仪上于室温下萃取(25 r/min)30 min后,3000 r/min离心,取下层萃余液测异甘草苷的含量,考察再生萃取剂的萃取能力,结果见表4。萃取剂循环使用时异甘草苷的萃取率可达到98.01%,再生后的萃取剂萃取能力有所提高,是因为前期萃取剂中异甘草苷未萃取完全,经过再次络合萃取,异甘草苷被萃取出来,该结果表明,络合萃取后的萃取剂可循环使用,降低生产成本。

表4 再生萃取剂的萃取能力考察结果
3 讨论
膜萃取过程机制是建立在溶剂萃取或络合萃取机制之上的,即物理萃取和化学萃取[14]。膜的最大的作用是提供更大的传质比表面积,其传质过程发生在由料液相和充满膜孔的溶剂相所形成的界面层上,该传质过程不存在传统液液萃取过程中的液滴的分散和聚合现象[15]。其中膜萃取中溶质的传质过程可为以下几个步骤:(1)溶质由水相主体扩散至水相边界层;(2)溶质由水相边界层扩散至水相-有机相界面并与萃取剂发生反应,生成萃合物;(3)萃合物由膜相主体扩散至溶剂相主体。目前膜萃取技术主要用于工业废水的净化,回收废水中的酚类、苯胺类等有机化合物和金属[16-17],而将该技术用于分离纯化中药提取液中的有效成分还未有报道。本实验使用中空纤维膜将萃取剂与甘草超滤液和反萃取液隔离开,在保证相与相之间不直接接触的条件下,萃取及反萃取过程在中空纤维膜的表面的微孔中进行,该技术既分离纯化得到了目标物质,还使得萃取剂循环使用,很大程度上节约了成本。
本实验在串级固体膜萃取及反萃取异甘草苷过程中发现,膜萃取12 h后异甘草苷的平均萃取率就能达到97.15%,继续增加萃取时间异甘草苷萃取率保持不变,但是膜反萃取36 h后,异甘草苷的平均反萃取率仅能达到80.41%,而在课题组前期络合萃取异甘草苷实验中萃取15 min时异甘草苷的萃取率就能达到97.60%,反萃取率能达到95.40%[10]。导致目标物质在膜萃取实验中萃取及反萃取时间比较长的原因可能是:实验所用膜组件的中空纤维膜壁太厚、萃取传质阻力太大,后期将通过改进膜组件以期获得更高的萃取效率;其次推断导致异甘草苷的萃取率及反萃取率存在差异的原因可能是:在络合反应过程中反应速度的不同形成的络合物的牢固程度不同,进而导致络合物解离速度不一样,故形成的络合物转移至反萃取剂中的速度不同,其反应机制将在后续研究中进行。
利益冲突 所有作者均声明不存在利益冲突
[1] 李娜, 张晨, 钟赣生, 等. 不同品种甘草化学成分、药理作用的研究进展及质量标志物(Q-Marker)预测分析 [J]. 中草药, 2021, 52(24): 7680-7692.
[2] 中国药典[S].一部. 2020: 88.
[3] 刘刚, 吴燕, 刘育辰, 等. 乌拉尔甘草化学成分研究进展 [J]. 中国现代中药, 2021, 23(11): 2006-2016.
[4] 李娜, 张晨, 钟赣生, 等. 不同品种甘草化学成分、药理作用的研究进展及质量标志物(Q-Marker)预测分析[J]. 中草药, 2021, 52(24): 7680-7692.
[5] 赵艳敏, 刘素香, 张晨曦, 等. 基于HPLC-Q-TOF-MS技术的甘草化学成分分析 [J]. 中草药, 2016, 47(12): 2061-2068.
[6] 周姗, 袁伯川, 杨瑞, 等. HPLC法分析12产地甘草中4种主要黄酮类化合物的含量 [J]. 中华中医药学刊, 2017, 35(8): 1943-1947.
[7] 韦悦, 程娟娟, 程雪梅, 等. 维吾尔药复方木尼孜其颗粒剂的质量控制方法研究 [J]. 药物分析杂志, 2017, 37(10): 1799-1809.
[8] 任明, 许真真. HPLC-UV切换波长法同时测定复方甘草合剂中甘草苷、异甘草苷、甘草素和甘草酸 [J]. 山东医药, 2016, 56(11): 35-37.
[9] 石盘棋, 刘晓霞, 魏舒畅, 等. 络合萃取-反萃法制备异甘草素的工艺研究 [J]. 高校化学工程学报, 2020, 34(4): 939-945.
[10] 孙晓燕, 王继龙, 刘晓霞, 等. 络合萃取异甘草苷的工艺条件研究 [J]. 中草药, 2019, 50(20): 4920-4924.
[11] 蒲红利, 周博, 魏舒畅, 等. 甘草超滤液中甘草酸的络合萃取研究 [J]. 食品工业科技, 2019, 40(6): 157-160.
[12] 周博, 蒲红利, 王继龙, 等. 基于超滤-络合萃取技术的甘草酸制备工艺研究 [J]. 中草药, 2019, 50(6): 1323-1327.
[13] 戴猷元, 秦炜, 张瑾. 有机物络合萃取化学 [M]. 北京: 化学工业出版社, 2008: 20.
[14] 张楠. 中空纤维支撑液膜法回收制药废水中7-ACA的过程研究[D]. 天津: 天津大学, 2016.
[15] 戴猷元. 新型萃取分离技术的发展及应用 [M]. 北京: 化学工业出版社, 2007: 182.
[16] 段作山. PVDF中空纤维膜萃取处理煤气化含酚废水 [D]. 哈尔滨: 哈尔滨工业大学, 2010.
[17] 姜名珊. MOFs混合基质膜萃取技术—高效液相色谱法分析环境中有机污染物 [D]. 青岛: 青岛理工大学, 2019.
Preparation of isoglycyrrhizin by ultrafiltration and solid membrane extraction and reverse extraction
LIU Mei-qing, DUAN Rui3, SUN Xiao-yan1, WANG Ji-long1, 2, FENG Xiao-li1, 2, WAN Ling-juan1, WEI Shu- chang1, 2
1. Gansu University of Traditional Chinese Medicine, Lanzhou 730000, China 2. Gansu Pharmaceutical Engineering Research Center of Traditional Chinese Medicine, Lanzhou 730000, China 3. Shenyang Institute of Food and Drug Control, Shenyang 110122, China
To prepare isoglycyrrhizin from Gancao (et, GRR) ultrafiltrate by solid membrane extraction technology, and obtain the technological conditions for the separation of isoglycyrrhizin.The effects of three phase flow rate and reverse extraction temperature on the extraction efficiency of isoglycyrrhizin were investigated with the extraction and reverse extraction rates of isoglycyrrhizin as indexes.The optimal extraction conditions were as follows: flow rate of GRR ultrafiltrate was 94 mL/min, flow rate of extractant was 188 mL/min, flow rate of reverse extractant was 188 mL/min, and temperature of reverse extractant was 35 ℃. Under these conditions, the average extraction rate of isoglycyrrhizin was 97.15% and the reverse extraction rate was 80.41%, finally, the transfer rate of isoglycyrrhizin reached 78.12%.As a new technology for the separation of the active components of traditional Chinese medicine, solid membrane extraction has many advantages, such as high efficiency, simplicity and recyclable extractant, which can provide a new suitable technology for the separation and preparation of isoglycyrrhizin.
isoglycyrrhizin; ultrafiltration; solid membrane; extraction; reverse extraction;et
R283.6
A
0253 - 2670(2022)15 - 4673 - 05
10.7501/j.issn.0253-2670.2022.15.010
2022-01-24
国家自然科学基金资助项目(82060721);甘肃省教育厅“双一流”科研重点项目(GSSYLXM-05)
刘梅清,女,硕士研究生,从事中药制剂工艺研究。Tel: 18215106395 E-mail: 1489594688@qq.com
通信作者:魏舒畅(1969—),男,教授,博士生导师,从事中药制剂工艺研究。Tel: 13893467387 E-mail: wshch006@163.com
[责任编辑 郑礼胜]
