大黄-桃仁药对调控子宫腺肌病在位内膜线粒体稳态的机制研究
2022-08-02易永丽付先芸蔡三金
易永丽,雷 娅,王 坤,付先芸,蔡三金
• 药理与临床•
大黄-桃仁药对调控子宫腺肌病在位内膜线粒体稳态的机制研究
易永丽,雷 娅#,王 坤,付先芸*,蔡三金*
三峡大学医学院,国家中医药管理局中药药理肿瘤科研三级实验室,湖北 宜昌 443000
探索大黄-桃仁药对对子宫腺肌病(adenomyosisi,AM)在位内膜线粒体稳态的调控机制。同种异体垂体移植法构建AM小鼠模型,光镜及透射电镜(TEM)观察大黄-桃仁药对治疗前后子宫组织病理及超微结构改变;免疫荧光检测线粒体自噬通路PTEN诱导的推定激酶1(PTEN-induced putative kinase 1,PINK1)/帕金森蛋白(Parkinson protein,Parkin)蛋白表达。培养人永生化子宫内膜异位症在位内膜间质细胞hEM15A,观察大黄-桃仁药对处理前后细胞增殖能力、活性氧(reactive oxygen species,ROS)、抗氧化酶系、线粒体膜电位、线粒体自噬小体、线粒体自噬蛋白的变化。病理切片显示,经大黄-桃仁药对治疗后,中、重度的浸润比例较模型组减少。TEM观察发现模型组子宫内膜上皮细胞及间质细胞线粒体肿胀、线粒体脊消失,部分形成线粒体自噬体;经大黄-桃仁药对治疗后子宫内膜上皮细胞及间质细胞线粒体数量增加,无明显肿胀、线粒体脊清晰可见。与对照组比较,造模后子宫内膜层PINK1、Parkin表达显著上调(<0.001);经大黄-桃仁药对治疗后,PINK1、Parkin表达显著下降(<0.05、0.001)。体外实验结果表明,hEM15A细胞线粒体膜电位下降,ROS呈较高水平;经大黄-桃仁药对处理后,hEM15A细胞的增殖及侵袭能力下降(<0.05、0.001),线粒体膜电位升高,ROS水平下降(<0.001),抗氧化酶系统Cu-Zn超氧化物歧化酶(superoxide dismutase,SOD)、Mn-SOD和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性上调(<0.01、0.001),氧化损伤指标丙二醛(malondialdehyde,MDA)水平下调(<0.01)。hEM15A细胞线粒体与溶酶体之间存在较强的共定位关系,经大黄-桃仁药对处理后,线粒体与溶酶体共定位的数量显著减少(<0.05),PINK1、Parkin及其下游视神经蛋白(Optineurin,OPTIN)、核点蛋白52(nuclear dot protein 52,NDP52)经大黄-桃仁药对处理后显著下调(<0.01、0.001)。大黄-桃仁药对可通过改善线粒体抗氧化酶系、调控线粒体自噬水平、恢复线粒体膜电位等多途径维护AM在位内膜细胞乏氧线粒体稳态,从而减轻氧化应激损伤。
大黄-桃仁药对;子宫腺肌病;在位内膜线粒体稳态;线粒体自噬;氧化应激
子宫腺肌病(adenomyosisi,AM)发病率高[1],90%的患者伴有痛经、月经过多、性交困难、不孕等临床症状[2],对其生活和工作造成极大的困扰[3]。除手术外,目前临床采用非甾体抗炎药和激素控制AM的疼痛症状和异常子宫出血[4]。但现有保守治疗方法伴随着排卵抑制、肝肾功能受损、疗效差、复发率高等问题,严重影响患者身心健康[3]。中医药因具有显著改善AM临床症状和病理浸润程度,且不干扰正常内分泌的独特优势日益引起广泛的关注[5]。本课题组前期实验证实,AM的发生是在位内膜缺氧损伤的结果[6],线粒体是细胞内最高级的反应性传感系统,对缺氧损伤极为敏感。线粒体损伤诱发的能量代谢异常是内膜异位发生的重要前提和潜在治疗靶点[7]。目前研究证实,化瘀类中药可以调控缺氧微环境下线粒体呼吸链酶系及抗氧化酶系,调控线粒体膜的稳定性,从而修复受损线粒体,抑制细胞异常增殖能力[8-9]。本研究拟以在位内膜线粒体稳态为靶点,探索化瘀核心药对大黄-桃仁治疗AM的作用机制。
1 材料
1.1 动物
SPF级8周龄雌性ICR小鼠(体质量23.1~26.4 g)及10周龄雄性小鼠(体质量25.2~29.7 g),购自北京维通利华实验动物技术有限公司,动物许可证号SCXK(京)2016-0006。小鼠每笼4只,置于实验动物房屏障环境饲养,温度(24±2)℃,相对湿度为40%~70%,12 h灯光照射,12 h黑暗。动物实验经三峡大学动物实验伦理委员会批准(批准号20190801)。
1.2 细胞
人子宫内膜异位症患者在位内膜间质细胞永生化细胞hEM15A(编号GDC0601)购自武汉大学中国典型培养物保藏中心细胞库。
1.3 药品与试剂
PTEN诱导的推定激酶1(PTEN-induced putative kinase 1,PINK1)兔多抗(批号23274-1-AP)、帕金森病蛋白(Parkinson protein,Parkin)兔多抗(批号14060-1-AP)、视神经蛋白(optineurin,OPTIN)兔多抗(批号10837-1-AP)、核点蛋白52(nuclear dot protein 52,NDP52)兔多抗(批号12229-1-AP)购自武汉三鹰生物技术有限公司;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)兔多抗(批号AB-P-R001)购自杭州贤至生物有限公司;HRP标记的山羊抗兔二抗(批号BA1054)购自武汉博士德生物工程有限公司;CCK8细胞增殖及细胞毒性检测试剂盒(批号HY-K0301)购自美国MedChemExpress公司;BCA蛋白浓度测定试剂盒(批号P0010)、线粒体膜电位JC-1检测试剂盒(批号C2006)、Mito-Tracker Green线粒体绿色荧光探针(批号040721210826)、Lyso-Tracker Red溶酶体红色荧光探针(批号012621210827)、ROS检测试剂盒(批号S0033)均购自碧云天生物技术有限公司;谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)测试试剂盒(批号A005)、超氧化物歧化酶(superoxide dismutase,SOD)测试试剂盒(批号A001-2)、丙二醛(malondialdehyde,MDA)测试试剂盒(批号A003-4)均购自南京建成生物工程研究所;大黄免煎剂(批号19004961,酒炙法炮制,1 g免煎剂相当于5 g临床剂量)、桃仁免煎剂(批号19006412,1 g免煎剂相当于20 g临床剂量)由北京康仁堂制药有限公司提供;丙泊酚乳状注射液(国药准字H19990282,批号21803281)购自西安立邦制药有限公司;对照品芦荟大黄素(批号110795-201710,质量分数为98.3%)、大黄酸(批号110757-201607,质量分数为99.3%)、大黄素(批号110756-201512,质量分数为98.7%)、大黄酚(批号110796-201621,质量分数为99.2%)、大黄素甲醚(批号110758-201621,质量分数为99.0%)均购自国家食品药品监督检验研究院;苦杏仁苷对照品(批号K-001-171216,质量分数为98.0%)购自成都瑞芬斯生物技术有限公司。
1.4 仪器
MCO175型CO2培养箱(日本SANYO公司);Multiskan GO型全波长酶标仪(美国Thermo Fisher Scientific公司);电泳仪、170-8280型ChemiDocMP化学发光成像系统(美国Bio-Rad公司);BOM-1000型超净工作台(苏州安泰空气技术有限公司);2391Model型透射电子显微镜(TEM,美国IITC公司);LC-2010A型系列液相色谱仪(日本岛津公司)。
2 方法
2.1 大黄-桃仁药对的高效液相色谱分析
2.1.1 混合对照品溶液的制备 精密称取芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚对照品适量,加甲醇分别配制成含芦荟大黄素50 μg/mL、大黄酸50 μg/mL、大黄素50 μg/mL、大黄酚50 μg/mL、大黄素甲醚25 μg/mL的溶液,分别精密量取上述对照品溶液各2 mL混匀。
精密称取苦杏仁苷对照品适量,加甲醇配制成含苦杏仁苷0.1 mg/mL的溶液。
2.1.2 供试品溶液的制备 溶液制备方法及色谱条件按照国家药品监督管理局国家药品标准(酒大黄配方颗粒,YBZ-PFKL-2021075;桃仁配方颗粒,YBZ-PFKL-2021120)进行。
(1)大黄免煎剂溶液的制备:精密称取大黄免煎剂0.156 1 g,加入70%甲醇25 mL,加热回流1 h。取滤液5 mL,挥去溶剂,加8%盐酸溶液10 mL,超声处理2 min,再加三氯甲烷10 mL,加热回流1 h后,分液漏斗分取三氯甲烷层,酸液再用三氯甲烷提取3次,每次量取10 mL,合并三氯甲烷液,减压回收溶剂至干,残渣加甲醇使溶解,加甲醇至10 mL,摇匀,滤过,取续滤液即得。
(2)桃仁免煎剂溶液的制备:精密称取桃仁免煎剂0.101 4 g,加入70%甲醇50 mL,超声30 min后,摇匀,滤过,取续滤液5 mL,置量瓶中,加50%甲醇至10 mL,摇匀,即得。
2.1.3 色谱条件
(1)大黄免煎剂及混合对照品溶液的色谱条件:Dikma C18色谱柱(250 mm×4.6 mm,5 μm),流动相为甲醇-0.1%磷酸水溶液(85∶15);进样量为10 μL;检测波长为254 nm。
(2)桃仁免煎剂及苦杏仁苷对照品溶液的色谱条件:依利特C18色谱柱(250 mm×4.6 mm,5 μm),流动相为甲醇-水(1∶4);进样量为10 μL;检测波长为210 nm。
2.2 体内实验
2.2.1 动物模型的建立 采用同种异体垂体移植法建立AM小鼠模型[10]。ICR雌性小鼠ip丙泊酚乳状注射液麻醉(0.1 mg/g)。局部消毒后下腹正中纵切口2 cm,分离右侧子宫。取ICR雄性小鼠,断颈处死,取垂体,与少量生理盐水混匀,形成垂体生理盐水悬浊液。取50 mL套管穿刺针,吸入垂体生理盐水悬浊液,穿刺并推入宫腔,滴入庆大霉素溶液0.25 mL(1000 U/g),常规缝合。术后常规饲养。
2.2.2 实验分组及给药 雌性ICR小鼠随机抽取6只为对照组,其余25只手术造模。术后手术组随机抽取11只为模型组,另14只为大黄-桃仁药对(4.25 g/kg)组。大黄-桃仁药对组小鼠按1∶1(临床等效剂量)比例ig大黄和桃仁免煎剂。模型组及对照组ig等体积生理盐水,1次/d,连续8周,后引颈处死,剖腹取出右侧子宫组织。
2.2.3 苏木素-伊红(HE)染色 各组子宫用4%多聚甲醛固定,石蜡包埋。65 ℃干燥30 min后,将组织切成5 μm连续切片,进行HE染色,于显微镜下观察病理浸润程度。
2.2.4 TEM观察子宫内膜-肌层交界(endometrial myometrial interface,EMI)处子宫内膜腺上皮细胞及间质细胞的线粒体自噬情况 取1 mm3离体组织或单层培养细胞以戊二醛及锇酸双固定,丙酮梯度脱水,环氧丙烷浸透,包埋剂包埋、聚合;超薄切片机切片,甲苯胺蓝定位;醋酸铀及柠檬酸铅依次染色。观察EMI处线粒体、溶酶体超微结构变化,观察自噬小体数量。
2.2.5 PINK1和Parkin免疫荧光染色 子宫切片脱蜡漂洗,依次加入山羊血清、PINK1抗体、Parkin抗体及二抗,分别用PBS溶液漂洗3次,每次5 min。切片上加入DAPI复染细胞核,PBS孵育3次,每次5 min。最后加入抗荧光淬灭剂,对切片进行密封。观察染色结果。
2.3 体外实验
2.3.1 子宫内膜间质细胞培养 hEM15A细胞用含10%胎牛血清、1%青霉素-链霉素的DMEM/F-12培养基,于5% CO2、37 ℃、饱和湿度的培养箱中培养。
2.3.2 CCK-8实验 收集处于对数生长期的hEM15A细胞,以3×104/mL接种于96孔板中,每孔l00 μL,培养至细胞贴壁。将大黄-桃仁药对免煎颗粒粉碎,称取适量,溶解于0.9%生理盐水中,在磁力加热搅拌器上60 ℃加热并搅拌1 h,配制成质量浓度为20 mg/mL的药液,经0.22 μm的针式过滤器滤过,最后用无血清培养基分别将滤液配制成质量浓度为0.5、1、3、5、10、20 mg/mL的溶液,加入药物处理48 h,对照组加入不含药物的培养基。加入10 μL CCK-8溶液,并继续培养3 h。采用酶标仪测定450 nm处的吸光度()值。
2.3.3 线粒体膜电位检测 用不含EDTA的0.25%胰酶消化细胞,终止消化后收集细胞,1200 r/min离心5 min,弃上清,重悬于0.5 mL细胞培养液中;加入0.5 mL JC-1染色工作液,混匀,37 ℃孵育20 min;4 ℃、1200 r/min离心3 min,弃上清,洗涤2次;加入1 mL JC-1染色缓冲液重悬细胞,4 ℃、1200 r/min离心3 min,弃上清;再加入1 mL JC-1染色缓冲液重悬细胞,4 ℃、1200 r/min离心3 min,弃上清;以500 μL JC-1染色缓冲液重悬后,采用流式细胞仪检测。
2.3.4 活性氧(reactive oxygen species,ROS)检测 用不含EDTA的0.25%胰酶消化细胞,终止消化后收集,1200 r/min离心5 min,弃上清,以PBS溶液重悬;用PBS溶液将细胞润洗2次,1200 r/min离心5 min;弃去PBS溶液,加入1 mL稀释的DCFH-DA,37 ℃孵育20 min,每3分钟混匀1次;用无血清培养基洗涤细胞3次,采用流式细胞仪检测。
2.3.5 抗氧化酶系及氧化损伤检测 按GSH-Px及SOD试剂盒说明书加入样本和试剂,涡旋混匀,37 ℃孵育40 min,加入特定的显色剂显色,室温静置10 min,用1 cm光径石英皿,采用分光光度计测定412 nm处的值,计算GSH-Px活性;测定550 nm处的值,计算Mn+SOD及Cu-Zn SOD活性。
按MDA试剂盒说明书加入样本和试剂,涡旋混匀,95 ℃水浴40 min,冷却,离心,测定532 nm处的值,计算MDA含量。
2.3.6 免疫荧光标记细胞内的线粒体自噬 分别配制线粒体特异性荧光探针Mito-Tracker Green及溶酶体特异性荧光探针Lyso-Tracker Red工作液,37 ℃孵育后,与细胞共同孵育40 min。吸出染色工作液,在细胞培养皿中更换培养基,于激光共聚焦显微镜下观察。其中绿色的荧光点为线粒体,红色荧光点为溶酶体,溶酶体和线粒体的共定位细胞中形成黄色荧光即线粒体自噬阳性点。
2.3.7 Western blotting检测自噬蛋白表达 加入裂解液提取各组细胞蛋白,采用BCA蛋白定量试剂盒测定蛋白质量浓度。蛋白样品经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,室温封闭,漂洗后分别加入NDP52、OPTIN、PINK1、Parkin和GAPDH抗体(1∶1000),4 ℃孵育过夜;洗膜后加入HRP标记的二抗(1∶10 000),室温孵育2 h,漂洗后加入化学发光剂,采用Image J软件测定条带灰度值。
2.3.8 Transwell实验 胰酶消化后离心细胞,加入培养液重悬细胞;在24孔板中加入800 μL预冷的10%胎牛血清的DMEM/F-12培养基,并放入Transwell小室,在Transwell小室上室加入100 μL用无血清培养基稀释的Matrigel(1 mg/mL),37 ℃孵育4~5 h使其成胶状,待Matrigel干成胶状后在Transwell上室分别接入200 μL各组细胞悬液,培养48 h;用镊子取出小室,小室倒扣,弃去小室中培养基,加入1 mL甲醇固定10 min,苏木素染色15 min,棉签擦拭,清除小室内残留的细胞;沿小室边缘将膜切下,中性树胶封片,于显微镜下观察并拍照。
2.4 统计学分析
采用SPSS 20.0统计软件进行数据分析,定量指标用单因素方差分析,组间比较用LSD、SNK分析和Tamhane’s2检验。
3 结果
3.1 大黄-桃仁药对的HPLC分析
如图1所示,大黄免煎剂的指纹图谱在254 nm处检测出芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚,桃仁免煎剂的指纹图谱在210 nm处检测出苦杏仁苷。
3.2 体内实验结果
3.2.1 HE染色观察浸润程度 HE染色(图2)观察表明,造模后子宫内膜间质及腺体向肌层浸润,成功形成AM模型,其成模率可达90%。经大黄-桃仁药对治疗后,中、重度(2、3级)的浸润比例较模型组减少。
3.2.2 TEM观察大黄-桃仁药对治疗前后内膜细胞、间质细胞、平滑肌细胞的线粒体超微结构变化 如图3所示,对照组EMI处子宫内膜上皮细胞及间质细胞中线粒体量丰富,大小形态正常,线粒体脊清晰可见;模型组EMI处子宫内膜上皮细胞及间质细胞线粒体肿胀、线粒体脊消失,部分形成线粒体自噬体;经大黄-桃仁药对治疗后,子宫内膜上皮细胞及间质细胞线粒体数量增加,无明显肿胀、线粒体脊清晰可见。
3.2.3 免疫荧光染色观察大黄-桃仁药对治疗前后不同部位(上皮细胞、间质细胞)线粒体自噬通路PINK1、Parkin蛋白表达的变化 如图4所示,PINK1、Parkin蛋白在各组大鼠子宫内膜肌层交界处的在位内膜腺上皮细胞、间质细胞及平滑肌细胞中均有表达。与对照组比较,造模后子宫内膜层PINK1有上调趋势,经大黄-桃仁药对治疗后,PINK1表达显著下降(<0.001);Parkin表达在模型组显著上调(<0.001),经大黄-桃仁药对治疗后,其表达显著下降(<0.05)。
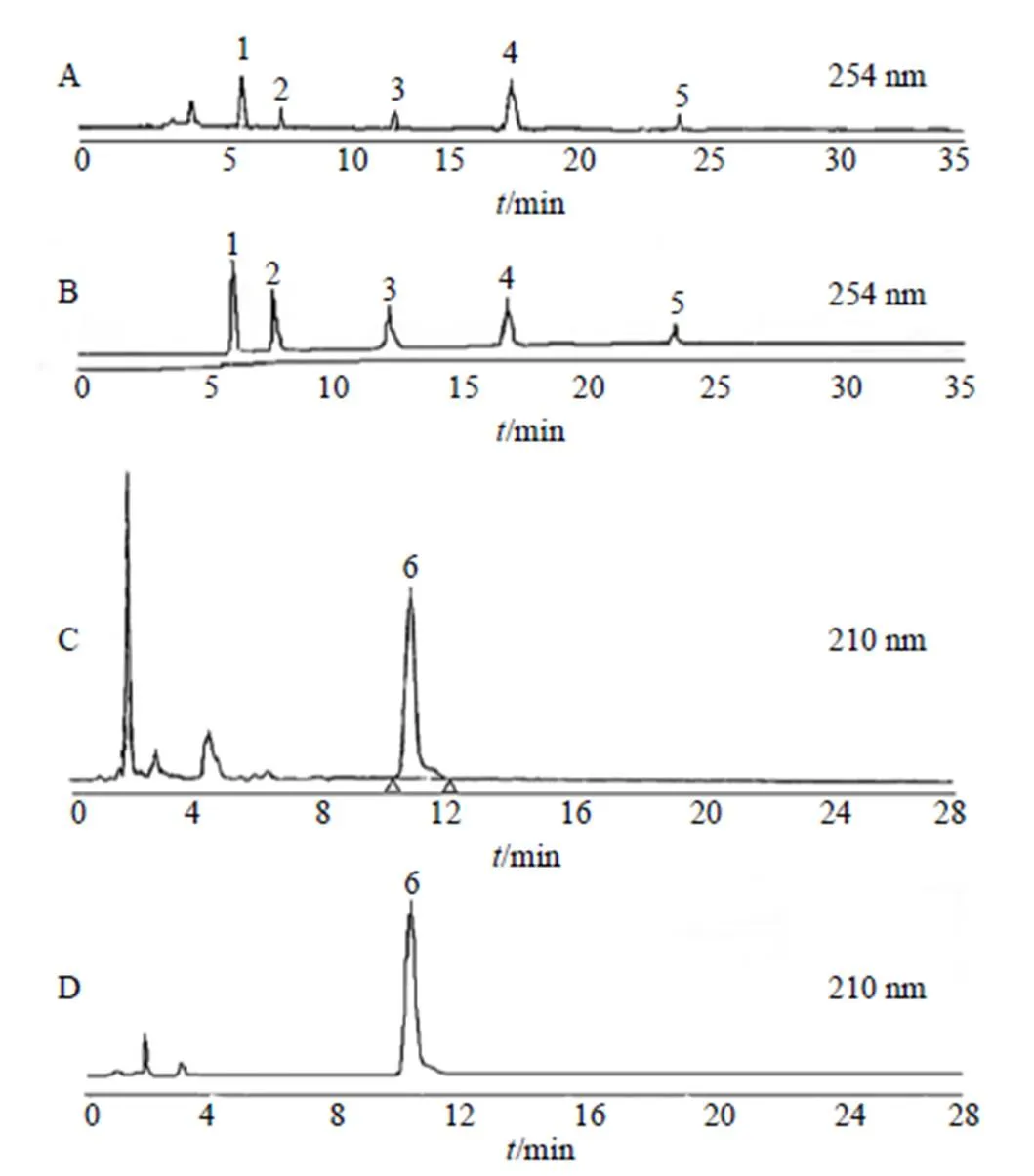
1-芦荟大黄素 2-大黄酸 3-大黄素 4-大黄酚 5-大黄素甲醚 6-苦杏仁苷
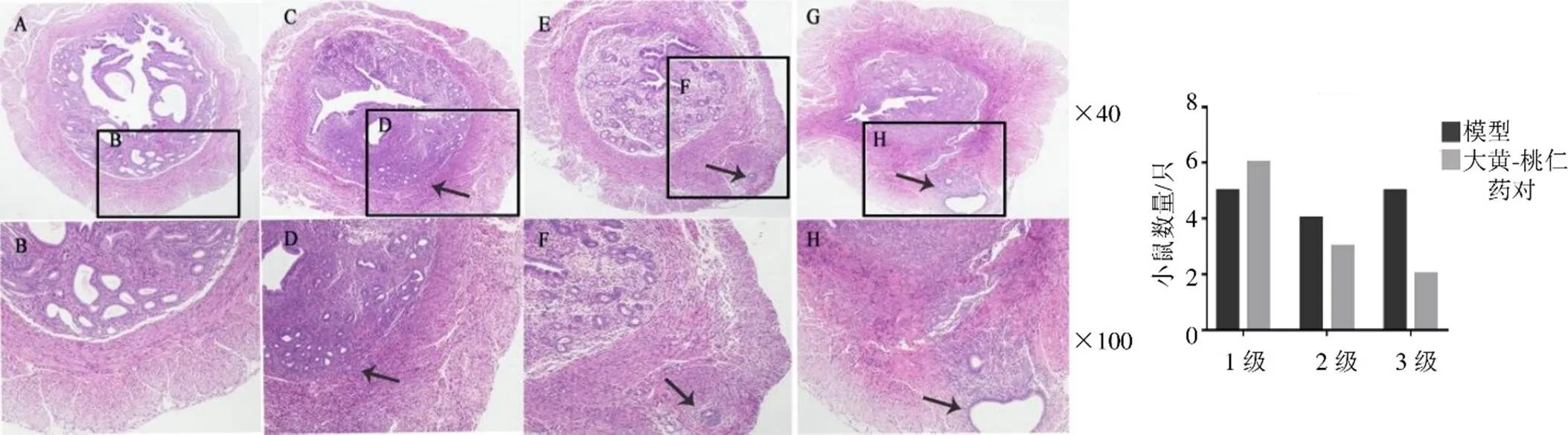
A、B-正常子宫横切面 箭头指示造模后子宫内膜腺体及间质逐渐浸润入内肌层(C、D,1级)、外肌层(E、F,2级)、浆膜下(G、H,腺肌瘤,3级),形成异位灶

黑色箭头标示线粒体,蓝色箭头标示溶酶体;黄色箭头标示线粒体自噬体

M为子宫平滑肌层,E为子宫内膜层,箭头为EMI处内膜腺体 与对照组比较:###P<0.001;与模型组比较:*P<0.05 ***P<0.001
3.3 体外实验结果
3.3.1 hEM15A细胞的培养及鉴定 如图5所示,镜下可见大量子宫内膜间质细胞,呈梭形。对其进行免疫荧光染色,波形蛋白染色阳性(红色),角蛋白染色阴性(绿色),细胞纯化率达90%以上。
3.3.2 CCK-8实验 如图6所示,hEM15A细胞增殖能力在大黄-桃仁药对处理48 h后显著下降,并呈剂量相关性。根据CCK-8实验结果,选择1 mg/mL大黄-桃仁药对给药48 h进行后续实验。

图5 hEM15A细胞的培养及鉴定
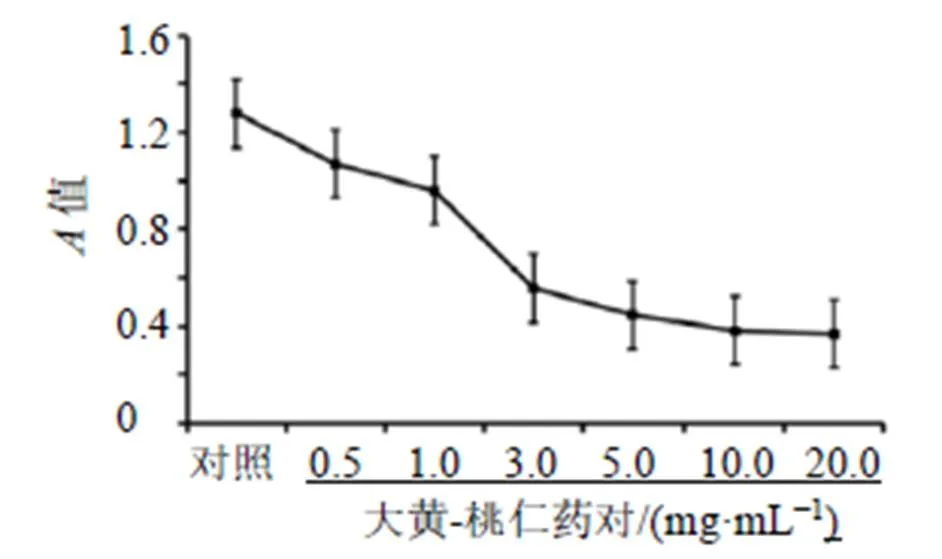
图6 大黄-桃仁药对对hEM15A细胞增殖的影响
3.3.3 Transwell实验检测大黄-桃仁药对处理前后hEM15A细胞的侵袭能力 如图7所示,经大黄-桃仁药对处理后,细胞的侵袭能力显著下降(<0.05)。
3.3.4 线粒体膜电位、ROS及抗氧化酶系的变化 如图8-A所示,hEM15A细胞有部分呈现JC-1单体形式,表示线粒体膜电位下降;经大黄-桃仁药对处理后,膜电位升高。如图8-B所示,hEM15A细胞ROS呈较高水平,经大黄-桃仁药对处理后ROS水平显著下降(<0.001)。如图8-C所示,经大黄-桃仁药对处理后,hEM15A细胞抗氧化酶系统(Cu- Zn SOD、Mn SOD、GSH-Px)活性上调(<0.01、0.001),氧化损伤指标MDA水平下调(<0.01)。

与对照组比较:*P<0.05
3.3.5 免疫荧光双染观察大黄-桃仁药对处理前后hEM15A细胞线粒体自噬水平变化 如图9-A、B所示,hEM15A细胞线粒体与溶酶体之间存在较强的共定位关系,经大黄-桃仁药对处理后,线粒体与溶酶体共定位的数量显著减少(<0.05)。Western blotting观察大黄-桃仁药对处理前后hEM15A细胞PINK1/Parkin通路及下游蛋白表达变化(图9-C),结果显示,经大黄-桃仁药对处理后PINK1、Parkin及其下游蛋白OPTIN、NDP52显著下调(<0.01、0.001)。
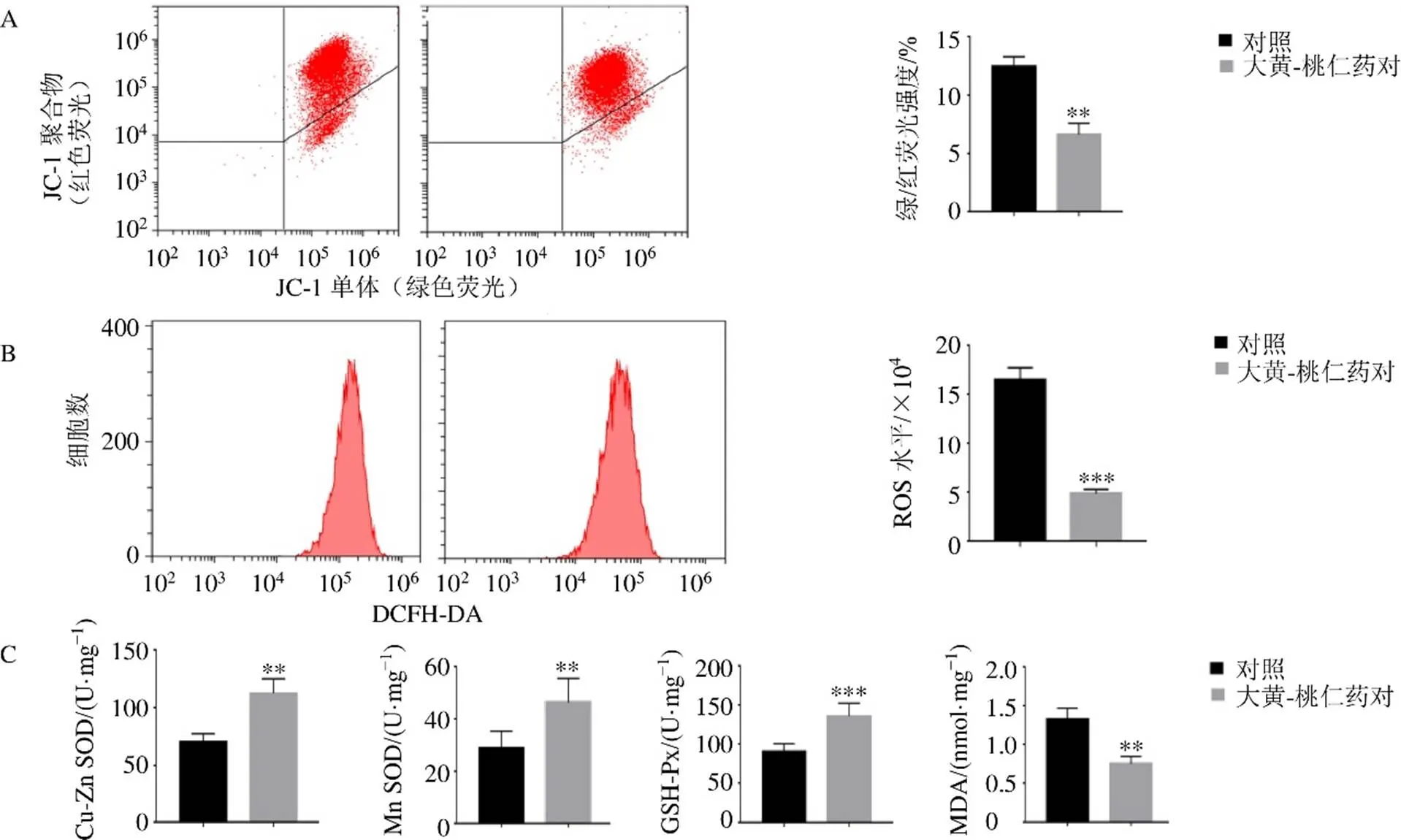
A-JC-1荧光染色 B-hEM15A细胞ROS水平 C-抗氧化酶系统Cu-Zn SOD、Mn SOD、GSH-Px活性及氧化损伤指标MDA水平 与对照组比较:**P<0.01 ***P<0.001
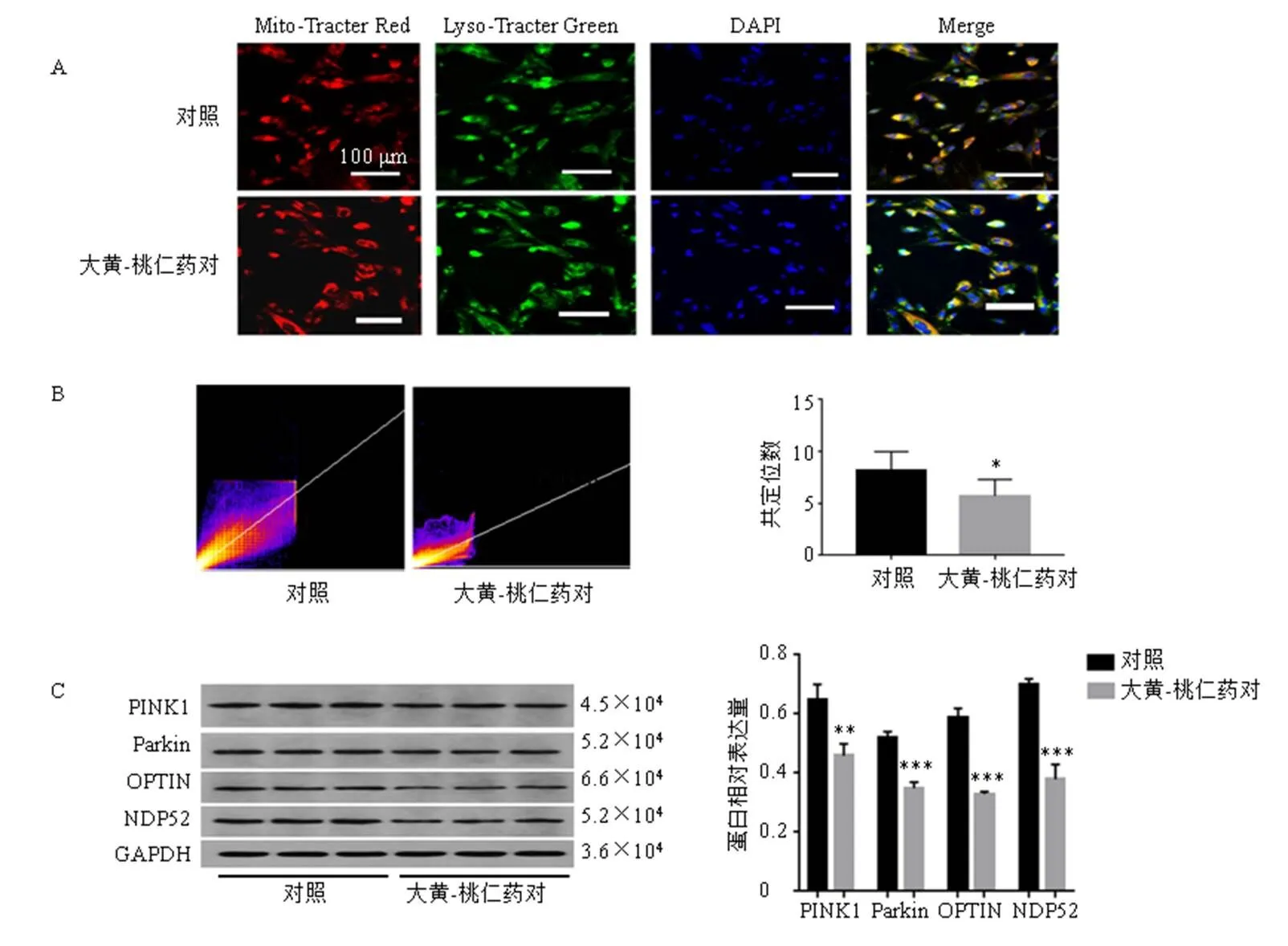
A-免疫荧光双染观察大黄-桃仁药对处理前后hEM15A细胞线粒体自噬水平(红色荧光标记线粒体,绿色荧光标记溶酶体,两者共定位黄色荧光为线粒体自噬) B-线粒体-溶酶体共定位散点图 C-线粒体自噬通路相关蛋白表达 与对照组比较:*P<0.05 **P<0.01 ***P<0.001
4 讨论
AM临床表现为进行性加重的痛经,属于中医学中“癥瘕”的范畴。中医理论认为,情志内伤、外邪入侵、体质因素或手术损伤导致气血失和、冲任损伤,瘀血恶血壅于肌肉,内结成块而致癥。因此,“瘀血致癥”是AM的核心病机环节,活血化瘀为其基本治疗大法[11]。化瘀类药物在AM治疗中获得高频次选用[12]。大黄-桃仁药对来源于中医经典活血化瘀方,桃核承气汤、下瘀血汤、大黄䗪虫丸、抵挡丸(汤)、鳖甲煎丸、大黄牡丹汤均含有该药对。其中,大黄下瘀血、破癥瘕积聚、推陈出新,桃仁活血化瘀、润肠通便,两者同用,刚柔相济、攻逐瘀血、直下胞宫[13]。本研究结果显示,经大黄-桃仁药对治疗的AM小鼠病理浸润程度减轻,中、重度浸润的比例下降。体外实验结果表明,大黄-桃仁药对可显著抑制hEM15A细胞增殖,并呈剂量相关性。
有研究者指出,在位内膜的超微结构变化可能对子宫内膜细胞特性起决定作用[14],其中,在位内膜乏氧线粒体损伤导致能量代谢异常是内膜异位发生的重要前提和潜在治疗靶点[7]。线粒体能量代谢异常,呼吸链在传递电子过程中发生电子丢失,可产生ROS。生理情况下产生的少量ROS,可由抗氧化酶系清除。当缺氧等特殊病理状态下时,线粒体抗氧化酶系(如Mn SOD、GSH)的防御功能减弱,ROS可持续累积,造成线粒体DNA、蛋白质和膜脂质的氧化损伤,跨膜电位下降,并可进一步导致线粒体受损、三磷酸腺苷(adenosine triphosphate,ATP)合成障碍,进而形成恶性循环,形成持续的氧化应激状态。研究表明,ROS可根据浓度对细胞增殖产生相反的影响[15],高浓度的ROS可直接诱导肿瘤细胞的死亡,但在慢性缺氧状态下,低于肿瘤细胞死亡阈值的亚临床剂量的ROS的累积[16],可通过激活核因子-κB(nuclear factor-κB,NF-κB)、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)等多种信号通路,增强胰腺癌[17]、乳腺癌[18]、淋巴瘤[19]、涎腺腺样囊性癌[20]等多种肿瘤细胞的侵袭能力。AM是一类有肿瘤样恶性增殖能力的疾病,有研究显示氧化应激与内膜异位的严重程度密切相关,ROS的特异性产物可作为患者预后评估的指标[16]。本研究结果显示,AM在位子宫内膜线粒体肿胀、脊消失,伴随线粒体膜电位下降及ROS的异常累积。
目前研究表明,化瘀类中药可以调控缺氧微环境下线粒体呼吸链酶系及抗氧化酶系,调控线粒体膜的稳定性,从而修复受损线粒体,抑制细胞异常增殖能力。川芎嗪可以通过保护线粒体酶和膜电位,减少ROS产生[21];八珍汤[22]、大黄酚[23]等可通过调节线粒体ROS合成酶还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamideadenine dinucleotide phosphate,NADPH)及ROS清除酶SOD、GSH活性,直接清除OH−、O2−;泽兰[24]、紫草[25]、丹皮酚[26]等能抑制ROS诱导的氧化炎症级联反应,防止线粒体的进一步损伤。含有大黄-桃仁核心药对的中医经典活血化瘀方大黄蛰虫丸可通过调节缺氧应激条件下的线粒体能量代谢[9]抑制细胞异常侵袭能力[8]。本研究结果得到相似的结论,证实化瘀药对大黄-桃仁能够有效改善在位内膜间质细胞线粒体膜电位,减少ROS产生,调控抗氧化酶系,减少氧化损伤。
线粒体自噬是调控受损线粒体质量的重要机制之一,可隔离并清除功能失调且具有潜在危险的线粒体,是维持细胞内环境稳定的关键[27]。线粒体自噬需要识别受损的线粒体成分,并将线粒体与溶酶体融合为线粒体吞噬小体[28]。PINK1是线粒体损伤的主要探测器,健康线粒体PINK1蛋白含量极低[29],去极化的线粒体抑制PINK1的降解途径,导致PINK1在线粒体外膜的磷酸化激活及蓄积。激活的PINK1介导Parkin从胞质转位到损伤的线粒体外膜。Parkin具有泛素-蛋白连接酶活性[30],介导线粒体外膜蛋白的泛素化。自噬受体蛋白NDP52、OPTIN等可识别泛素化的线粒体,同时锚定自噬囊泡膜,形成线粒体-自噬溶酶体,最终移除损伤线粒体[31]。目前对线粒体自噬在子宫内膜异位症中的调控存在争议。有研究者认为,下调线粒体自噬可显著降低子宫内膜间质细胞的迁移和存活能力[32];但另有研究者持相反的看法,认为激活线粒体自噬通路有助于病变体积、面积和直径的减少[33]。本研究对AM小鼠子宫在位内膜细胞的电镜观察发现,与正常小鼠相比,无论间质细胞还是腺上皮细胞,其线粒体数量均显著减少,线粒体发生了肿胀、线粒体脊消失,病变线粒体周围溶酶体显著增多,并可见到线粒体与溶酶体融合的增加。与此同时,AM模型小鼠PINK1和Parkin蛋白显著上调。因此推测在AM中存在线粒体受损、其形态结构发生异常,而伴随的线粒体自噬的过度激活,可使损伤线粒体被清除而不是被修复,致线粒体数量的减少,最终发生细胞功能的异常和缺陷。进一步研究发现,经大黄-桃仁药对治疗后,线粒体与溶酶体融合的线粒体吞噬小体减少,线粒体的数量增加,形态趋于正常,线粒体双层膜结构及线粒体脊清晰可见。在体外研究中,发现大黄-桃仁药对可减少线粒体自噬的数量,并显著下调PINK1、Parkin、NDP52、OPTIN蛋白表达,证实大黄-桃仁药对可介导PINK1/Parkin信号通路调控线粒体自噬水平。
综上,化瘀药对大黄-桃仁可通过改善线粒体抗氧化酶系、调控线粒体自噬水平、恢复线粒体膜电位等多途径减轻AM在位内膜细胞乏氧线粒体损伤,下调氧化应激水平,最终抑制细胞的异常增殖。
利益冲突 所有作者均声明不存在利益冲突
[1] Upson K, Missmer S A. Epidemiology of adenomyosis [J]., 2020, 38(2/3): 89-107.
[2] Yu O, Schulze-Rath R, Grafton J,. Adenomyosis incidence, prevalence and treatment: United States population-based study 2006-2015 [J]., 2020, 223(1): 94.
[3] Alcalde A M, Martínez-Zamora M Á, Gracia M,. Impact of adenomyosis on women’s psychological health and work productivity: A comparative cross-sectional study [J]., 2021, 30(11): 1653-1659.
[4] Vannuccini S, Luisi S, Tosti C,. Role of medical therapy in the management of uterine adenomyosis [J]., 2018, 109(3): 398-405.
[5] Wang H X, Zhang J H, Zhu Q Q,. Integrating network pharmacology and experimental validation deciphers the mechanism of Guizhi Fuling Wan against adenomyosis [J]., 2021, 2021: 6034147.
[6] 付先芸, 魏绍斌. 子宫腺肌病小鼠血管生成及雌激素效应因子的相互作用机制 [J]. 武汉大学学报: 医学版, 2015, 36(6): 883-886.
[7] Govatati S, Deenadayal M, Shivaji S,. Mitochondrial NADH: Ubiquinone oxidoreductase alterations are associated with endometriosis [J]., 2013, 13(6): 782-790.
[8] 李萍, 舒琦瑾. 大黄䗪虫丸对Lewis肺癌小鼠血管生成的影响及机制 [J]. 中华中医药学刊, 2015, 33(1): 175-178.
[9] 吴丽, 倪子惠, 赵佳妤, 等. 大黄虫丸含药血清对肝癌SMMC-7721细胞能量代谢的影响 [J]. 中成药, 2018, 40(7): 1473-1478.
[10] Zhang X M, Yuan H, Deng L,. Evaluation of the efficacy of a danazol-loaded intrauterine contraceptive device on adenomyosis in an ICR mouse model [J]., 2008, 23(9): 2024-2030.
[11] 毕映雪. 基于数据挖掘的子宫腺肌病痛经用药规律分析及临床疗效观察 [D]. 济南: 山东中医药大学, 2020.
[12] 王领弟, 李盼盼, 张芳, 等. 基于中医传承辅助平台的中医药治疗子宫腺肌病用药规律分析及研究 [J]. 时珍国医国药, 2018, 29(3): 742-744.
[13] 廖姿, 张家琼, 付先芸, 等. 基于网络药理学的“大黄-桃仁”配伍治疗子宫腺肌病的作用机制研究 [J]. 中国中药杂志, 2020, 45(17): 4112-4119.
[14] 张颖, 周莉, 王红月, 等. 子宫结合带区肌细胞超微结构特点的研究 [J]. 中华妇产科杂志, 2015, 50(1): 37-40.
[15] Vilema-Enríquez G, Arroyo A, Grijalva M,. Molecular and cellular effects of hydrogen peroxide on human lung cancer cells: Potential therapeutic implications [J]., 2016, 2016: 1908164.
[16] 孙博, 申爱荣. 子宫内膜异位症并不孕患者血清、腹腔液中8-iso-PGF2α、GSH-PX的表达 [J]. 中国妇幼保健, 2010, 25(27): 3936-3938.
[17] Li W, Ma Z H, Ma J G,. Hydrogen peroxide mediates hyperglycemia-induced invasive activity via ERK and p38 MAPK in human pancreatic cancer [J]., 2015, 6(31): 31119-31133.
[18] Guo J Y, Xu Y, Ji W W,. Effects of exposure to benzo[a]pyrene on metastasis of breast cancer are mediated through ROS-ERK-MMP9 axis signaling [J]., 2015, 234(3): 201-210.
[19] 于卫华, 周庆彪, 刘颖, 等. 活性氧调控炎症诱发肿瘤机制的研究进展 [J]. 癌变·畸变·突变, 2016, 28(2): 158-161.
[20] Chang B Y, Yang H, Jiao Y,. SOD2 deregulation enhances migration, invasion and has poor prognosis in salivary adenoid cystic carcinoma [J]., 2016, 6: 25918.
[21] Gong X Z, Ivanov V N, Davidson M M,. Tetramethylpyrazine (TMP) protects against sodium arsenite-induced nephrotoxicity by suppressing ROS production, mitochondrial dysfunction, pro-inflammatory signaling pathways and programed cell death [J]., 2015, 89(7): 1057-1070.
[22] Song E Q, Fu J L, Xia X M,. Bazhen Decoction protects against acetaminophen induced acute liver injury by inhibiting oxidative stress, inflammation and apoptosis in mice [J]., 2014, 9(9): e107405.
[23] Lin F Q, Zhang C, Chen X Z,. Chrysophanol affords neuroprotection against microglial activation and free radical-mediated oxidative damage in BV2murine microglia [J]., 2015, 8(3): 3447-3455.
[24] Tsai M H, Lin Z C, Liang C J,. Eupafolin inhibits PGE2 production and COX2 expression in LPS-stimulated human dermal fibroblasts by blocking JNK/AP-1 and Nox2/p47(phox) pathway [J]., 2014, 279(2): 240-251.
[25] Prasad R G, Choi Y H, Kim G Y. Shikonin isolated fromdownregulates proinflammatory mediators in lipopolysaccharide-stimulated BV2microglial cells by suppressing crosstalk between reactive oxygen species and NF-κB [J]., 2015, 23(2): 110-118.
[26] Lin C, Lin H Y, Chen J H,. Effects of paeonol on anti-neuroinflammatory responses in microglial cells [J]., 2015, 16(4): 8844-8860.
[27] Strack R. A clearer view of mitophagy [J]., 2020, 17(7): 656.
[28] Galluzzi L, Vitale I, Aaronson S A,. Molecular mechanisms of cell death: Recommendations of the Nomenclature Committee on Cell Death 2018 [J]., 2018, 25(3): 486-541.
[29] Thomas R E, Andrews L A, Burman J L,. PINK1-Parkin pathway activity is regulated by degradation of PINK1 in the mitochondrial matrix [J]., 2014, 10(5): e1004279.
[30] Harper J W, Ordureau A, Heo J M. Building and decoding ubiquitin chains for mitophagy [J]., 2018, 19(2): 93-108.
[31] Fu T, Liu J P, Wang Y L,. Mechanistic insights into the interactions of NAP1 with the SKICH domains of NDP52 and TAX1BP1[J]., 2018, 115(50): E11651-E11660.
[32] Zhao Q D, Ye M X, Yang W,. Effect of Mst1 on endometriosis apoptosis and migration: Role of Drp1-related mitochondrial fission and parkin-required mitophagy [J]., 2018, 45(3): 1172-1190.
[33] Siracusa R, D'Amico R, Impellizzeri D,. Autophagy and mitophagy promotion in a rat model of endometriosis [J]., 2021, 22(10): 5074.
Mechanism ofetSemen drug pair on regulating endometrial mitochondrial homeostasis in adenomyosis
YI Yong-li, LEI Ya, WANG Kun, FU Xian-yun, CAI San-jin
Medical college of China Three Gorges University, Third-Grade Pharmacological Laboratory on Chinese Medicine Approved by State Administration of Traditional Chinese Medicine, Yichang 443000, China
To explore the regulation mechanism of Dahuang (et)-Taoren () drug pair (RP) on endometrial mitochondrial homeostasis in adenomyosis (AM).AM mice model was established by allogeneic pituitary transplantation. Histopathological and ultrastructural changes of uterus before and after treatment with RP were observed by light microscope and transmission electron microscope (TEM). Immunofluorescence was used to detect PTEN-induced putative kinase 1 (PINK1)/Parkinson protein (Parkin) expressions. Human immortalized endometriosis eutopic endometrial stromal cells hEM15A were cultured, and the effects of RP on cell proliferation, reactive oxygen species (ROS), antioxidant enzymes, mitochondrial membrane potential, mitophagosomes and mitophagy proteins changes.Pathological sections showed that compared with model group, proportion of moderate and severe infiltration was reduced after treatment with RP. TEM observation showed that mitochondria of endometrial epithelial cells and interstitial cells in model group were swollen, mitochondrial ridges were disappeared and some mitophagosomes were formed; The number of mitochondria in endometrial epithelial cells and interstitial cells were increased after treatment with RP, there was no obvious swelling, and mitochondrial ridges were clearly visible. Compared with control group, PINK1 and Parkin expressions in endometrial layer after modeling were significantly up-regulated (< 0.001); After treatment with RP, PINK1 and Parkin expressions were significantly decreased (< 0.05, 0.001). The results ofexperiments showed that mitochondrial membrane potential of hEM15A cells was decreased, and ROS level was higher; After treatment with RP, proliferation and invasion abilities of hEM15A cells were decreased (< 0.05, 0.001), mitochondrial membrane potential was increased, ROS level was decreased (< 0.001), antioxidant enzyme systems Cu-Zn superoxide dismutase (SOD), Mn-SOD and glutathione peroxidase (GSH-Px) activities were up-regulated (< 0.01, 0.001), and oxidative damage index malondialdehyde (MDA) level was down-regulated (< 0.01). There was a strong co-localization relationship between mitochondria and lysosomes in hEM15A cells. After treatment with RP, number of mitochondria and lysosomes co-localized was significantly reduced (< 0.05), PINK1, Parkin and their downstream proteins Optineurin (OPTIN), nuclear dot protein 52 (NDP52) were significantly down-regulated after treatment with RP (< 0.01, 0.001).RP can maintain hypoxic mitochondrial homeostasis of AM resident endomembrane cells by improving mitochondrial antioxidant enzymes, regulating level of mitophagy and restoring mitochondrial membrane potential, thereby reducing oxidative stress injury.
et-drug pair; adenomyosis; endometrial mitochondrial homeostasis; mitophagy; oxidative stress
R285.5
A
0253 - 2670(2022)15 - 4709 - 10
10.7501/j.issn.0253-2670.2022.15.014
2022-03-09
国家自然科学基金面上项目(81973897)
易永丽,硕士研究生,研究方向为中药药理研究。E-mail: 728113811@qq.com
通信作者:付先芸,副教授,硕士生导师,研究方向为子宫内膜异位性疾病及慢性盆腔疼痛。E-mail: dinnar1@163.com
蔡三金,副教授,研究方向为中医药治疗妇科疾病。E-mail: 106680558@qq.com
#共同第一作者:雷 娅,硕士研究生,研究方向为慢性盆腔疼痛。E-mail: 283392724@qq.com
[责任编辑 李亚楠]
