基于新型金属有机框架模拟酶的电化学检测食品胆固醇体系的构建
2022-08-01关桦楠刘晓飞刘树萍崔琳琳
张 悦, 关桦楠, 刘晓飞, 刘树萍, 崔琳琳, 宋 岩
(哈尔滨商业大学 食品工程学院, 黑龙江 哈尔滨 150028)
胆固醇是一种广泛存在于质膜中的甾体成分,也是胆汁酸、维生素D和激素等活性成分的前体物质,是人体所必需的营养成分[1]。血液中的胆固醇水平却与许多疾病密切相关,例如当血液中的胆固醇浓度处于高水平时,血管会发生堵塞,若血液中的胆固醇浓度处于低水平时,则会导致贫血、甲状腺功能亢进和营养不良等疾病。因此,灵敏、准确地检测食品中的胆固醇含量对疾病的预防具有重要意义。目前,胆固醇的常规检测方法主要有:高效液相色谱法[2]、比色法[3]、荧光法[4]和电化学法[5]等。其中,应用电化学法检测食品中胆固醇的含量具有高效、灵敏和准确等优势。例如Alagappan等[6]构建了基于金纳米颗粒- 功能化多壁碳纳米管- 聚吡咯/胆固醇氧化酶(Au-f-MWCNT-PPy/ChOx)的胆固醇电化学生物传感器,其中聚吡咯纳米材料作为支撑矩阵来维持胆固醇氧化酶的活性。Wu等[7]基于分层技术,成功开发了一种由水溶性聚乙烯亚胺还原氧化石墨烯(PEIrGO)复合材料和胆固醇氧化酶(ChOx)组成的新型电化学检测胆固醇平台。发现利用分层技术,ChOx可以良好地嵌入PEIrGO多层膜中。Jayanthi等[8]制备了一种新型的基于菊粉的纳米复合材料TiO2-MWCNT@Inulin,将ChOx固定化到纳米复合材料中,并修饰于玻碳电极上,用于胆固醇的检测。这些电化学检测胆固醇的方法依赖于天然胆固醇氧化酶的活性,然而,天然酶在极端条件下稳定性差、易变性失活,对环境变化高度敏感、易影响催化效率,使其应用受到限制[9]。
相较于天然酶易于失活的性质,人工合成的具有类酶活性的材料代替天然酶引起了广泛的关注。其中,金属有机框架(metal organic frame,MOF)被认为是模拟酶的理想材料[10]。金属有机框架是由金属离子或金属簇与有机配体通过配位键自组装而成的多孔网状结构的纳米杂化材料[11]。MOF中的金属团簇或金属离子一般为过渡金属离子和镧系离子,而有机配体通常含有吡啶和氰基、冠醚、多胺、膦酸盐、羧酸盐等官能团,这些官能团在MOF中起连接金属离子的桥梁作用[12]。近年来,金属有机框架作为模拟酶的研究愈加得到广泛的关注,与天然酶相比,其具有成本低、结构稳定、易于贮存和活性可调等的明显优势[13]。然而,与其他复合的金属有机框架相比,单金属有机框架的酶活性较低且不易显现。因此,本研究将在单金属有机框架的基础上增加其他纳米材料制备复合金属有机框架以提高其酶活性。在众多纳米材料中,Fe3O4磁性粒子和金纳米粒子均具有类过氧化物酶的活性[14-15],将二者加入到金属有机框架中可提高复合纳米粒子的类过氧化物酶的活性。此外,Fe3O4作为一种生物相容性磁性材料,可以通过磁铁对其进行回收并可重复利用[16-17]。金纳米粒子可通过调谐信号放大和加速电子转移,大大增强了电化学传感器的灵敏度和选择性[18-19]。因此,将Fe3O4磁性粒子和金纳米粒子与金属有机框架结合而成的纳米粒子复合材料兼具这些材料的所有优点,可以更加广泛地进行应用。本团队前期研究结果表明,Fe3O4磁性粒子和金纳米粒子具有良好的类过氧化物酶活性以及催化性能,因此选择其加入金属有机框架之中[20-22]。
本研究将Fe3O4磁性粒子和过渡金属铜离子(Cu2+)分散于对苯二甲酸(p-phthalic acid,PTA)形成的二维网状结构中,形成具有磁性的铜基金属有机框架(Fe3O4@Cu- MOF),并将金纳米粒子(Au Nanoparticles,AuNPs)嵌入其网络结构中,制备出具有酶活性的金属有机框架模拟酶(Fe3O4@Au/MOF)。由于协同效应,Fe3O4@Au/MOF综合了Fe3O4纳米粒子(Fe3O4nanoparticles,Fe3O4NPs)和AuNPs的双重催化性能,使其具有增强型的类过氧化物酶活性。此外,由于Fe3O4NPs的磁性核心具有较大的表面自由能和强磁偶极矩的相互作用,可以重复的回收利用,减少利用成本,然而彼此之间也容易发生聚集现象,降低催化活性。同样地,金纳米粒子之间也会发生聚集,从而阻碍了金纳米粒子之间的势能或电子转移过程。AuNPs具有高比表面积、优异的表面改性能力和高稳定性等独特的模拟酶性质,已成功地在许多电化学反应中用作有效的电催化剂[23]。利用空间效应,将二维网状结构的金属有机框架作为支撑基底可以减少金属合成过程中的结块现象来克服纳米颗粒自身的不足,有助于提高其催化活性。金属有机框架作为有效的电活性材料,具有快速传质和优异电子转移的纳米厚度、极高百分比的暴露活性表面以及易于识别和可调的原子结构和键合排列的独有特性[24]。而过渡金属铜的参与使得金属有机框架不仅具有这些优点,而且更加的稳定,不易被破坏。因此由Fe3O4NPs、AuNPs和铜基金属有机框架组成的Fe3O4@Au/MOF复合纳米材料具有较高的稳定性以及较强的过氧化物酶活性。Fe3O4@Au/MOF可使胆固醇氧化为胆甾烯三酮和过氧化氢(H2O2),而H2O2在模拟酶的催化下产生的具有氧化活性的羟基自由基(·OH)促进了3,3′,5,5′-四甲基联苯胺(3,3′,5,5′-tetramethylbenzidine,TMB)发生氧化还原反应,进而增加了体系中电荷的移动。基于此原理,构建出了Fe3O4@Au/MOF模拟酶增强型电化学胆固醇检测体系。希望本研究可为食品中胆固醇的检测技术的更新和无酶型传感器的构建提供新的选择。
1 材料与方法
1.1 材料与试剂
醋酸、醋酸钠、乙醇,辽宁馥源化工有限责任公司;3,3′,5,5′-四甲基联苯胺,梯希爱(上海)化成工业发展有限公司;胆固醇,北京鸿润宝顺科技有限公司;FeCl3·6H2O,国药集团化学试剂有限公司;聚乙烯吡咯烷酮,攻碧克新材料科技(上海)有限公司;N,N-二甲基甲酰胺,漯河豫博生物化工有限公司;硫酸铜,北京迈瑞达科技有限公司;对苯二甲酸,成都欧恩瑞思化学试剂有限公司;氯金酸,天津市科密欧化学试剂有限公司;硼氢化钠,上海宏瑞化工有限公司。实验所用试剂均为分析纯。
黄油,内蒙古蒙牛奶酪有限责任公司。
1.2 仪器与设备
KQ- 3200型超声波清洗器,昆山市超声仪器有限公司;FC- 204型电子天平,沈阳龙腾电子有限公司;PHS- 3C型pH计,上海雷磁精密科学仪器有限公司;CHI660E型电化学工作站,上海辰华仪器有限公司;HWS- 24型电热恒温水浴锅,上海一恒科学仪器有限公司;HZQ- QA型全温恒温摇床,苏州威尔实验用品有限公司;YH- 1019型水热反应釜,河南豫华仪器科技有限公司;DHG- 9203A型电热恒温鼓风干燥箱,上海善志仪器设备有限公司;Nicolet- iS20型傅里叶红外光谱,苏州英莳特仪器科技有限公司;LVEM5型透射电子显微镜,QUANTUM量子科学仪器贸易(北京)有限公司;EscaLab Xi型X射线光电子能谱仪,英国赛默飞世尔科技有限公司。
1.3 实验方法
1.3.1金属有机框架模拟酶的制备和表征方法
采用改良的绿色还原法制备金纳米粒子。取20 g切碎的新鲜橙皮在80 ℃去离子水中浸泡1 h,然后将滤液3 500 r/min离心5 min,用去离子水稀释上清液,得到橙皮备用溶液,并在4 ℃下保存。将预冷到4 ℃的20 mL氯金酸放入烧杯中,在磁力搅拌器下搅拌均匀,快速加入5 mL橙皮备用溶液。随着搅拌速度的不断提高,体系的颜色由黄色变为酒红色。当颜色在30 min内没有变化时,反应完成,即可以得到金纳米粒子溶液。
将2 g合成的Fe3O4纳米微粒加入10 mL乙醇中,并置于摇床中振荡30 min后,再依次加入3 g的聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP)、20 mL乙醇和45 mL的N,N-二甲基甲酰胺(N,N-dimethylformamide,DMF),并进行45 min的超声处理,之后,向其中加入10 mL浓度为0.05 mol/L的二价铜离子标准溶液和2 g的对苯二甲酸粉末,并在摇床中振荡充分反应30 min,将经过振荡处理的混合溶液置于水热反应釜中,在200 ℃的高温下反应6 h,再用乙醇和蒸馏水对混合溶液进行多次洗涤,直至洗涤水变为清澈,最后将洗涤干净的金属有机框架(Fe3O4@Cu- MOF)置于干燥箱中干燥至恒重。将Fe3O4@Cu- MOF超声分散于5 mL的蒸馏水中后,加入5 mL的金纳米粒子溶液并置于摇床中振荡6 h,再加入10 mL浓度为0.1 mol/L的硼氢化钠水溶液,超声震荡45 min,最后用蒸馏水进行洗涤,干燥至恒重得到Fe3O4@Au/MOF二维磁性金属有机框架。采用傅里叶红外光谱(fourier transform infrared spectrometer,FTIR)和透射电子显微镜(transmission electron microscope,TEM)以及X射线光电子能谱(X-ray photoelectron spectroscopy,XPS)对其结构和表观形貌进行分析。
1.3.2金属有机框架模拟酶电化学增强检测体系的优化
1.3.2.1 单因素实验方法
将不同质量的Fe3O4@Au/MOF粉末(0.002 5、0.005、0.007 5、0.010 0 g和0.012 5 g)分别加入不同pH值(4、5、6、7和8)的10 mL的HAc- NaAc缓冲溶液中混匀,并将其置于不同的恒定温度(20、30、40、50℃和60 ℃),加入400 μL浓度为1 mmol/L胆固醇标准溶液(采用乙醇溶解胆固醇粉末),充分反应15 min后,再加入200 μL的10 mmol/L的TMB溶液,并采用不同扫描速率(0.02、0.04、0.06、0.08 V/s和0.10 V/s)的电化学工作站进行检测。监测氧化峰电流的绝对值,并将其作为体系指标,指标越大越好。
1.3.2.2 正交试验方法
分别考察反应Fe3O4@Au/MOF添加量(A因素)、温度(B因素)、扫描速率(C因素)和pH值(D因素)对整个实验体系的影响,每种因素设计3个水平(根据单因素实验优化得出),选用L9(34)正交设计表进行优化实验方案。采用电化学工作站三电极系统,利用循环伏安法(cyclic voltammetry,CV)检测体系中的胆固醇浓度,监测氧化峰电流绝对值的变化,并确定因素影响的主次顺序及优选方案。
1.3.3金属有机框架模拟酶电化学检测胆固醇工作曲线的构建
按照优化实验得出的最适金属有机框架模拟酶电化学增强检测体系对不同浓度(0.001、0.005、0.010、0.050、0.100、0.200、0.500、1.000 mmol/L和1.500 mmol/L)的胆固醇进行检测,以胆固醇的浓度为横坐标,以氧化峰电流绝对值为纵坐标,绘制工作曲线,并计算最低检测限和回收率。
1.3.4金属有机框架模拟酶电化学检测胆固醇的抗干扰性研究
为验证电化学体系在检测过程中的抗干扰性能,在最优实验条件下向电化学检测体系中分别加入浓度为50 mmol/L的乳糖、甘氨酸、半胱甘酸、葡萄糖、Cu2+、Na+和K+常见干扰物质,观察氧化峰电流绝对值的变化,对其抗干扰性能进行评估。
1.3.5实际样品的检测研究
为了探讨构建的电化学增强检测体系在实际样品中的可行性,选择黄油作为样品进行胆固醇的检测。准确称取1 g黄油于烧杯中,并加入10 mL的2 mol/L氢氧化钾和10 mL的乙醇标准溶液,充分混合后将其置于60 ℃的水浴锅内加热1 h(加热过程中不断搅拌)。皂化完全后,冷却至室温,在分液漏斗中用乙醚萃取3次,将收集的萃取液中的乙醚挥发回收后,加入10 mL乙醇溶液溶解并定容作为待分析样液,利用所得到的最佳检测体系对其中的胆固醇含量进行检测。然后将配置好的胆固醇标准液加入黄油待分析样液中,使加标浓度分别为0.25、0.50、1.00 mmol/L。按照胆固醇最优电化学增强检测体系分别检测3种不同浓度样品溶液的氧化峰电流绝对值,代入工作曲线回归方程,测定其加标回收率并评价检测体系的准确度和精密度。
1.4 数据处理
数据平行,统计分析。每个样品重复分析3次,采用Microsoft Excel、SPSS和Origin进行数据统计与分析做图。
2 结果与分析
2.1 金属有机框架模拟酶的表征
首先,对自组装法制备的磁性金属有机框架模拟酶(Fe3O4@Au/MOF)进行了红外光谱分析,见图1。根据图1可知,位于500~750 cm-1的吸收峰是Fe—O键伸缩振动产生的;位于1 000~1 250 cm-1的吸收峰是醇羟基中C—O键伸缩振动产生的;位于1 625 cm-1处是一级酰胺的特征吸收峰,是由于N—H的弯曲振动所产生的,由此也证明了该金属有机框架具有氨基;与此同时,在2 250~2 750 cm-1的两个吸收峰是由于醛基质子的费米共振产生的伸缩振动而引起的;位于3 750~4 000 cm-1的吸收峰是酚羟基—OH键中O—H伸缩振动产生的。
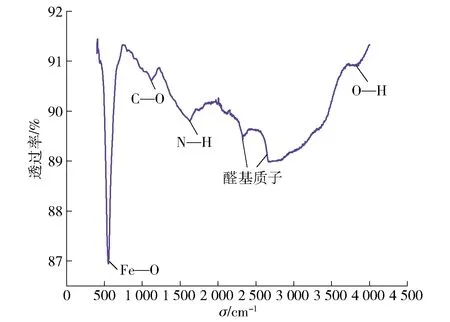
图1 Fe3O4@Au/MOF的红外光谱表征
其次,利用透射电子显微镜对制备的Fe3O4@Au/MOF的大小及分布情况进行了表征,见图2。图2显示了不同分辨率下Fe3O4@Au/MOF金属有机框架的TEM图像。由图2可知,该纳米微粒的平均粒径为8~15 nm,从图中可以看出,由表面粗糙的分散球组成的大团簇的直径约为600 nm。

图2 Fe3O4@Au/MOF的透射电子显微镜表征
采用XPS进一步对Fe3O4@Au/MOF复合材料的组成进行分析,见图3。由图3可知,在XPS中,3组主要峰分别为Fe 2p、Au 4f和Cu 2p。Fe 2p的高分辨率XPS光谱包含两个结合能值,分别为710.55 eV和724.32 eV,这两个结合能值分别代表双峰的Fe 2P3/2和Fe 2P1/2,这和Fe3O4磁性粒子的特征表现一致。在93.55 eV处可以观察到Au 4f区域的光谱,这表明了AuNPs在体系溶液中保持着金属状态[25-26]。932.52 eV处可以观察到Cu 2p区域的光谱,这与金属Cu的标准结合能相符合[27]。
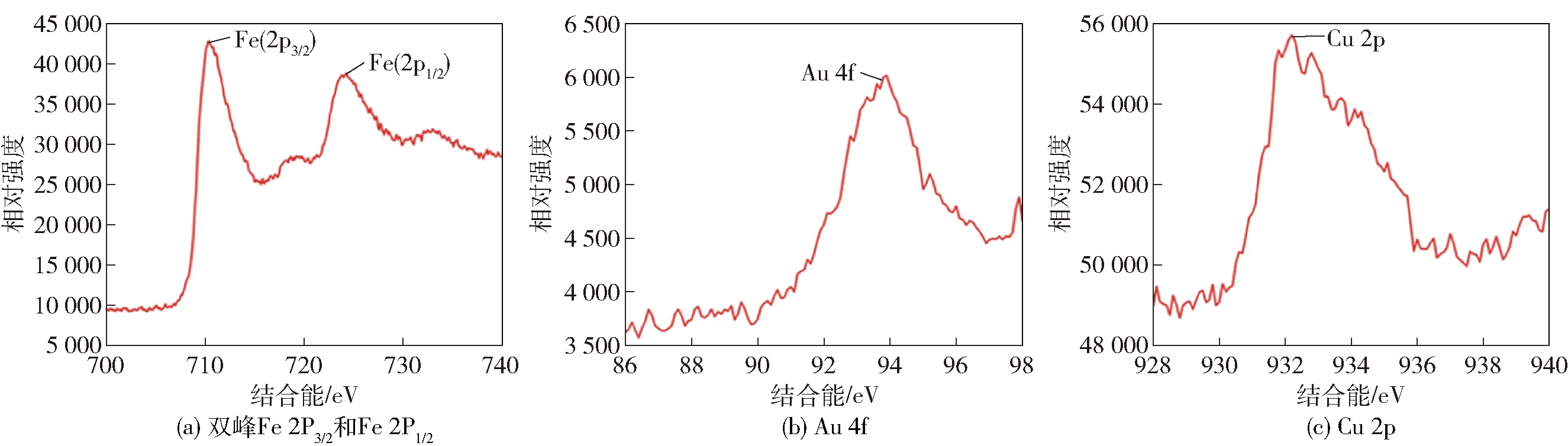
图3 Fe3O4@Au/MOF的XPS表征
2.2 金属有机框架模拟酶电化学增强检测体系的优化结果
2.2.1单因素实验的优化结果
依据1.3.2.1节实验方案,进行条件优化,结果见图4。
2.2.1.1 扫描速率的影响
在考察扫描速率对电化学增强检测体系影响的过程中,不仅要筛选出合适的水平,还要鉴定其与电流的线性关系。由图4(a)可知,随着扫描速率的增加,体系中的氧化峰电流绝对值明显上升,且氧化峰电流绝对值与扫描速率之间具有良好的线性关系,回归方程为y=112.4x+3.374,R2=0.995 8。这是由于体系中的电子转移过程受控于扩散效应,扫描速率增加,电子转移速率随之增大,电化学响应增加,从而氧化峰电流绝对值增高。因此,选取扫描速率为0.06、0.08、0.10 V/s参与正交设计优化实验最为适合。
2.2.1.2 pH值的影响
由图4(b)可知,当pH=4时,氧化峰电流绝对值达到最高点,此时的Fe3O4@Au/MOF模拟酶催化活性最为显著,同时在较酸性的溶液中含有大量的质子,并与胆固醇分子中的—OH基团相互作用[28],从而促使大量电子进行转移,电化学响应增加。当pH处于5~8时,随着pH不断地增加,氧化峰电流绝对值呈现显著的下降的趋势,这可能是由于体系中的质子随着pH的增加而不断减少,而质子参与体系中的氧化还原反应[29]。因此,体系中的电子转移量减少,从而电化学响应降低,氧化峰电流绝对值减小。综上所述,选取pH为4、5和6参与正交设计优化实验最为适合。
2.2.2.3 金属有机框架添加量的影响
由图4(c)可知,检测体系体积为10.60 mL,Fe3O4@Au/MOF添加量在0.002 5~0.010 0 g时,氧化峰电流绝对值随添加量的增加逐渐增大。这是由于在电化学增强检测体系中,一方面,随着Fe3O4@Au/MOF添加量的增加,体系内的模拟酶活性也增强,促进了胆固醇反应产生更多的过氧化氢,并使得过氧化氢产生具有氧化活性的自由基,从而与TMB发生氧化还原反应,增加了电子转移量,进而增加电流响应,氧化峰电流绝对值上升。当Fe3O4@Au/MOF添加量处于0.010 0~0.012 5 g时,氧化峰电流绝对值明显下降,这是由于随着体系中Fe3O4@Au/MOF添加量不断地增加,纳米粒子发生团聚现象,导致复合纳米模拟酶催化活性逐渐降低。综上所述,Fe3O4@Au/MOF添加量在0.010 0 g时电化学检测效果最优。因此,Fe3O4@Au/MOF添加量选取0.007 5、0.010 0、0.012 5 g参与正交设计优化实验最为适合。
2.2.2.4 温度的影响
为考察温度对体系检测胆固醇的影响,设计了5种温度进行实验,见图4(d)。通过图4(d)可以看出,当温度处于20~30 ℃时,随着温度的增加,反应速率增大,电极表面的电子转移数目增多,电化学信号增强,氧化峰电流绝对值不断地增大。当温度处于40~60 ℃时,随着温度的增加,溶液中的胆固醇溶解度不断增加,同时模拟酶的催化活性也不断增强,导致体系的反应速率增大,产生大量氧化活性自由基,并与TMB发生氧化还原反应,增加了电极表面的电子转移速率和电化学响应,因此氧化峰电流绝对值显著升高。考虑其即时检测的实用性,温度选取40、50、60 ℃参与正交设计优化实验最为适合。
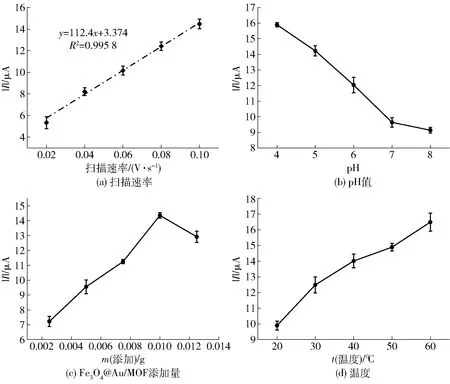
图4 金属有机框架模拟酶电化学增强检测体系的单因素优化结果
2.2.2正交试验的优化结果
通过正交试验设计优化金属有机框架模拟酶电化学增强检测体系结果分析见表1。由表1可知,实验各因素对氧化峰电流绝对值的影响主次顺序由高到低依次为:B(温度)、A(添加量)、C(扫描速率)、D(pH值)。通过极差分析确定的最优实验方案组合为:A3B2C3D1,即在检测体系体积为10.60 mL时,Fe3O4@Au/MOF添加量0.012 5 g,反应温度50 ℃,扫描速率0.1 V/s和缓冲液pH=4。虽正交优化的结果与单因素优化结果有些不同,这是由于原则上Fe3O4@Au/MOF添加量越大,催化效率越高,可显著提高催化胆固醇产生H2O2以及促进H2O2产生大量氧化活性自由基的速率,因此Fe3O4@Au/MOF的添加量可为0.012 5 g;对于体系的酸碱度,胆固醇在较酸的条件下易发生氧化还原反应,但由于质子参与体系反应,当溶液体系pH值过低存在大量的质子时,则会影响溶液的体系不利于进行检测,根据实验pH值可选为4;对于电化学工作站的扫描速率,本研究团队之前的实验研究表明,当扫描速率超过0.1 V/s时,检测体系的稳定性会受到影响,因此扫描速率可选择0.1 V/s。以最优条件进行3次平行实验,氧化峰电流绝对值平均值约为21.40 μA。
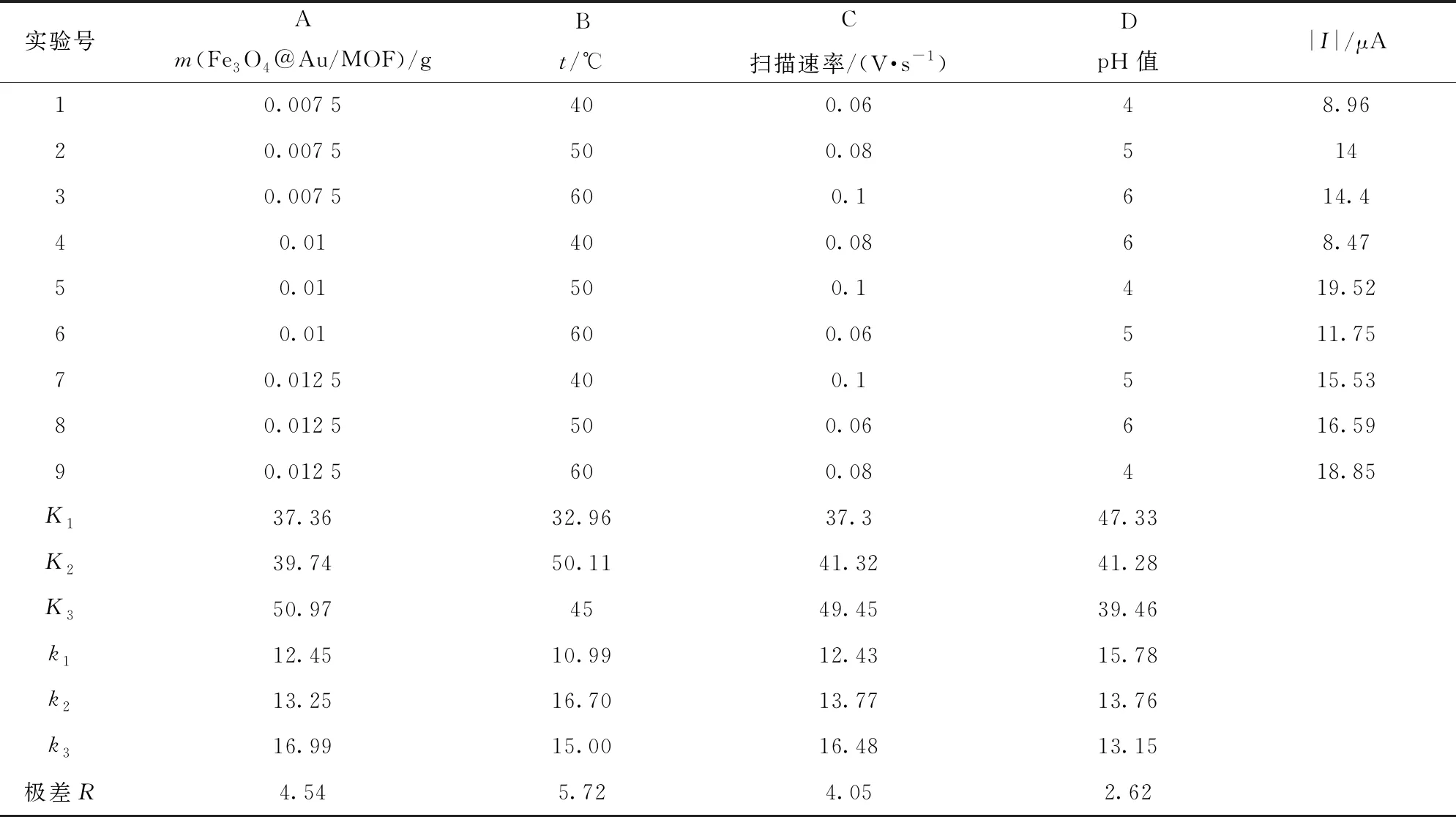
表1 金属有机框架模拟酶电化学增强检测体系的正交试验结果分析
2.3 金属有机框架模拟酶电化学检测胆固醇的工作曲线、检测限和回收率
选择一定范围的已知的胆固醇浓度构建其工作曲线,见图5。由图5可知,胆固醇浓度在0.001~1.500 mmol/L,与氧化峰电流绝对值具有良好的线性关系,工作曲线回归方程为y=20.640 1x+4.772 2,相关系数R2=0.995 6,计算检测限为2.7 μmol/L。为评估该体系的检测实用性,在较优的检测体系下,根据所得的工作曲线回归方程,对胆固醇进行回收率的评价,计算其回收率范围为98.40%~103.25%。结果表明,在Fe3O4@Au/MOF模拟酶催化的电信号增强效应下,所建立的检测方法对胆固醇具有较高的灵敏度和精密度。
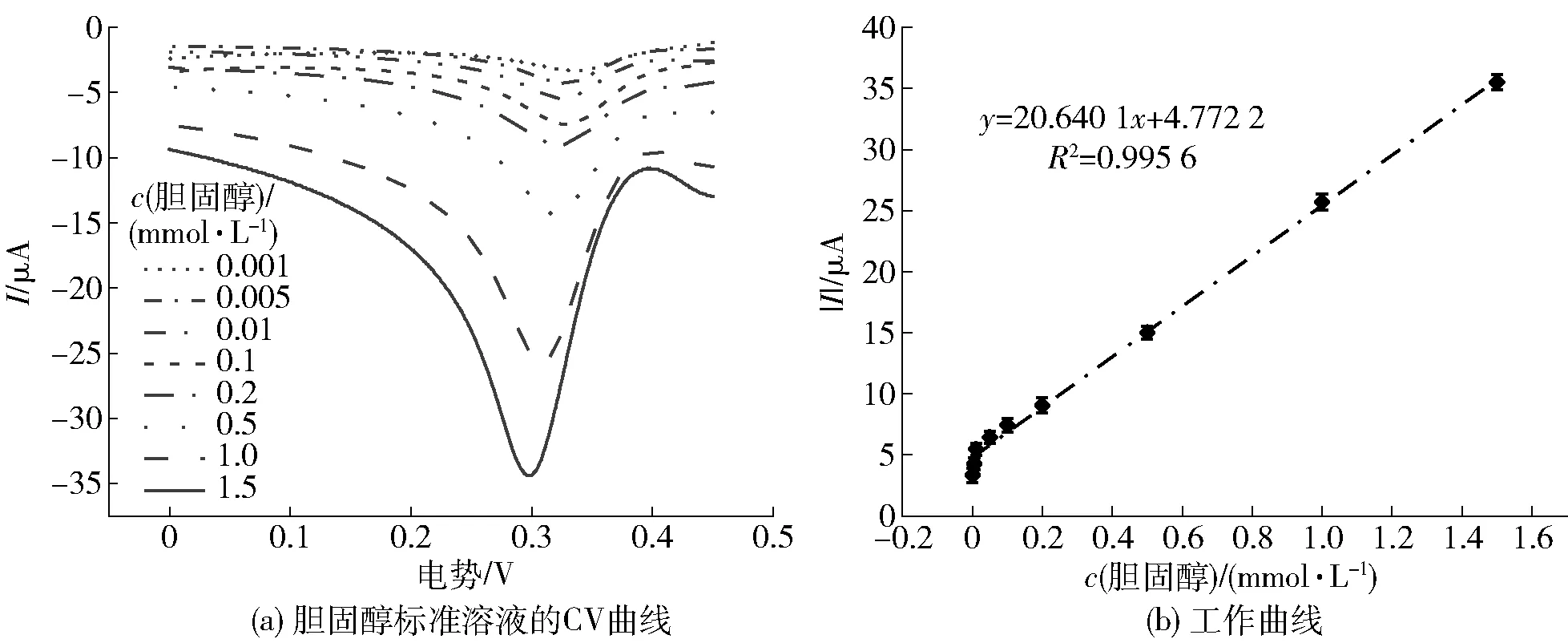
图5 Fe3O4@Au/MOF电化学增强体系检测胆固醇的工作曲线
2.4 金属有机框架模拟酶电化学检测胆固醇的抗干扰性
本研究选取食品中6种常见物质作为干扰物质,对体系的抗干扰性能进行评估,见图6。以浓度为0.5 mmol/L的胆固醇作为参照标准,选取浓度为50 mmol/L的乳糖、甘氨酸、半胱甘酸、葡萄糖、Cu2+、Na+和K+作为干扰物质,干扰物质的浓度均为胆固醇浓度的100倍。由图6可知,相较于50 mmol/L的乳糖、甘氨酸、半胱甘酸、葡萄糖、Cu2+、Na+和K+等干扰物质,该电化学增强体系对0.5 mmol/L的胆固醇表现出显著的电流响应,具有较高的氧化峰电流绝对值。表明了该电化学增强体系对胆固醇的检测具有良好的选择性和抗干扰性能。
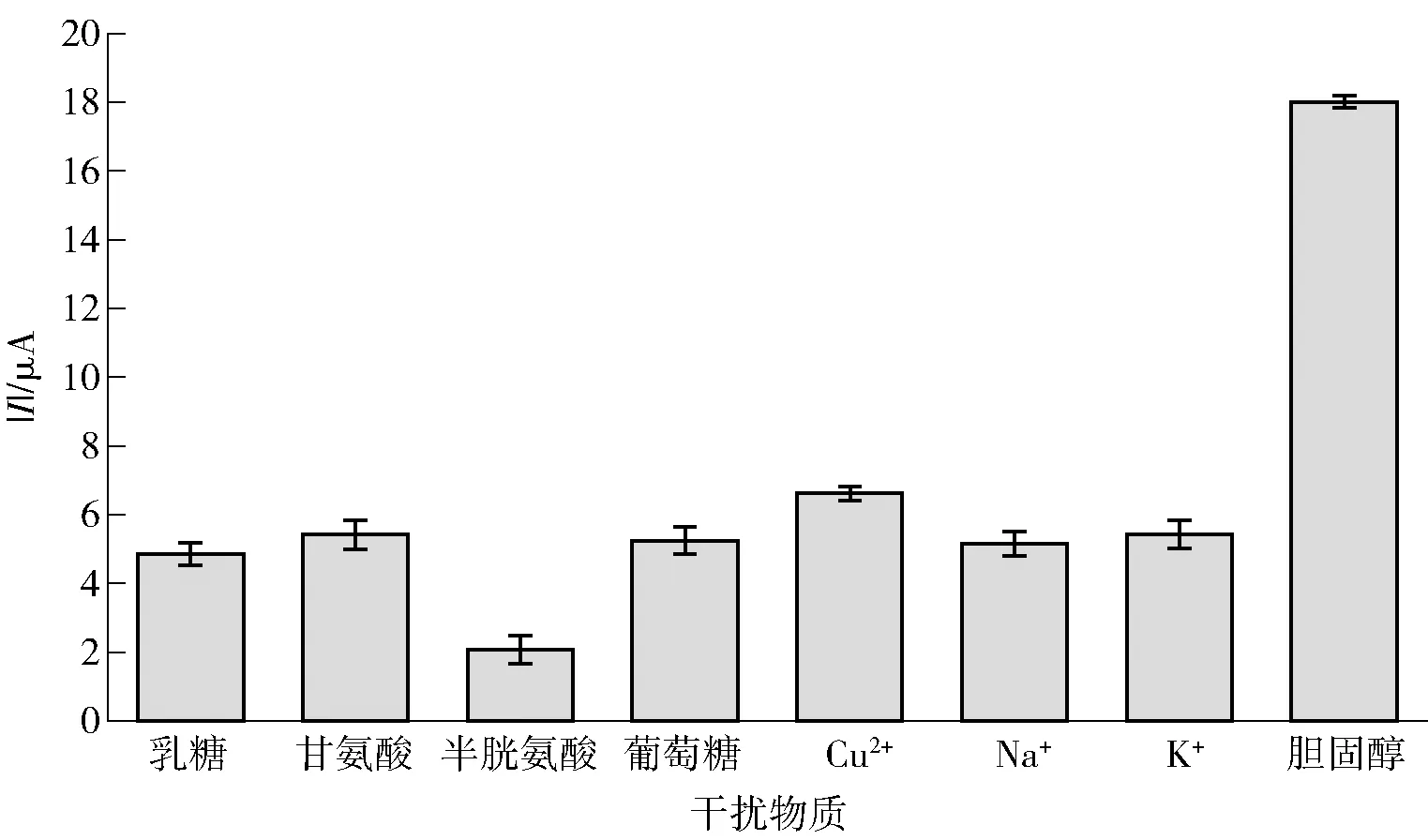
图6 Fe3O4@Au/MOF电化学增强体系检测胆固醇的抗干扰性
2.5 实际样品的检测结果
3种不同胆固醇加标浓度的黄油样品的检测结果见表2。由表2可知,该增强检测体系加标回收率分别为93.38%、110.36%和106.46%,相对标准偏差(RSD)分别为1.25%、2.52%和1.84%,均小于3%,说明该电化学增强检测体系对黄油样品具有良好的加标回收率和精密度,可实现对实际样品中胆固醇的检测。
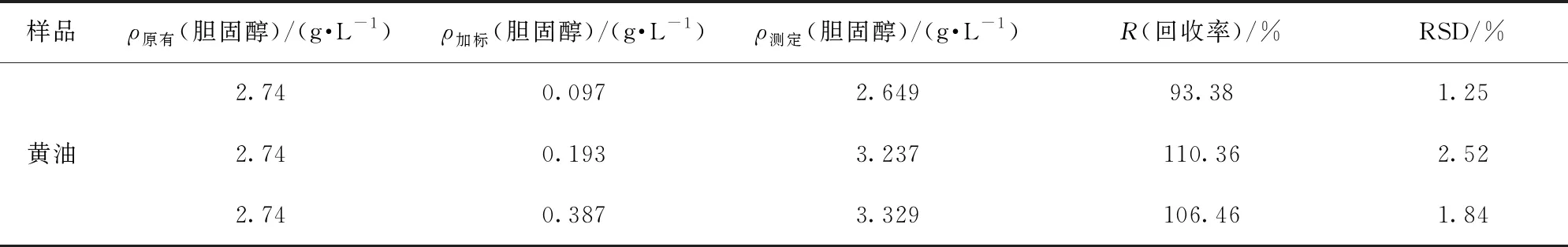
表2 金属有机框架模拟酶电化学增强检测体系对实际样品的加标回收率和精密度的检测结果
3 结 论
纳米粒子独特的酶活性对于提高电化学传感器的检测性能至关重要,因此本研究制备了一种新型的具有良好的增强型类过氧化物酶活性的Fe3O4@Au/MOF纳米复合材料。在H2O2的存在下,Fe3O4@Au/MOF可催化H2O2产生·OH,并进一步促进TMB被氧化,使得玻碳电极表面的电子发生转移,进而体系的电信号产生响应,基于此原理可对胆固醇进行电化学检测。此外,基于Fe3O4@Au/MOF纳米粒子的电化学传感器无需对电极进行修饰,提高了检测时间以及降低了检测的难度,从而获得良好的检测稳定性和方便性。且该检测体系对共存分子具有较强的抗干扰能力,并成功地应用于黄油样品中胆固醇的测定,解决了可以实时实地快速检测食品中胆固醇含量的实际问题。希望该检测方法为电化学传感器的构建开辟一条新的途径,为食品质量安全检测工作提供一种高效便捷的选择。
