酸菜中具有抑菌活性乳酸菌的分离鉴定及其产细菌素特性
2022-08-01孙庆申王钰涵韩德权韩晓云
孙庆申, 王钰涵, 韩德权, 张 炎, 韩晓云
(1.黑龙江大学 农业微生物技术教育部工程研究中心, 黑龙江 哈尔滨 150500;2.黑龙江大学 生命科学学院 黑龙江省普通高等学校微生物重点实验室, 黑龙江 哈尔滨 150080;3.黑龙江大学 生命科学学院 黑龙江省普通高等学校分子生物学重点实验室, 黑龙江 哈尔滨 150080)
东北酸菜是白菜经腌制而成的传统食品。酸菜腌制过程中的微生物发酵不仅赋予酸菜独特的色、香、味,而且低pH值在一定程度上抑制了有害菌的生长[1]。但是随着贮藏期的延长,由于杂菌大量繁殖引起的酸菜腐败现象时有发生。不同的酸菜贮藏性能不同,可能与酸菜中特有微生物及其抑制腐败菌作用有关。因此,从酸菜中分离具有防腐作用的微生物,并明确其发挥抗菌作用的成分具有重要的意义。
植物乳杆菌作为发酵蔬菜中的主要种属,在发酵过程中会产生不同的抗菌物质,如有机酸、抗菌肽(包括细菌素)等[2]。细菌素是一类由核糖体合成的低分子量抗菌肽,具有一定的抑菌作用[3-4]。这一特性使它们成为发酵食品的有效防腐剂。乳酸菌作为一类革兰氏阳性菌,常被用作食品发酵剂和益生菌制剂[5-6]。Islam 等[7]分离得到乳酸菌具有广谱抑菌性,对食源性腐败菌、致病菌具有较好抑菌能力。高兆建等[8]从泡菜中分离到的发酵乳杆菌具有良好的耐酸碱性,作为酸性食物防腐剂具有良好的发展前景。齐世华等[9]通过筛选高产苯乳酸的菌株得到植物乳杆菌Lp45,其抑制霉菌生长的能力较强,作为生物保鲜剂具有良好的应用前景。
随着人们食品安全意识的提高,挖掘具有广谱抑菌性能的细菌素受到了越来越多的关注[10]。尽管针对植物乳杆菌细菌素分泌的研究已有很多报道,这些菌株的来源不同,同时大多数细菌素的抑菌谱较窄。本研究从市售的保藏期较长的腌菜中筛选出了一株具有高效抗菌活性的菌株,经生理生化及分子生物学鉴定该菌株为植物乳杆菌,并对其所产的细菌素的性质进行了研究。本实验所筛选出的植物乳杆菌L3产细菌素L3除了具备目前研究的细菌素的特性以外,对革兰氏阴性菌如大肠杆菌,以及真菌等都具有较好的抑菌活性,这些特性对于防止食品的微生物败坏具有重要的意义。
1 材料与方法
1.1 指示菌与试剂
指示菌:凝结芽孢杆菌、蜡样芽孢杆菌、枯草芽孢杆菌、金黄色葡萄球菌、单核增生李斯特菌、铜绿假单胞菌、大肠杆菌、白色念珠菌、毕赤酵母、青霉菌均来自黑龙江大学微生物重点实验室保存菌种。
蛋白胨、酵母浸粉、牛肉膏,北京奥博星生物技术有限责任公司;胃蛋白酶、胰蛋白酶、蛋白酶K、过氧化氢酶、琼脂粉、葡萄糖、硫酸锰、吐温8 0、硫酸镁、磷酸钠、氯化钠,天津市科密欧化学试剂有限公司;Sephadex G- 50,北京博奥拓达科技有限公司。MRS肉汤培养基,Solarbio试剂公司。
PDA固体培养基:马铃薯200 g,葡萄糖20 g,琼脂20 g,加蒸馏水至1 000 mL,121 ℃高压蒸汽灭菌20 min,用于真菌指示菌的培养(不加琼脂的为PDA液体培养基)。
LB固体培养基:酵母浸粉 5 g,蛋白胨10 g,氯化钠 10 g,琼脂20 g,加蒸馏水至1 000 mL,121 ℃高压蒸汽灭菌20 min,用于细菌指示菌的培养(不加琼脂的为LB液体培养基)。
1.2 仪器与设备
YPD固体培养基:葡萄糖20 g,酵母粉10 g,蛋白胨20 g,琼脂20 g,加蒸馏水至1 000 mL,121 ℃高压蒸汽灭菌20 min,用于酵母菌和霉菌的分离与培养(不加琼脂的为YPD液体培养基)。
LRH- 250型生化培养箱,上海一恒科技有限公司;LDZM- 75型立式压力蒸汽灭菌器,上海申安医疗器械厂;752型紫外可见分光光度计,上海光谱仪器有限公司;SW- CJ- 2FD型双人单面净化工作台,苏州净化设备有限公司;XS- 212型生物显微镜,南京江南光电股份有限公司;H1650型高速离心机,长沙湘仪仪器制造公司;HZQ- C型空气浴振荡器,哈尔滨东联电子技术开发有限公司;DKS- 24型水浴锅,上海经济区沈荡中新电器厂。
1.3 实验方法
1.3.1乳酸菌的分离及拮抗菌初筛
购买市售保质期为9个月的各品牌腌制蔬菜,包括亲民北大荒有机酸菜、翠花酸菜、朱老六东北酸菜、迟红棵酸菜、秒厨酸菜丝、农夫大田酸菜、农夫酸菜和正宗大田酸菜产品,在过保质期1个月时将每个品牌包装袋内的蔬菜和汁液分别取出,经组织捣碎机捣碎后取1 mL样品加到9 mL的无菌生理盐水中,充分振荡后进行稀释,取稀释度为1×10-7和1×10-8倍的样品200 μL,在含有CaCO3的MRS培养基上进行涂布,37 ℃培养24~48 h;选择有溶钙圈的白色单菌落通过三区划线进行分离纯化,再挑取单一菌落接种至MRS斜面,4 ℃保存备用。将挑选出来的19个菌株在37 ℃兼性厌氧环境下进行培养,观察乳酸菌生长情况。
再利用从酸菜汁中分离出的青霉菌,采用菌饼法进行拮抗实验,对19个菌株的抑菌活性进行初筛[11]。将对数生长期的乳酸菌菌悬液以7 140g离心15 min,取上清液加入至PDA培养基,在PDA培养基未凝固时,接入分离出的青霉菌,将此含有青霉菌和乳酸菌上清液的PDA培养基倒入平板内,28 ℃培养24~48 h,观察乳酸菌上清液对青霉菌抑菌圈直径的大小。以无菌生理盐水制成的未加入乳酸菌上清液、仅接种青霉菌的PDA培养基为对照。实验重复三次。
1.3.2一株优势乳酸菌的筛选及菌种鉴定
将1.3.1节中筛选出的一株抑菌效果最好的乳酸菌命名为L3。
1.3.2.1乳酸菌L3生长及抑菌动力学曲线
将乳酸菌L3以体积分数为2%的接种量接入MRS液体培养基中,37 ℃静置培养24 h。每隔2 h测定发酵液的pH值以及OD600值,以未接菌的MRS液体培养基做对照。通过培养时间(t)与培养液OD值绘制乳酸菌L3的生长曲线。
在乳酸菌L3培养24 h过程中,每隔2 h取培养液5 mL,经7 140g离心15 min后,取上清液。以枯草芽孢杆菌为指示菌,采用牛津杯法测定上清液对指示菌的抑菌效果,以培养时间(t)为横坐标,抑菌圈直径(mm)为纵坐标,绘制抑菌动力学曲线。
1.3.2.2乳酸菌L3的菌种鉴定
1)菌体的生理生化特征。根据《伯杰细菌鉴定手册》和《常见细菌系统鉴定手册》方法,采用革兰氏染色,吲哚实验,过氧化氢实验以及碳水化合物利用实验等对乳酸菌L3进行菌株鉴定[12]。
2)16S rDNA分子生物学鉴定。采用Ezup柱式细菌基因组提取试剂盒对所分离的乳酸菌L3进行DNA提取,利用细菌通用引物(F:AGTTTGATCMTGGCTCAG;R:GGTTACCTTGTTACGACTT)进行PCR扩增,并将扩增产物委托生工生物工程(上海)股份有限公司进行测序。利用blast软件将所得菌株L3的16S rDNA基因序列与NCBI数据库中已知序列进行比对,进行同源性分析,然后提交到NCBI Genebank数据库进行登记。
1.3.3细菌素L3的抗菌活性测定
1.3.3.1细菌素L3的抑菌性能干扰因素排除实验
根据文献[13]报道的方法对抑菌物质的抑菌性能干扰因素,如酸、蛋白酶等,进行排除分析。
无细胞上清液(cell-free supernatant,CFS)的制备。将分离出的乳酸菌L3以体积分数2%的接种量接种于100 mL的MRS液体培养基中,37 ℃ 120 r/min摇床培养18 h,7 140g离心10 min取上清液,用0.22 μm微孔滤膜过滤得到CFS,4 ℃保存备用。
指示菌的制备:将金黄色葡萄球菌和酵母菌按体积分数2%的接种量分别接种于LB和YPD液体培养基中,37 ℃ 150 r/min摇床培养过夜,1 776g离心10 min后收集菌体,稀释至1×10-7倍,分别涂布于LB和YPD固体培养基,再用牛津杯打孔,备用。
1)排除酸实验。将CFS冷冻干燥,用1 mL无菌蒸馏水复溶,再用5 mol/L NaOH溶液调节pH值6.5~7.0[14]。采用琼脂扩散法,向含有指示菌的YPD和LB固体培养基牛津杯孔内加入调节pH前后的CFS 100 μL,4 ℃静置1 h,于37 ℃培养24 h比较两者的抑菌圈大小。
2)蛋白酶敏感实验。用50 mmol/L(pH=7.0)的PBS缓冲液把适量的蛋白酶K、胰蛋白酶以及胃蛋白酶溶解,分别加入经处理的CFS,各蛋白酶终质量浓度均为1 mg/mL[15],分别调整为各酶的最适pH值(蛋白酶K pH值8.0、胰蛋白酶pH值7.8~8.5、胃蛋白酶pH值1.5~2.0,37 ℃水浴2 h后调回pH值6.5~7.0。对照组为未经各种酶处理的CFS。采用琼脂扩散法,37 ℃培养24 h测量抑菌圈直径。
3)排除过氧化氢实验。根据文献[16]的方法进行调整后,用50 mmol/L(pH=7.0)的PBS缓冲液把H2O2酶溶解,加入CFS中,使H2O2酶终质量浓度均为10 mg/mL,以未加H2O2的CFS作为对照组,37 ℃水浴2 h后,取100 μL处理后的CFS加入牛津杯孔中,4 ℃静置1 h,于37 ℃培养24 h测量抑菌圈直径。
1.3.3.2细菌素L3的提取及纯化
参考文献[16]的方法提取CFS中的细菌素,取100 mL的CFS于烧杯中,加入1.5倍体积的乙酸乙酯进行萃取,4 ℃静置过夜,收集有机相,45 ℃旋转蒸发,得到CFS中的细菌素。对乳酸菌L3胞内的细菌素,采取细胞破碎的方法提取,具体过程如下:采用细胞破碎仪将培养至对数生长期的乳酸菌L3进行超声破碎5 min,于75 ℃水浴中加热15 min,灭活蛋白水解酶,7 140g离心10 min,用5 mmol/L PBS缓冲液 (pH值7.1~7.4)洗细胞沉淀物,重悬于灭菌蒸馏水;再次离心后重悬于100 mmol/L NaCl 至pH=2.0,4 ℃放置2 h,不断搅拌,使细菌素从破碎的细胞最大限度地释放出来,悬浮液再次离心,取上清液,在上清液中加入1.5倍体积的乙酸乙酯进行萃取,4 ℃静止过夜,倒出有机相,45 ℃旋转蒸发,得到乳酸菌胞内细菌素粗提物,将其与发酵上清液中提取的细菌素分别用甲醇复溶,混合后备用。
采用Sephadex G- 50层析柱将提取的细菌素L3进行过滤层析,流动相使用100%纯水,每6 mL馏分收集1管,流速为0.2 mL/min,然后再利用自动分步收集器收集样品。收集各洗脱峰进行抑菌活性检测,将有抑菌活性的收集液合并,冻干并进一步分析。
1.3.3.3细菌素L3的抑菌谱检测
采用琼脂扩散法测定细菌素L3的抑菌活性。无菌条件下将LB、PDA和YPD固体培养基倒入灭菌后的平皿中,待冷却至适当温度,加入各指示菌(凝结芽孢杆菌、蜡样芽孢杆菌、枯草芽孢杆菌、金黄色葡萄球菌、单核增生李斯特菌、铜绿假单胞菌、大肠杆菌、白色念珠菌、毕赤酵母、青霉菌)混匀后(指示菌稀释度为1×10-7倍),插入牛津杯,待冷却后取出。在孔中加入100 μL的细菌素L3水溶液,置于37 ℃培养24 h,测量抑菌圈直径d。以空白培养基为对照组,每组3个平行。
1.3.3.4细菌素L3分子量的测定
经系列纯化后的活性组分通过 Tricine-SDS- PAGE 电泳测定细菌素L3分子量。采用相同条件进行两次电泳,电泳结束后,一份用于染色,另一份经充分洗涤脱去十二烷基硫酸钠(sodium dodecyl sulfate,SDS)后,覆盖LB培养基做抑菌活性验证实验。根据抑菌条带位置判断细菌素L3的分子量大小。
1.3.3.5细菌素L3的稳定性测定
本部分实验以枯草芽孢杆菌作为指示菌,经LB液体培养基培养24 h后,1 776g离心10 min后收集菌体,涂布于LB固体培养基平皿中,再通过琼脂扩散法分别测定经过下述处理的细菌素L3的抑菌活性,以未处理的细菌素L3作为对照。
1)热稳定性。将细菌素L3加热至60、80、100 ℃处理20 min或121 ℃处理15 min,测定其对枯草芽孢杆菌的抑菌圈直径。
2)酸碱稳定性。根据参考文献[17]方法略做修改,配置pH=1.5、2.5、3.5、4.5的人工模拟胃液、pH=7的人工模拟肠液以及pH>7的碱性溶液处理细菌素L3,测定细菌素L3的酸碱稳定性。
3)蛋白酶的敏感性。根据参考文献[18]的方法略做修改,用胃蛋白酶、胰蛋白酶和蛋白酶K分别处理细菌素L3,将各酶(终浓度为1 mg/mL)加入细菌素L3中,37 ℃水浴2 h,测定细菌素L3对不同的蛋白酶的敏感性。
4)对其他物质的敏感性。参考文献[19-20]的方法,向细菌素L3样品中加入质量分数为1%吐温- 80、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA),30 ℃处理4 h,通过牛津杯法测定细菌素L3对上述物质的敏感性。
1.3.3.6细菌素L3对金黄色葡萄球菌的生长抑制作用
将初步提纯的细菌素L3与金黄色葡萄球菌以1∶1(体积比)的接种量进行接种,观察未接种的金黄色葡萄球菌和接入细菌素L3的金黄色葡萄球菌在600 nm下的OD值变化。
1.4 数据分析
使用Excel软件计算平均值和标准误差值。利用Origin软件对实验结果进行统计分析,显著性水平为P<0.05。
2 结果与讨论
2.1 乳酸菌的分离及拮抗菌初筛结果
本研究采用溶钙圈法从不同品牌的酸菜中,挑选出呈白色或者微黄色、不透明或半透明、圆润光滑、边沿整齐的19个杆状或短杆状乳酸菌菌落(见表1)。

表1 19株乳酸菌菌落形态
因为在果蔬贮藏和保鲜过程中,霉菌污染是导致果蔬品质变坏甚至腐败的最主要的有害菌,且霉菌具有传播速度快等特点,所以,本实验以酸菜中分离出的青霉菌作为指示菌,以所得到的19株乳酸菌的抑菌活性强弱作为筛选条件,获得5株对青霉菌有拮抗作用的乳酸菌,通过菌饼直径比较发现编号为L3的菌株抑菌能力最强(见表2),因此选择乳酸菌L3进行后续实验。
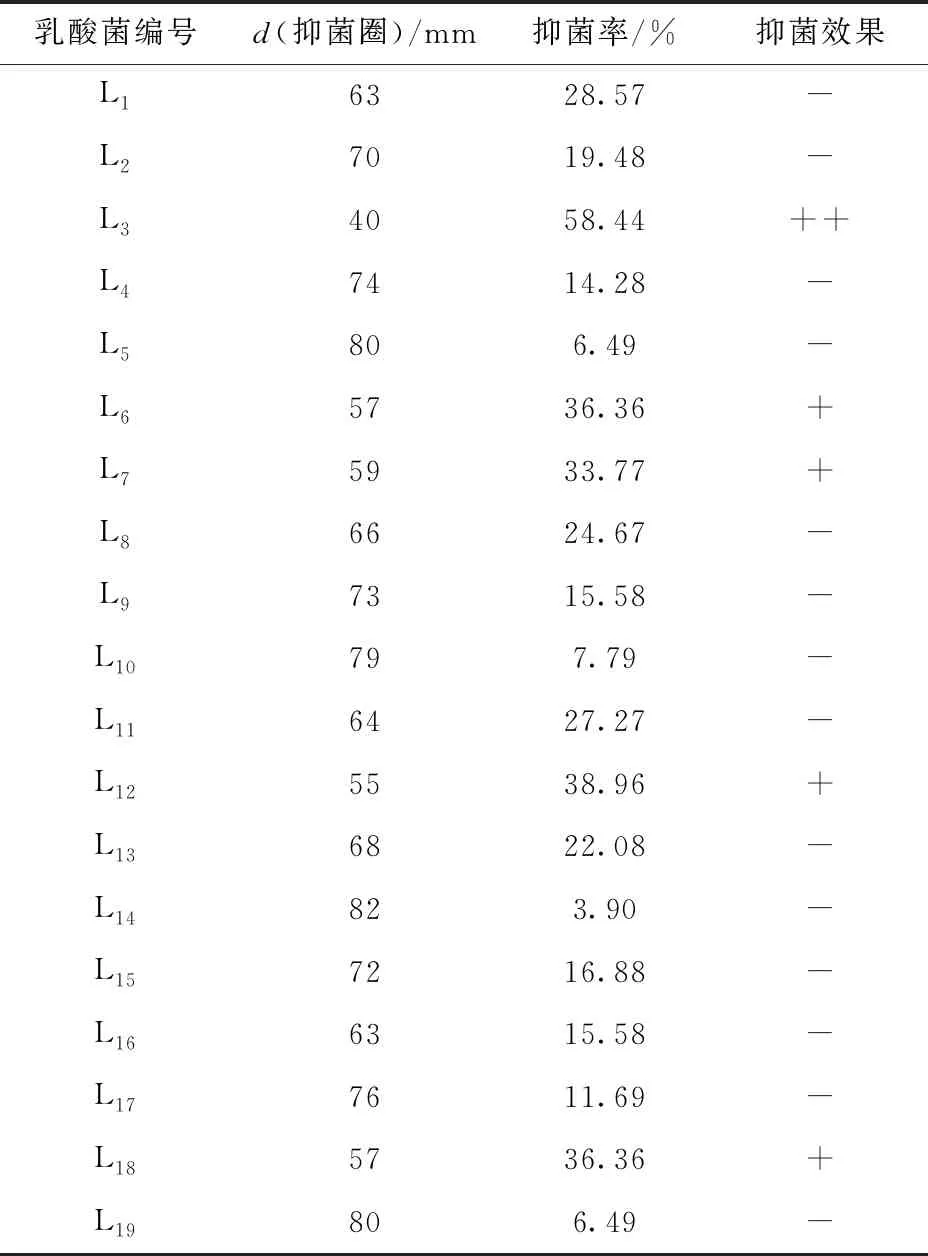
表2 19株乳酸菌对青霉菌的抑菌性能
2.2 乳酸菌L3的生理生化特性及菌种鉴定结果
2.2.1乳酸菌L3的生长动力学、产酸特性及抑菌曲线
本实验测定了培养液的OD600值,以此判定乳酸菌L3的生长曲线,结果见图1,在MRS液体培养基中,乳酸菌L3培养约2 h开始进入对数生长期,并于18 h之后进入了稳定期。该菌株的产酸能力强,在培养2 h时pH值下降到5.5左右,到8 h时,pH下降到4.0以下。以枯草芽孢杆菌作为指示菌进行抑菌活性测定,从培养4 h开始,菌株L3的发酵液开始具有抑菌活性,在进入生长稳定期后抑菌活性基本稳定,在24 h达到最高水平,所以将24 h作为产细菌素L3的最佳发酵时间。
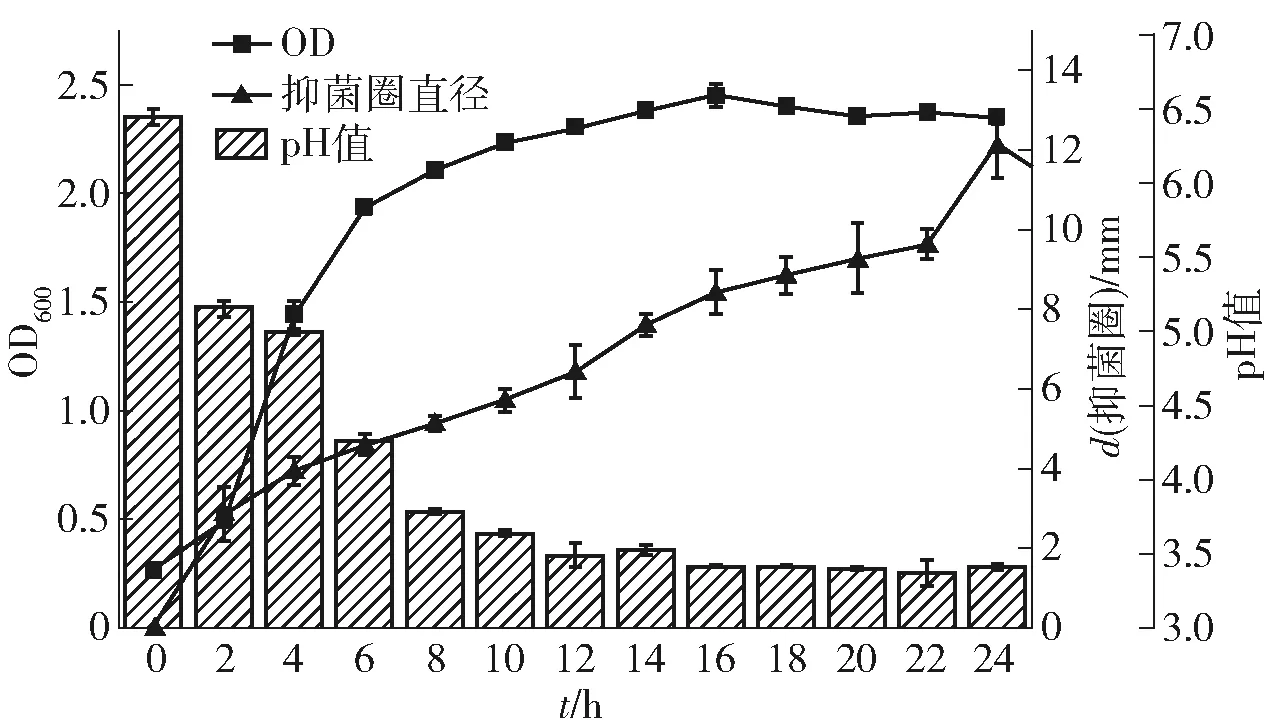
图1 优势乳酸菌L3生长曲线及抑菌动力学曲线
2.2.2乳酸菌L3的生理生化特征
利用溶钙圈实验证明了乳酸菌L3具有分解CaCO3的能力。经过革兰氏染色,吲哚试验,过氧化氢试验以及测试碳水化合物中经发酵后均呈阳性,初步判定菌株L3属于乳杆菌属(见表3)。

表3 乳酸菌L3生理生化鉴定结果
2.2.3乳酸菌L3的16S rDNA分子生物学鉴定结果
本实验按照细菌基因组提取试剂盒操作说明提取了菌株L3的总DNA,并进行葡聚糖凝胶电泳检测,然后将提取的基因组作为模板进行PCR扩增,获得的目的片段大小在1 500 bp左右(见图2)。对菌株L3的16S rDNA序列在NCBI数据库上进行Blast分析,结果显示,这株菌与植物乳杆菌同源性在99%以上,故将该菌株确定为植物乳杆菌(Lactobacillusplantarum),并命名为植物乳杆菌L3,将该序列提交NCBI Genebank数据库,获得菌株序列号为MT781360。
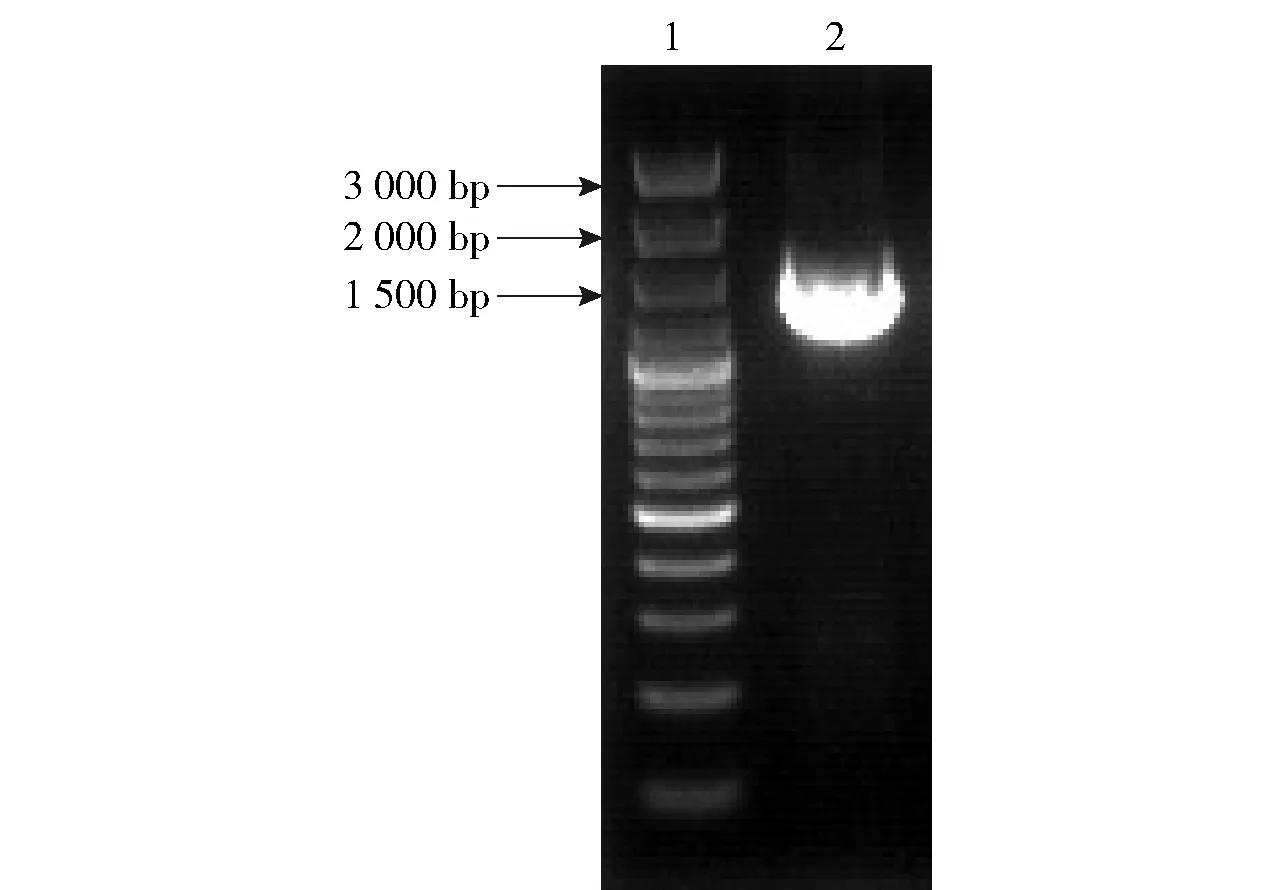
泳道1为Marker;泳道2为乳酸菌L3
2.3 细菌素L3的抗菌活性分析
2.3.1细菌素L3粗提物的抑菌性能干扰因素排除实验结果
有研究表明乳酸菌的代谢产物中具有多种抑菌物质,包括有机酸、过氧化氢等[21]。为了证明抑菌物质的蛋白质性质,对1.3.3.1节中的无菌上清液进行了蛋白水解酶处理、排酸和H2O2酶实验;然后以枯草芽孢杆菌为指示菌,发现加入了蛋白酶K和胰蛋白酶后抑菌活性明显降低,而加入了过氧化氢酶后抑菌活性没有明显变化,说明除了过氧化氢酶以外,该抑菌物质对其他酶都敏感,证明了抑菌物质是蛋白质类物质(见表4)。这一结果与Seval等[15]分离出的细菌素KT11,以及徐志娇等[22]从植物乳杆菌L10中发现的代谢物抑菌活性相似,所有这些细菌素对pH值有一定的依赖性,对温度和过氧化氢酶不敏感,经过蛋白酶处理后其抑菌活性降低,与本实验研究结果一致,进一步说明了其蛋白质性质。

表4 细菌素L3对酶的敏感性
2.3.2细菌素L3粗提物的初步纯化结果
初步纯化细菌素L3采用分子筛凝胶过滤层析,层析结果见图3,洗脱2 h 34 min左右出现第一个峰,全程仅有一个峰,将该峰进行收集后做抑菌实验,发现存在抑菌性。

A为目标峰。
2.3.3细菌素L3的抑菌谱
采用牛津杯法测定细菌素L3对不同的革兰氏阳性菌、革兰氏阴性菌和真菌等的抗菌活性,结果见表5,除凝结芽孢杆菌和乳酸杆菌外,细菌素L3对所有的指示菌都有抑菌活性,对革兰氏阳性菌的抑制活力显著高于革兰氏阴性菌。细菌素L3对革兰氏阳性菌中的蜡样芽孢杆菌、单核增生李斯特菌的抑菌活性高于对枯草芽孢杆菌、金黄色葡萄球菌的抑菌活性。对革兰氏阴性菌的抑制作用稍弱,对于铜绿假单胞菌和肺炎克雷伯氏菌的抑菌活性强于大肠杆菌的抑菌活性。除此之外,细菌素L3对于真菌中的白色念珠菌、毕氏酵母及青霉菌也显示了良好的抑制生长的能力。这些结果显示,细菌素L3具有广谱抑菌活性。
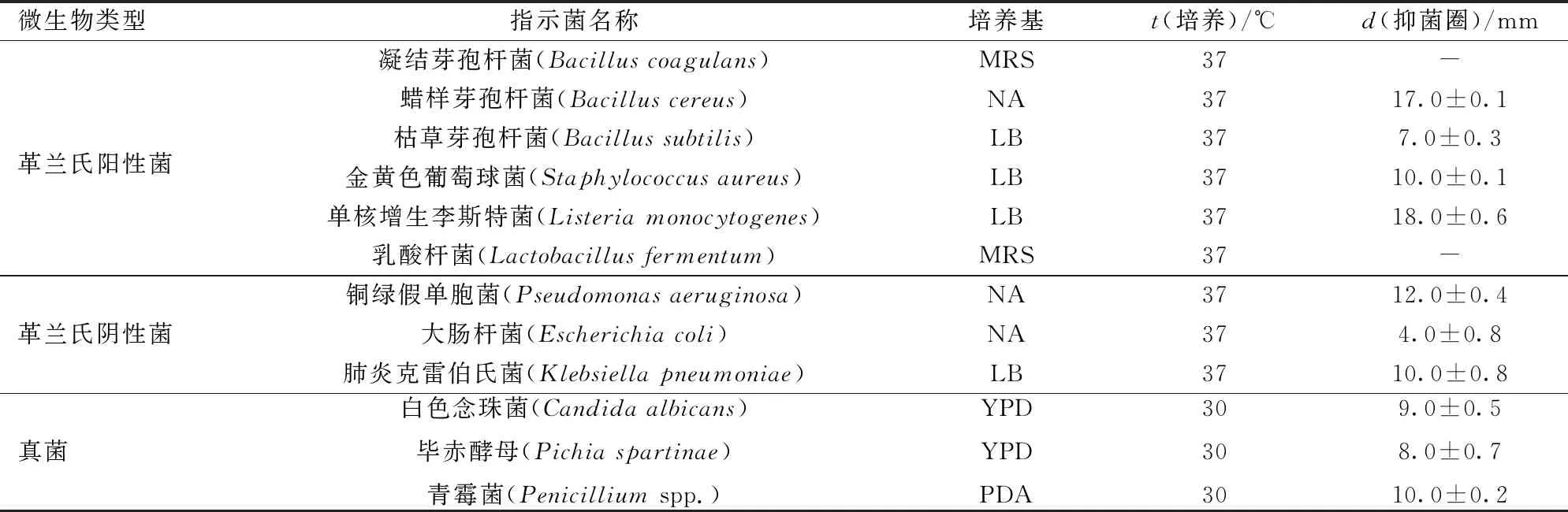
表5 细菌素L3的抑菌谱
2.3.4细菌素L3分子质量的大小
将细菌素L3经过乙酸乙酯萃取后旋转蒸发浓缩、Sephadex G- 50 凝胶分子筛层析及HPLC纯化处理后,对收集的抑菌活性组分进行Tricine-SDS- PAGE 检测(见图4),细菌素L3泳道显示清晰的非常靠近的两个条带,这两个条带均存在抑菌活性,该抑菌物质的分子质量大小介于4~5 kDa。研究显示,不同来源的细菌素分子质量范围变化较大,如Xin等[23]从芽孢杆菌中分离出得细菌素大小为5.8 kDa,Seval等[15]分离出的细菌素KT11分子质量大小在3.5 kDa;也有一些研究发现的细菌素分子质量较小,例如韩金志等[24]分离出的细菌素FZU122的分子质量大小为1.05 kDa,Wayah等[25]分离的细菌素SPW11为1.2 kDa。本研究通过抑菌实验显示,植物乳杆菌L3分泌的细菌素L3与已报道的细菌素不是同一种物质。

泳道1为细菌素L3浓缩液;泳道2为MRS培养基对照;泳道3为Marker。
2.3.5细菌素L3的稳定性结果
酸碱稳定性结果表明,纯化后得到的细菌素L3在pH值 2~10的范围内抑菌活性保持稳定,且在pH=3时抑菌活性最高(见图5),这与Seval等[15]分离出的细菌素KT11性质相似。将细菌素L3分别置于60、80、100 ℃水浴20 min,或120 ℃下处理15 min后,仍保持抑菌活性(表6)。

表6 温度对细菌素L3抑菌活性的影响

图5 pH值对细菌素L3抑菌效果的影响
季红等[26]从乳杆菌ST- III发酵上清液分离到细菌素类物质,但其在pH=7时几乎丧失活性。细菌素L3相比于此抑菌素的酸碱稳定性更好,这与Zhou[27],Messaoudi[28],Castro[29]等报道的细菌素性质相似。有些细菌在低温下是稳定的,但在100 ℃或121 ℃下失去了大部分抑菌活性,例如肠球菌素F4- 9[30]。因此基于细菌素的蛋白质性质和热稳定性,细菌素L3可以归类于热稳定细菌素,在食品工业中有潜在的应用价值。
2.3.6细菌素L3对金黄色葡萄球菌的抑制作用结果
金黄色葡萄球菌作为常见的食源性致病微生物,广泛存在于环境中。因此本文研究了细菌素L3对金黄色葡萄球菌生长的抑制作用(见图6),金黄色葡萄球菌在未添加细菌素L3的培养基上培养2 h时开始进入对数生长期,到10 h后开始缓慢增长,24 h吸光度值到达1.999。添加细菌素L3的金黄色葡萄球菌对数生长期明显延迟,表现出生长抑制,16 h后OD值约为0.868,进入稳定期不再增长。说明细菌素L3能很明显地抑制金黄色葡萄球菌生长。

图6 细菌素L3对金黄色葡萄球菌的抑菌作用
3 结 论
本研究在众多品牌腌制蔬菜中分离出19株乳酸菌,进行抗菌活性的研究,最终得到一株具有较好抑菌活性的乳酸菌。通过菌体形态、生理生化实验及16S rDNA基因序列比对分析,确定该菌株为植物乳杆菌,命名为植物乳杆菌L3。利用Sephadex G- 50柱层析从该菌株发酵上清液中分离得到抑菌物质,其分子量大小同文献报道的其他植物乳杆菌来源的细菌素不同,初步判定细菌素L3是一种新型的细菌素。抑菌实验显示细菌素L3对大肠杆菌、蜡样芽孢杆菌以及金黄色葡萄球菌等多种食源性腐败菌均具有抑菌活性。多种蛋白酶处理后发现细菌素L3活性完全消失,表明细菌素L3是蛋白类物质。稳定性研究表明细菌素L3在较高的温度、酸性、中性和偏碱性环境下依旧保持较高的活性,抗逆性强。细菌素L3特性与大多文献报道的细菌素存在一定差异。因此,本研究从酸菜中分离得到的植物乳杆菌L3所产的细菌素L3能为一种新型细菌素,在食品防腐方面具备明显的优势,有潜力进一步开发为天然食品防腐剂。但是该细菌素的产量还较低,下一步工作将通过优化发酵条件以及通过群体感应诱导等方法提高该细菌素的产量,并将进一步应用于发酵乳中。
