山茱萸抗过敏活性组分的筛选及其对RBL-2H3细胞脱颗粒的作用
2022-08-01张歌珂孙亚娟
张歌珂,刘 学,杨 成,孙亚娟
江南大学化学与材料工程学院 合成与生物胶体教育部重点实验室,无锡 214122
过敏疾病是世界卫生组织列入21世纪重点研究和防治的疾病之一,在世界范围内的发病率已达到20%~30%,故寻找有效抗过敏药物是目前的研究热点。目前抗过敏化学药物有很多,但大多具有作用环节单一,且副作用较大的特点[1],而植物提取物是具有不同结构和来源的天然化合物的复杂混合物[2],具有多靶点的抗过敏能力,对过敏反应的不同关键步骤均有影响,且作用缓和,副作用小[3]。我国中药资源丰富,为抗过敏天然物质的研究提供了较好的基础。
山茱萸(CornusofficinalisSieb.et Zucc.)是我国的一种药食同源植物,含有环烯醚萜及其苷、三萜类、黄酮类等物质,在中医理论中,具有良好的补益功效,常用于治疗虚症、肝肾疾病和生殖系统疾病[4]。山茱萸具有多种生物活性,如抗过敏、抗炎、抗氧化、抗糖尿病、抗骨质疏松、血管舒张等活性[5,6]。
Kim等[7]研究发现山茱萸水提物可抑制OVA诱导的哮喘模型中的肺过敏反应,具有一定的抗过敏功效。Kao等[8]发现含有山茱萸的中药组方可有效缓解过敏原Der-p诱导的过敏性哮喘症状,降低血清中IgE水平。Li等[9]究发现含有山茱萸的中药制剂(山茱萸占比11%)对皮肤瘙痒、PCA反应和皮肤功能障碍有明显的抑制作用。特应性皮炎是一种过敏性皮肤疾病,Mechesso等[10]报道了C2RPL提取物(山茱萸∶多花玫瑰∶胡枝子∶侧柏∶锥栗比例为4∶1∶1∶1的组方)可改善特应性皮炎症状,呈浓度依赖形式减少β-氨基己糖苷酶的释放,表明其具有抗过敏活性。Quah等[6]发现山茱萸70%乙醇提取物能减少抗DNP IgE诱导的β-氨基己糖苷酶的释放,表明具有抗过敏功效。
目前,对山茱萸提取物中起抗过敏作用的具体成分尚未见有报道。故本文在前期研究的基础上进一步对山茱萸中抗过敏活性成分进行探究,旨在发现山茱萸中具有抗过敏活性的确切成分。过敏反应根据其机理分为Ⅰ、Ⅱ、Ⅲ、Ⅳ型,由化学介质如组胺、前列腺素、白三烯、炎症因子等诱发[11],研究表明,绝大部分Ⅰ型过敏疾病与体内透明质酸酶(HAase)活性相关,且HAase是直接控制肥大细胞脱颗粒(与Ⅳ型过敏反应相关)的靶酶之一[12],因而透明质酸酶抑制实验和肥大细胞脱颗粒抑制实验常用于体外抗过敏研究。
本文以透明质酸酶抑制活性为指标筛选山茱萸中的抗过敏组分,通过MTT法和细胞脱颗粒抑制实验进一步考察其抗过敏活性,得到抗过敏活性最高的组分,最后采用气相色谱-质谱联用法(GC-MS)对其进行分析鉴定,以明确山茱萸中具有抗过敏活性的成分,为综合开发利用山茱萸中抗过敏活性成分提供科学依据。
1 材料与方法
1.1 材料与仪器
山茱萸(CornusofficinalisSieb.Et Zucc.)果实材料购于北京同仁堂,批号471201201;透明质酸(HA,分子量1 000 000,批号H0443562)购于天津希恩思生化科技有限公司;透明质酸酶来源于牛睾丸(50 KU,批号H128644)、牛血清白蛋白(纯度96%,批号A116563)、芹菜素(纯度≥98%,批号A106676)、钙离子载体A23187(纯度≥97%,批号C137844)、邻苯二甲醛(OPA,纯度98%,批号P108632)、4-硝基苯基-2-乙酰氨基-2-脱氧-β-D-吡喃葡萄糖苷(PNAG,纯度98%,批号N107918)和组胺(纯度96%,批号H111796)购于上海阿拉丁生化科技有限公司(中国);Dulbecco改良Eagle培养基(DMEM,批号SH30284.01)购于Hyclone公司;双抗(批号15140122)和胰蛋白酶(批号25200056)购于Gibco BRL(Grand Island,NY,USA);胎牛血清(批号FBS-PN500)购于Newzerum(Upper Riccarton,Christchurch,New Zealand);3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT,纯度99%,批号M2128)购于西格玛奥德里奇(上海)贸易有限公司;二甲基亚砜(DMSO,批号20210310)、磷酸氢二钠(批号20201012)、磷酸二氢钠(批号20201112)、氯化钠(批号20210310)、冰醋酸(批号20201127)、石油醚(60~90 ℃,批号20200412)、正丁醇(批号20200412)、乙酸乙酯(批号20200812)购于国药集团,试剂均为分析纯。
旋转蒸发器(德国IKA公司);CYTATION 5多功能微孔板酶标仪(美国Bio Tek公司);快速制备色谱仪(Isolera One瑞典Biotage公司);QP2010Ultra型气相色谱质谱联用仪(日本岛津公司)。
1.2 实验方法
1.2.1 山茱萸不同极性部位的制备
将山茱萸果实烘干,粉碎后准确称取山茱萸粉末100 g,按1∶15(g/mL)的比例加入75%乙醇溶液,40 ℃超声处理40 min,抽滤,滤渣继续重复提取3次,合并滤液,滤液用0.22 μm有机滤膜过滤后,旋蒸至无醇味,加入去离子水分散均匀,依次用石油醚(60~90 ℃)、乙酸乙酯、水饱和正丁醇萃取,静置过夜,萃取液分别减压旋蒸至干,得到石油醚提取物、乙酸乙酯提取物、正丁醇提取物和水提取物,分别命名为COPE、COEE、CONE和COWE,4 ℃储存备用。
1.2.2 COPE分离纯化
采用快速制备色谱对COPE进一步分离纯化,将COPE以干法上样于硅胶柱顶端,首先用石油醚洗脱,再以石油醚和乙酸乙酯进行梯度洗脱(石油醚/乙酸乙酯100∶0→0∶100),最后用乙醇洗脱。对洗脱流分进行薄层色谱分析(TLC),根据TLC分析结果合并流分,得到18个组分,依次命名为COPE-1~COPE-18。将各组分在30 ℃下减压旋蒸至干,称重后用石油醚定容,-20 ℃储存备用。
1.2.3 透明质酸酶(HAase)抑制实验
参照文献[13]方法并适当改善,测定样品对HAase活性的抑制作用。简述如下:分别取100 μL HAase(20 mmol/L溶于磷酸缓冲液pH 7)与5 μL样品加入离心管中,混匀后37 ℃反应10 min;加入100 μL透明质酸溶液(0.05%,溶于300 mmol/L磷酸钠缓冲液pH 5.35),37 ℃反应45 min;加入1 mL酸性白蛋白溶液(0.1%牛血清白蛋白溶于醋酸缓冲液pH 3.75)使未分解的透明质酸沉淀,室温下反应10 min后立即用酶标仪在600 nm处测定吸光值。对照组将HAase替换为100 μL磷酸缓冲液。空白组将样品替换为5 μL水。阳性对照品为芹菜素,阴性对照为样品溶剂,每组样品重复3次。IC50值为抑制率为50%时的样品浓度。HAase抑制率计算公式如下:
透明质酸酶抑制率=
式中:As为不含HAase的样品的吸光值;Bs为含HAase的样品的吸光值;An为不含HAase的样品溶剂的吸光值;Bn为含HAase的样品溶剂的吸光值;Aw为不含HAase的空白组的吸光值;Bw为含HAase的空白组的吸光值。
1.2.4 MTT法测定活性组分的细胞毒性
RBL-2H3细胞在含5% CO2的37 ℃培养箱中培养,细胞培养液使用含有10%胎牛血清和1%双抗的DMEM。在细胞长至80%~90%时,在96孔板以1.5×105个/mL的密度接种细胞。细胞活力通过MTT实验进行,具体步骤如下所述[14],细胞在96孔板中孵育24 h后,加入样品100 μL再次孵育24 h,弃培养液加入100 μL 0.05% MTT溶液,避光培养4 h,小心吸去溶液,加入100 μL DMSO,酶标仪振荡后测定490 nm处的吸光值,按下述公式计算细胞存活率:
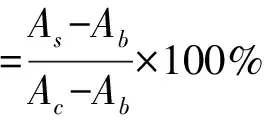
式中:As为样品组吸光值;Ac为对照组吸光值;Ab为空白组吸光值。
1.2.5 细胞脱颗粒抑制实验
采用钙离子载体A23187刺激细胞脱颗粒。RBL-2H3细胞与样品于37 ℃孵育30 min后,加入钙离子载体(400 ng/mL,溶于台式液)37 ℃孵育30 min。收集上清液,-20 ℃储存备用。
1.2.5.1β-氨基己糖苷酶释放检测
β-氨基己糖苷酶释放依据文献[3]方法测定。取30 μL上清液至96孔板中,加入50 μL PNAG(溶于0.1 mol/L柠檬酸缓冲液pH 4.5,1.3 mg/mL)混匀,37 ℃反应60 min。然后加入80 μL 0.5 mol/L NaOH。酶标仪测定反应液在405 nm处的吸光度。
1.2.5.2 组胺释放检测
组胺释放的测定参考文献[15]并适当改善。通过将组胺转化为荧光组胺-OPA-产物间接测定组胺含量。250 μL上清液中加入50 μL 1 mol/L NaOH和12.5 μL 1% OPA,将组胺转化为荧光组胺OPA产物。室温反应4 min后,加入25 μL 3 mol/L HCl终止反应。通过酶标仪测定荧光强度,激发波长为360 nm,发射波长为450 nm。组胺释放率以样品组吸光值与最大释放组吸光值的比值表示。
1.2.6 GC-MS分析
GC-MS分析条件参考文献[16,17],并适当调整。
气相色谱条件:色谱柱(RTX-5MS 30 m × 0.25 mm,0.25 μm);载气为氦气,进样量1 μL;流速为1.1 mL/min;分流比30∶1;柱箱温度设置为100 °C,保持1 min,然后升至220 °C,再以30 °C/min的速度升至300 °C,保持10 min。
质谱条件:离子源EI 200 °C;电子能量70 eV;倍增电压1 000 V;质量扫描范围:34~850 amu;采集方式:扫描。采用峰面积归一化法确定组分的相对含量;以标准谱库NIST11作为质谱数据库。
2 结果与分析
2.1 山茱萸不同极性部位的透明质酸酶抑制作用
透明质酸酶抑制实验结果显示COPE的透明质酸酶抑制活性最高(IC50值为3.11 mg/mL),其次是COWE(IC50值为13.31 mg/mL)和COEE(IC50值为18.16 mg/mL),CONE的抑制活性较低,IC50值为65.47 mg/mL。山茱萸中极性较小的物质的抗过敏活性更高。因此,对COPE进一步分离纯化。
2.2 COPE分离纯化及透明质酸酶抑制作用
经硅胶柱色谱分离纯化共获得55个流分,分别标记为石油醚洗脱流分、1~53和乙醇洗脱流分,1~53号流分的TLC分析结果如图1所示,综合紫外光灯(365 nm)下检识的结果和10%硫酸乙醇溶液显色检识的结果,将具有相同Rf值且颜色相同的点进行合并,分别将合并的流分进行减压浓缩,最终得到18个组分,依次命名为COPE-1~COPE-18。其中,COPE-1的产率最高,为21.2%,其次是COPE-18(19.2%)和COPE-4(13.8%)。

图1 COPE流分薄层色谱图Fig.1 TLC chromatogram of fractions of COPE注:A:紫外光灯显色(365 nm);B:10%硫酸乙醇溶液显色。Note:A:Coloration results under UV lamp (365 nm);B:Coloration results of 10% sulfuric acid ethanol solution.
本实验采用同为天然化合物的芹菜素作为阳性对照品,其是一种已知的透明质酸酶抑制剂[18,19]。COPE-1~COPE-18的透明质酸酶抑制活性如图2所示,其中有12个组分与溶剂对照存在显著差异,COPE-8、COPE-9、COPE-10在2.5 mg/mL的浓度下对透明质酸酶抑制作用相当,COPE-7抑制作用略低,但它们都优于同浓度的阳性对照品芹菜素。COPE-7、COPE-8、COPE-9、COPE-10对透明质酸酶的IC50值分别为1.12、1.07、0.87、1.04 mg/mL,均低于芹菜素的IC50值(2.02 mg/mL),表明它们均具有优异的透明质酸酶抑制活性,具有较好的抗过敏潜力。继续通过细胞脱颗粒抑制实验考察4个组分对RBL-2H3细胞脱颗粒释放组胺和β-氨基己糖苷酶的抑制作用作进一步筛选。

图2 石油醚部位组分的透明质酸酶抑制活性Fig.2 Anti-hyaluronidase activity of 18 fractions of COPE注:COPE-1~COPE-18浓度为2.5 mg/mL;Api为芹菜素,浓度为2.5 mg/mL;Solvent control为样品溶剂(20% DMSO)对照;与芹菜素相比,**P < 0.01。Note:The concentrations of COPE-1-COPE-18 are 2.5 mg/mL;Api is apigenin (2.5 mg/mL);Solvent control is the solvent of sample (20% DMSO);Compared with Api,**P < 0.01.
2.3 山茱萸抗过敏组分的脱颗粒抑制作用
2.3.1 山茱萸抗过敏组分的细胞毒性
采用MTT法检测不同组分对RBL-2H3细胞活力的影响,结果如图3~6所示,COPE-7在所有测试浓度下,对细胞均无毒性(细胞活力≥90%);COPE-8在不高于20 μg/mL的浓度下没有明显的细胞毒性;COPE-9和COPE-10在不高于1.25 μg/mL的浓度下,没有明显的细胞毒性。
2.3.2 山茱萸抗过敏组分对组胺和β-氨基己糖苷酶释放的抑制作用
RBL-2H3细胞脱颗粒已广泛应用于过敏和免疫学研究,特别是在筛选分离的化合物和天然提取物的抗过敏特性方面得到了广泛的应用[3]。刺激物钙离子载体A23187在不高于400 ng/mL的浓度时无细胞毒性,因此实验使用400 ng/mL的A23187对RBL-2H3细胞进行刺激。脱颗粒抑制实验结果如图7~10所示,4个组分均呈浓度依赖形式抑制A23187刺激的细胞脱颗粒水平。COPE-7、COPE-8、COPE-9、COPE-10在无细胞毒性的最高浓度下分别将组胺水平降至(47.6±1.9)%、(54.3±0.9)%、(67.0±2.3)%和(73.3±2.7)%;将β-氨基己糖苷酶水平降至(55.3%±1.2)%、(60.8%±3.3)%、(72.6%±3.4)%和(82.0±1.6)%。由结果看出,与COPE-7相比,同浓度条件下COPE-8的抑制作用最好,分别将组胺水平和β-氨基己糖苷酶水平降低了46%和39%。因此,推测COPE-8为山茱萸中最主要的抗过敏活性物质。

图3 COPE-7的细胞毒性Fig.3 Cytotoxicity of COPE-7

图4 COPE-8的细胞毒性Fig.4 Cytotoxicity of COPE-8注:与对照组(样品浓度为0 μg/mL)相比,**P < 0.01,下同。Note:Compared with control (the concentration of sample is 0 μg/mL),**P < 0.01,the same below.

图5 COPE-9的细胞毒性Fig.5 Cytotoxicity of COPE-9

图6 COPE-10的细胞毒性Fig.6 Cytotoxicity of COPE-10
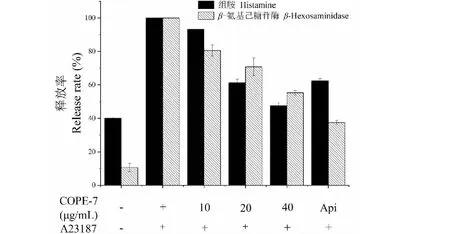
图7 COPE-7对组胺和β-氨基己糖苷酶释放的抑制作用Fig.7 The effect of COPE-7 on β-hexosaminidase and histamine release注:Api为芹菜素,浓度为20 μg/mL;A23187为刺激物钙离子载体A23187,浓度为400 ng/mL;“+”表示添加,“-”表示不添加;与“样品(-),A23187(+)”相比,**P < 0.01;*P < 0.05,下同。Note:Api is apigenin (20 μg/mL);A23187 is calcium ionophore A23187 (400 ng/mL);‘ + ’ means to add;‘ - ’ means not to add;Compared with ‘sample (-),A23187 (+)’,**P < 0.01;*P < 0.05. The same below.

图8 COPE-8对组胺和β-氨基己糖苷酶释放的抑制作用Fig.8 The effect of COPE-8 on β-hexosaminidase and histamine release

图9 COPE-9对组胺和β-氨基己糖苷酶释放的抑制作用Fig.9 The effect of COPE-9 on β-hexosaminidase and histamine release

图10 COPE-10对组胺和β-氨基己糖苷酶释放的抑制作用Fig.10 The effect of COPE-10 on β-hexosaminidase and histamine release
2.4 COPE-8的化学成分分析
4个活性组分中,COPE-9和COPE-10的细胞毒性较高,与COPE-7相比,COPE-8对RBL-2H3细胞脱颗粒抑制作用最好,且得率相对较高(6.5%),成分组成相对较少,故对COPE-8进行GC-MS分析,得到的COPE-8总离子流色谱图见图11,利用峰面积归一法对各成分的相对含量进行计算,与标准谱库NIST11的质谱峰进行比对共鉴定出12个化合物,由表1可见,已鉴定成分占总COPE-8的96.01%,其主要成分为α-香树脂醇(19.12%)、6a,14a-甲醇烯,全氢-1,2,4a,6b,9,9,12a-七甲基-10-羟基(16.71%)、n-棕榈酸(16.38%)、δ-14-千层塔烯(13.1%)和β-香树脂醇(11.94%)。α-香树脂醇和β-香树脂醇都是五环三萜类化合物,结构非常相似,已有研究表明两种三萜类化合物的混合物显示出免疫刺激、抗炎、抗焦虑和抗抑郁活性[20],其中β-香树脂醇具有较好的透明质酸酶抑制活性,其IC50值为33.98 μg/mL[21]。据Oliveira等报道,α-香树脂醇和β-香树脂醇可有效抑制小鼠的抓挠行为,且显著抑制化合物48/80诱导的肥大细胞脱颗粒,抑制率高达86%[22],表明α-香树脂醇和β-香树脂醇具有一定的抗过敏活性。香紫苏醇可显著减轻特应性皮炎症状,减少肥大细数量[23],且能通过减少炎症细胞因子的表达和提高抗氧化酶的活性表现出对LPS刺激的巨噬细胞的抗炎活性[24]。

图11 COPE-8的总离子流图Fig.11 Total ion chromatogram of the COPE-8
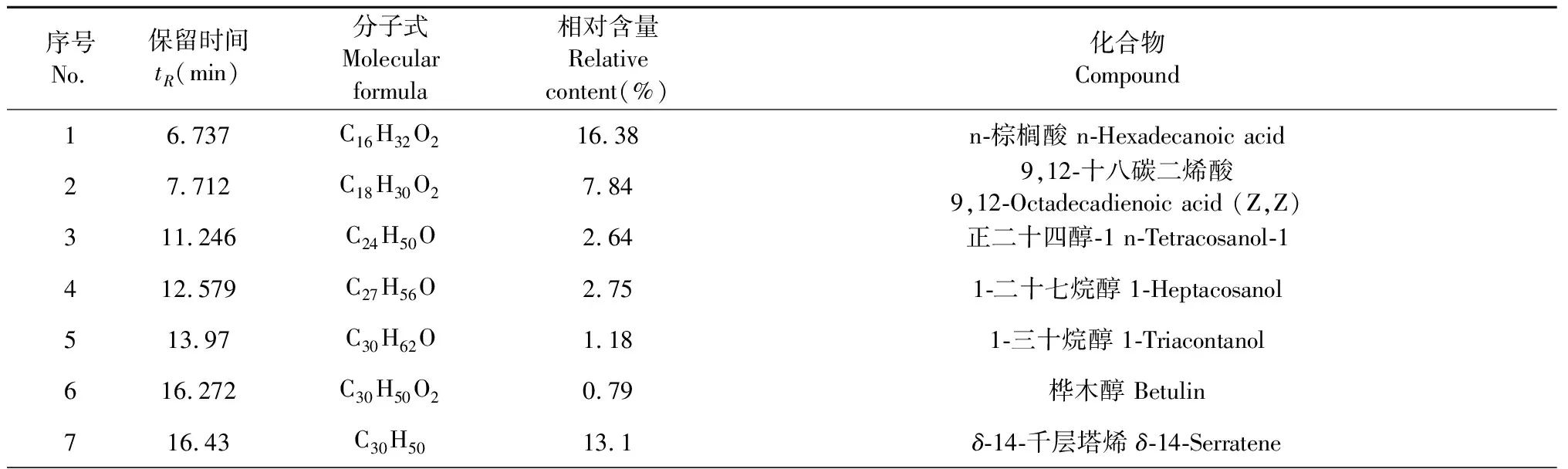
表1 COPE-8化学成分

续表1(Continued Tab.1)
3 结论与讨论
本文通过比较山茱萸不同极性部位的透明质酸酶抑制活性,发现山茱萸石油醚部位活性显著高于其他部位,表明山茱萸中极性较小的物质抗过敏活性更高。据Li等[9]报道,含有山茱萸的中药组方提取物在3 mg/mL时对透明质酸酶的抑制率为70%,具有较好的抗过敏作用,而本文通过硅胶柱色谱法分离得到的组分COPE-8仅在2.5 mg/mL时就表现出超过70%的透明质酸酶抑制率,表明其具有更高的抗过敏活性。
肥大细胞活化后分泌和释放介质及炎症因子等引发过敏反应,此过程称为肥大细胞脱颗粒,是机体发生过敏的重要环节[25]。在释放的促炎介质中,组胺是最具特征和最有效的血管活性介质,并被认为是脱颗粒的标志[26]。故本实验通过评价4个活性组分对组胺和β-氨基己糖苷酶释放的影响评价其抗过敏活性,进一步筛选得到活性最好的COPE-8组分,其在20 μg/mL时将组胺和β-氨基己糖苷酶释放水平分别降低46%和39%,而以山茱萸为主的组方C2RLP提取物在30 μg/mL时仅将β-氨基己糖苷酶释放水平降低24%[10],此外山茱萸70%乙醇提取物在30 μg/mL时也仅将β-氨基己糖苷酶释放水平降低18%[6],进一步说明组分COPE-8在抗过敏活性方面的优势。
本研究首次以透明质酸酶抑制活性为导向探索山茱萸中抗过敏活性成分。通过对山茱萸提取物的系统分离纯化,得到具有显著抑制透明质酸酶活性和细胞脱颗粒作用的COPE-8组分,其能显著降低钙离子载体A23187诱导的组胺和β-氨基己糖苷酶的释放,且优于目前已报道的山茱萸粗提物或组方提取物,表明其具有较强的抗过敏活性。通过GC-MS分析明确了COPE-8中的抗过敏活性物质主要为萜类化合物,包括α-香树脂醇、β-香树脂醇和香紫苏醇,且它们还具有抗炎、抗氧化等作用[20,24,27],表明其具有广泛的生物活性。
综上所述,山茱萸中具有抗过敏活性的成分为α-香树脂醇、β-香树脂醇和香紫苏醇,其具有较强的抗过敏活性,且兼具抗炎和抗氧化等生物活性,具有广泛的应用前景。
