基于UPLC-Q-TOF-MS的苦水玫瑰醇提物化学成分分析
2022-08-01杜少波陈晓文董志强谢惠春
杜少波,陈晓文,董志强,谢惠春*
1青海师范大学生命科学学院;2青海省青藏高原药用动植物资源重点实验室;3青藏高原生物资源形成机制与综合利用重点实验室,西宁 810008
玫瑰(RosarugoseThunb)为蔷薇科蔷薇属常绿或落叶灌木,全国各地均有种植,著名品种有山东平阴玫瑰、甘肃苦水玫瑰、北京妙峰山玫瑰等[1,2]。其中,苦水玫瑰(Rosasertata×Rosarugosa)是中国玫瑰和钝齿蔷薇的自然杂交种,具有助眠、抗焦虑等作用,且花瓣中提取的玫瑰油还能作为高级香精、香料、香水及化妆品的重要原料,这都与其化学成分密切相关[3-5]。已有研究证明,玫瑰花中的化学成分高达百余种[6],主要有挥发油类、黄酮类、多酚类、多糖类等化合物。其中挥发油是玫瑰精油的主要类化合物,主要含有香茅醇、香叶醇等化学成分[7]。多酚和黄酮类化合物是玫瑰的主要活性成分,具有清除自由基、清除色素沉着的作用,是重要的抗氧化物质[8]。
目前对于玫瑰精油挥发油类的化学成分研究较多,但玫瑰的黄酮类、多酚类和其他类化合物的成分分析还不够完善,对于苦水玫瑰品种的化学成分的研究更是鲜有报道。因此,本研究采用灵敏度高、选择性高、稳定性高、分辨率高、扫描范围广的超高效液相色谱-四级杆-飞行时间质谱(UPLC-Q-TOF-MS)技术[9],从苦水玫瑰醇提物中分析鉴定出63个主要化学成分。与前人研究相比,本研究进一步完善了苦水玫瑰中黄酮类和多酚类化合物的化学成分鉴定,并且首次在该属鉴定得到的化合物达到28个,为苦水玫瑰的质量控制及药效物质基础研究提供了参考和理论依据。
1 材料与方法
1.1 供试样品
苦水玫瑰样品来自青海省互助县塘川镇黄家湾村苦水玫瑰种植基地(经度101°57′06″,纬度36°50′15″,海拔2 750 m),并由青海省药用动植物资源重点实验室主任陈志教授鉴定,标本保存于青海师范大学城西校区617实验室,标本号为2021-X-06。样品经过自然风干,粉碎过筛(过50目筛)分装后,在-20 ℃冷冻保存备用。
1.2 试剂
甲醇、异丙醇(色谱级LC,德国Merck公司);乙腈、甲酸(质谱级LC/MS,德国Merck公司);氢氧化钠(ACS级,ACS reagent≥97%,美国Sigma公司);亮氨酸脑啡肽(Standards Kit for Tof G2-S,美国Waters公司);蒸馏水(广州屈臣氏食品饮料有限公司);超纯水由Milli-Q超纯水仪制备,其他试剂均为分析纯。
没食子苷(CAS:58511-73-2);槲皮素-3-O-葡萄糖苷-7-O-鼠李糖苷(CAS:18016-58-5);紫云英苷(CAS:480-10-4);羟基积雪草酸(CAS:18449-41-7);没食子酸(CAS:149-91-7);芦丁(CAS:153-18-4);异槲皮苷(CAS:21637-25-2);山奈酚(CAS:520-18-3);槲皮素(CAS:117-39-5);对照品纯度均≥98%,均购自成都植标化纯生物技术有限公司。甲酸钠溶液为实验室配制。
1.3 耗材
0.2 μm、13 mm Pall GHPAcrodisc®Syringe滤膜(美国Pall公司);1 mL一次性无菌注射器带针(丰临医疗器械有限公司);Labmed移液枪头1 000、200、20 μL(美国Labmed Biotech公司);KG2 211W 1.5 mL离心管(美国KiRGEN公司);2 mL透明螺口盖样品瓶(美国Waters公司)。
1.4 仪器与设备
Xevo G2-XS QTof液质联用仪(美国Waters公司);Secura513-1CN精密天平(德国Sartorius公司);KQ3200DE型数控超声波清洗器(昆山市超声仪器有限公司),Milli-Q超纯水仪(美国Millipore公司);5810R台式高速冷冻离心机(德国Eppendorf Centrifuge公司);Masslynx V4.1质谱软件(美国Waters公司);UNIFI?科学信息系统(美国Waters公司)。
1.5 方法
1.5.1 测试样品的配制
所有液质上机样品均现配现用,4 ℃冰箱保存,无长时间放置。
1.5.1.1 对照品溶液的配制
分别取没食子苷、没食子酸、槲皮素-3-O-葡萄糖苷-7-O-鼠李糖苷、芦丁、异槲皮苷、紫云英苷、山奈酚、槲皮素、羟基积雪草酸9个对照品适量置于量瓶中,加甲醇溶解,配置成浓度为0.25 mg/mL溶液,上机前依据化合物的溶解情况,用适量75%乙腈稀释后,冷冻离心10 min(12 000 r/min,10 ℃),离心管取出后轻放,取上清液,分别存储2 mL的透明样品瓶中。
1.5.1.2 供试品溶液的配制
准确称取自然风干的苦水玫瑰样品0.5 g,置于具塞玻璃试管,加入5 mL色谱甲醇浸没,50 ℃水浴,超声提取1 h,摇匀后静置5 min。取提取液上清200 μL,加入75%乙腈1 000 μL稀释,充分混匀后冷冻离心10 min(12 000 r/min,10 ℃),离心管取出后轻放,取上清液过0.2 μm微孔滤膜,存储在2 mL透明样品瓶,标记为Rose,即得供试样品溶液。
1.5.2 UPLC-Q-TOF-MS检测及分析方法
1.5.2.1 色谱条件
Waters ACQUITY UPLC HSS T3色谱柱(100 mm×2.1 mm,1.8 μm),体积流量0.3 mL/min,进样量1 μL,柱温40 ℃;流动相为0.1%甲酸水溶液(A)-0.01%甲酸乙腈溶液(B),梯度洗脱,程序设置见表1。
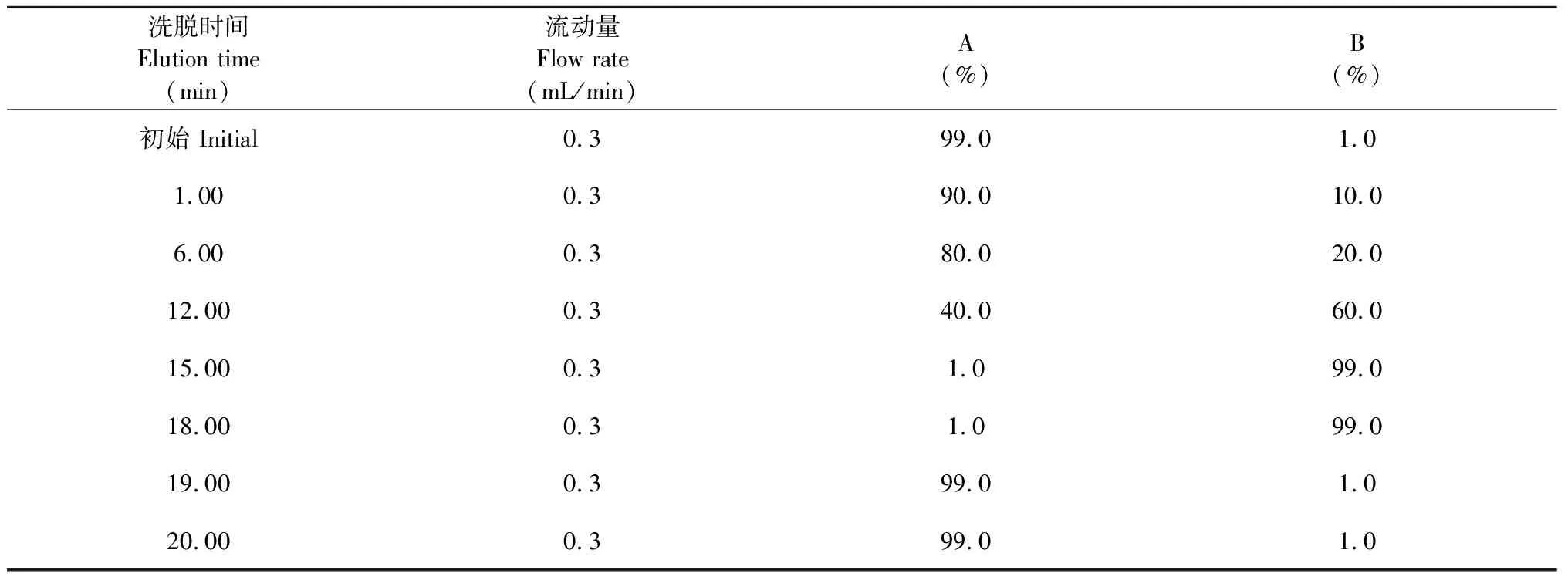
表1 梯度洗脱程序
1.5.2.2 质谱方法
电喷雾离子源(ESI)在负离子条件下,Continuum模式,采集MSE数据。校正液为200 pg/μL亮氨酸脑啡肽,0.5 mmol/L甲酸钠。
扫描范围m/z50~1 200,扫描时间0.2 s,检测时间20 min。
低能量碰撞电压(CE)6 V,高能量碰撞电压为20~60 V;负离子模式的毛细管电压为2.0 kV,锥孔电压为60 V,离子源温度为100 ℃,辅助喷雾电离与去溶剂气体为高纯度N2,去溶剂化温度450 ℃,锥孔气体流量50 L/hr,去溶剂化气体流量600 L/hr。
1.5.3 数据处理
Masslynx V4.1软件,采集、管理和处理UPLC-Q-TOF-MS数据。UNIFI科学信息系统,进行数据的浏览、存储和综合分析等。通过提取MS质谱图和相关碎片信息,基于其内置的质谱分析平台,包括ChemSpider在线数据库(PubMed、PubChem、MassBank等)和中药数据库(TCM Chiese[UNIFI1.7]),结合文献报道和Scifinder数据进行成分判别分析。
2 结果与分析
2.1 苦水玫瑰醇提物分析
基于UPLC-Q-TOF-MS技术,在色谱条件优化的前提下,检测供试样品,得到负离子模式下玫瑰花醇提物的总离子色谱图(total ions chromatograph,TIC),如图1所示。得到没食子苷、没食子酸、槲皮素-3-O-葡萄糖苷-7-O-鼠李糖苷、芦丁、异槲皮苷、紫云英苷、山奈酚、槲皮素及羟基积雪草酸9个对照品负离子模式下总离子色谱图,如图2所示。综合出峰情况,根据质谱给出的精确相对分子质量,结合质谱特征碎片离子信息,对玫瑰花醇提物的化学成分进行定性分析,并结合相关文献及数据库推断,共检测出63个成分。其中,包含26个黄酮类、11个多酚类(4个酚酸类及7个鞣质类)、7个三萜类、4个苯丙素类,1个环烯醚萜类、1个挥发油类、8个有机酸类和5个未鉴定成分,鉴定结果见表2。柳穿鱼叶苷、草木樨苷、积雪草酸等28个化合物首次在该属得到鉴定,其化合物结构式如图3所示。
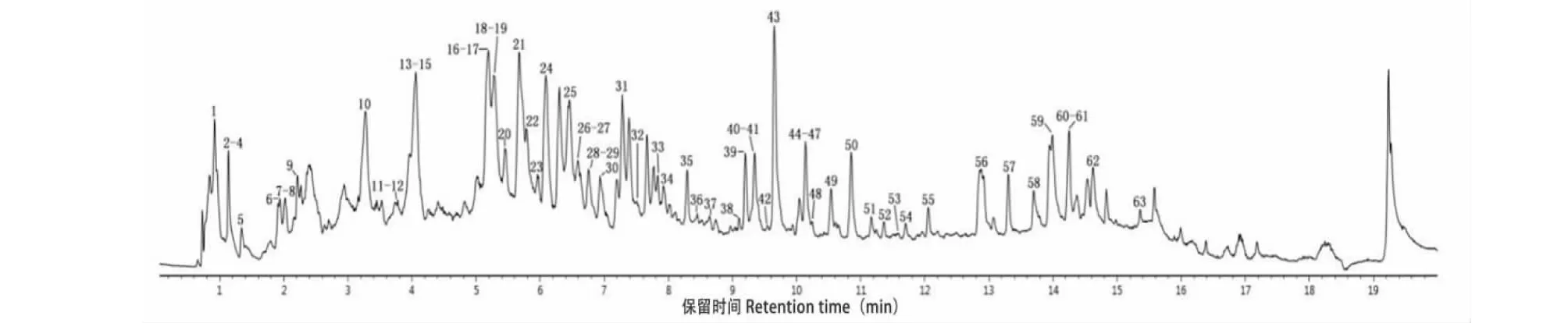
图1 苦水玫瑰负离子模式TICFig.1 TIC of Rosa sertata×Rosa rugosa under negative ion mode

图2 对照品负离子模式TIC图Fig.2 The TIC of standards under negative ion mode注:1~9分别为没食子苷、没食子酸、槲皮素-3-O-葡萄糖苷-7-O-鼠李糖苷、芦丁、异槲皮苷、紫云英苷、山奈酚、槲皮素、羟基积雪草酸。Note:1-9 are glucogallin,gallic acid,quercetin-3-O-Glucoside-7-O-rhamnoside,rutin,isoquercitroside,kaempferol-3-O-glucoside,kaempferol,quercetin,madecassic acid.
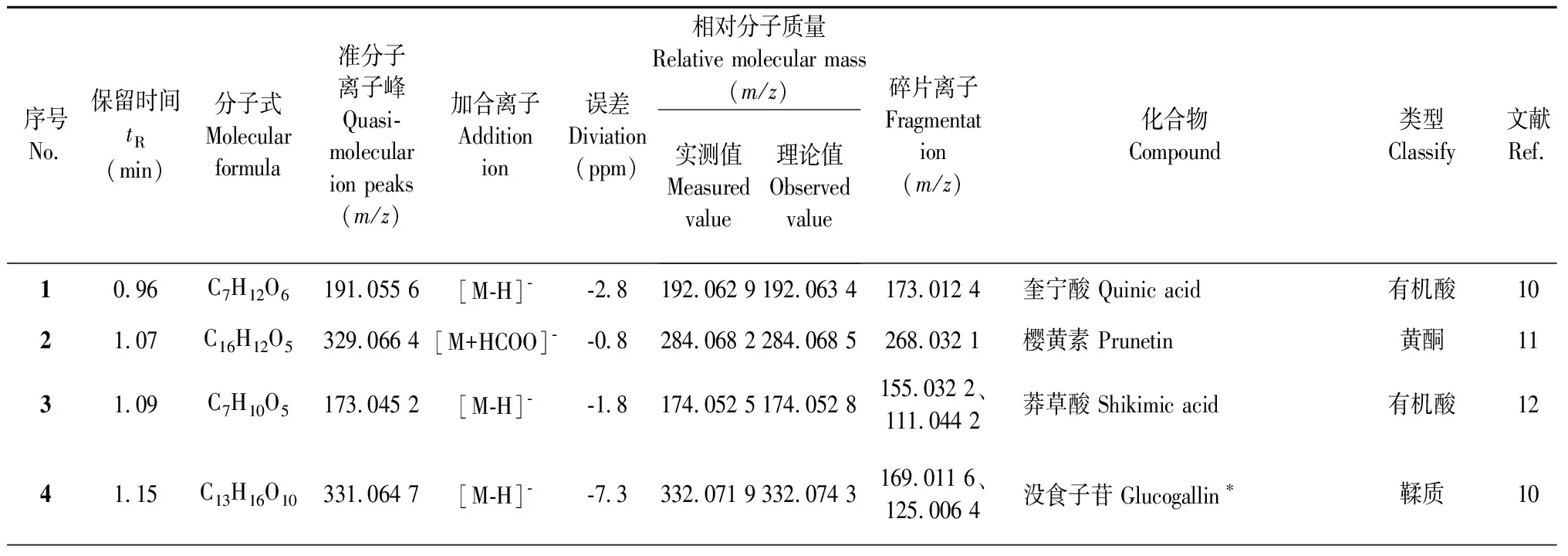
表2 苦水玫瑰的UPLC-Q-TOF-MS质谱数据

续表2(Continued Tab.2)
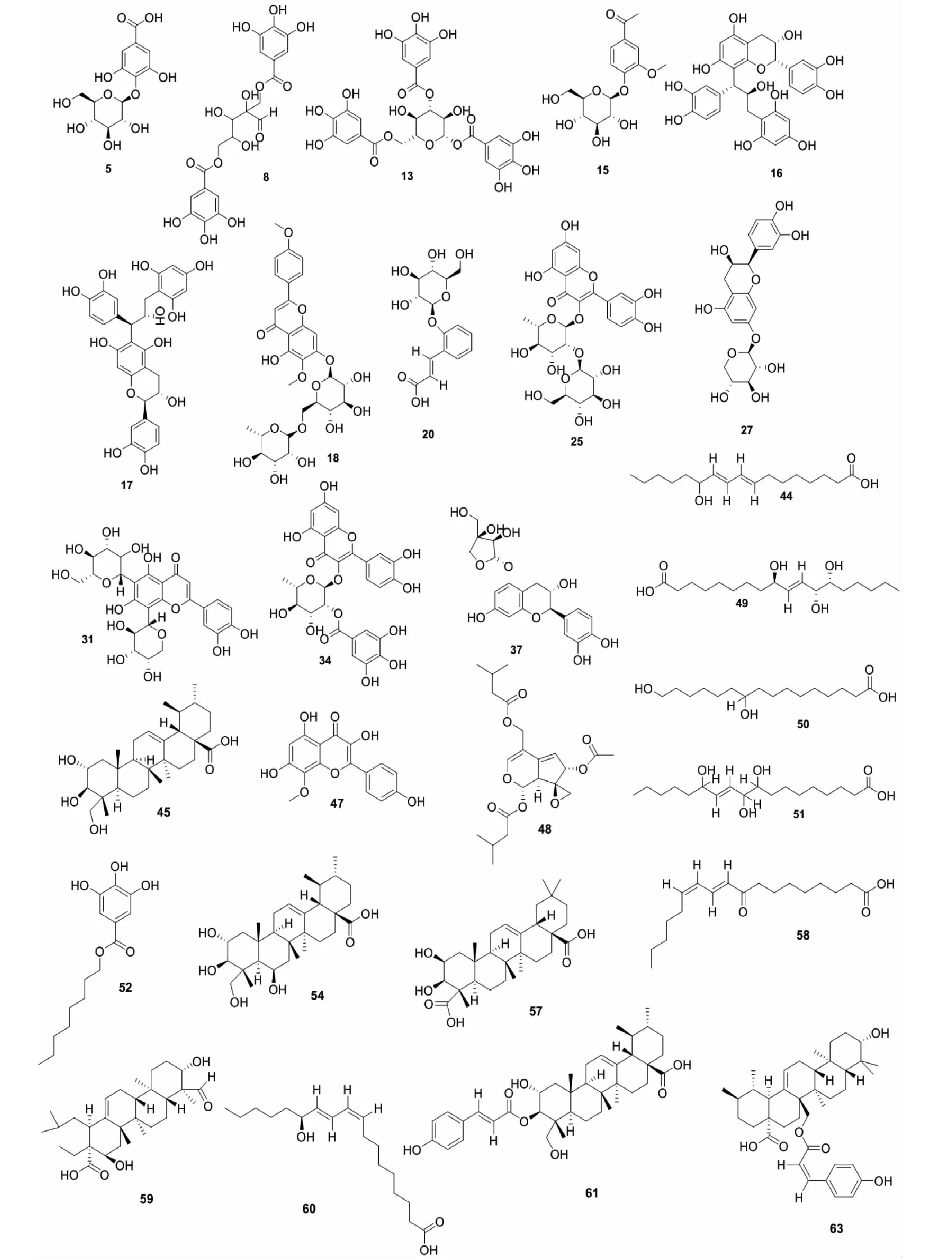
图3 首次从蔷薇属中鉴定的28个化合物结构式Fig.3 Structures of 28 compounds identified from genus Rosa for the first time
2.2 主要化合物的鉴定与归属
2.2.1 黄酮类化合物
黄酮类化合物主要由苷元和糖基组成,发生裂解时首先脱去其糖基部分形成苷元结构,然后苷元离子进一步发生RDA裂解反应或者脱羰基反应[42]。本研究中化合物2、11、18、19、22、23、25~42、46、47为该类化合物。
化合物2:准分子离子峰为m/z329.066 4[M+HCOO]-,推断分子式为C16H12O5,在裂解过程中,失去一分子CH3,形成m/z269.032 1[M-H-CH3]-特征性碎片离子,参考文献[11]确定化合物2为樱黄素。
化合物11:准分子离子峰为m/z289.069 8[M-H]-,推断分子式为C15H14O6,在裂解过程中,首先失去一分子CO2,形成m/z245.076 9[M-H-CO2]-特征性碎片离子,再失去一个C2H2O形成m/z203.068 7[M-H-CO2-C2H2O]-特征性碎片离子,参考文献[15]确定化合物11为表儿茶素。
化合物18:准分子离子峰为m/z657.163 7[M+Cl]-,推断分子式为C29H34O15,在裂解过程中首先失去一分子鼠李糖基分子形成m/z475.015 9[M-H-C6H10O4]-特征性碎片离子,再失去一分子葡萄糖基形成m/z313.023 9[M-H-C12H20O9-Glc]-特征性碎片离子,参考文献[19]确定化合物18为柳穿鱼叶苷。
化合物26:准分子离子峰为m/z609.142 3[M-H]-,推断分子式为C27H30O16,在裂解过程中首先脱去一分子C6H10O4,形成m/z463.278 5[M-H-C6H10O4]-特征性碎片离子,进一步再脱去一个葡萄糖基分子形成m/z301.042 2[M-H-C6H10O4-Glc]-特征性碎片离子,经过对照品对比和参考文献[10]确定化合物26为芦丁,其一、二级质谱图为图4。
化合物27和37:准分子离子峰分别为m/z421.110 4[M-H]-和m/z421.116 3[M-H]-,推断分子式都为C20H22O10,其碎片离子基本相似,确定化合物可能互为同分异构体,其裂解过程可能先失去一分子C5H8O4,形成m/z289[M-H-C5H8O4]-特征性碎片离子,再失去一分子H2O形成m/z271[M-H-C5H8O4-H2O]-特征性碎片离子,参考文献[23]推断化合物27和37为(+)-儿茶素7-O-β-D-木糖苷或其同分异构体。
化合物41:准分子离子峰为m/z593.131 3[M-H]-,推断分子式为C30H26O13,在裂解过程中首先失去一分子C9H6O2形成m/z447.145 3[M-H-C9H6O2]-特征性碎片离子,再失去一分子葡萄糖基形成m/z285.1544[M-H-C9H6O2-Glc]-特征性碎片离子,参考文献[15]确认化合物41为银锻苷。
化合物46:准分子离子峰为m/z285.039 6[M-H]-,推断分子式为C15H10O6,在裂解过程中失去一分子CO2形成m/z241.002 2[M-H-CO2]-特征性碎片离子,参考文献[28]确认化合物46为木犀草素。
化合物19、22、23、25、28~30、32~36、38~40都为槲皮素类或山奈酚类化合物,主要丢失糖基部分。如化合物23:准分子离子峰为m/z609.143 1[M-H]-,推断分子式为C27H30O16,在裂解过程中首先失去一分子鼠李糖基,形成m/z463.053 4[M-H-C6H10O4]-特征性碎片离子,再脱去一个葡萄糖基分子得m/z301.074 8[M-H-C6H10O4-Glc]-特征性碎片离子,经过对照品比对和参考文献[11]确定化合物23为槲皮素-3-O-葡萄糖苷-7-O-鼠李糖苷。化合物35:准分子离子峰为m/z417.081 5[M-H]-,推断分子式为C20H18O10,在裂解过程中首先失去一分子阿拉伯糖基,形成m/z285.125 9[M-H-C5H8O4]-特征性碎片离子,参考文献[20]确定化合物35为山奈酚-3-O-阿拉伯糖苷。
化合物31、42及47:根据分子式和碎片离子信息并结合参考文献[25]、文献[12]和文献[29],推断其为刺苞菊甙、乔松素-7-O-β-D-葡萄糖苷、3,4′,5,7-四羟基-8-甲氧基-黄酮。
2.2.2 多酚类化合物
2.2.2.1 酚酸类化合物
酚酸是一类含有酚环的有机酸,易脱去H2O和CO等部分[43]。本研究中化合物5、7、12、52为该类化合物。
化合物5、7、12、52:其准分子离子峰分别为m/z331.065 2[M-H]-、m/z169.0132[M-H]-、m/z183.028 1[M-H]-、m/z281.141 8[M-H]-,推断其分子式分别为C13H16O10、C7H6O5、C8H8O5、C15H22O5,并且碎片离子中都具有m/z125,结合对照品比对及参照文献[13]、文献[10]、文献[16]和文献[34]确定化合物分别为4-葡萄糖没食子酸、没食子酸、没食子酸甲酯、没食子酸辛酯,其中没食子酸的一、二级质谱图为图5。
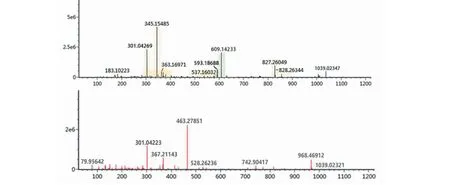
图4 芦丁的一、二级质谱图Fig.4 Primary and secondary mass spectra of rutin
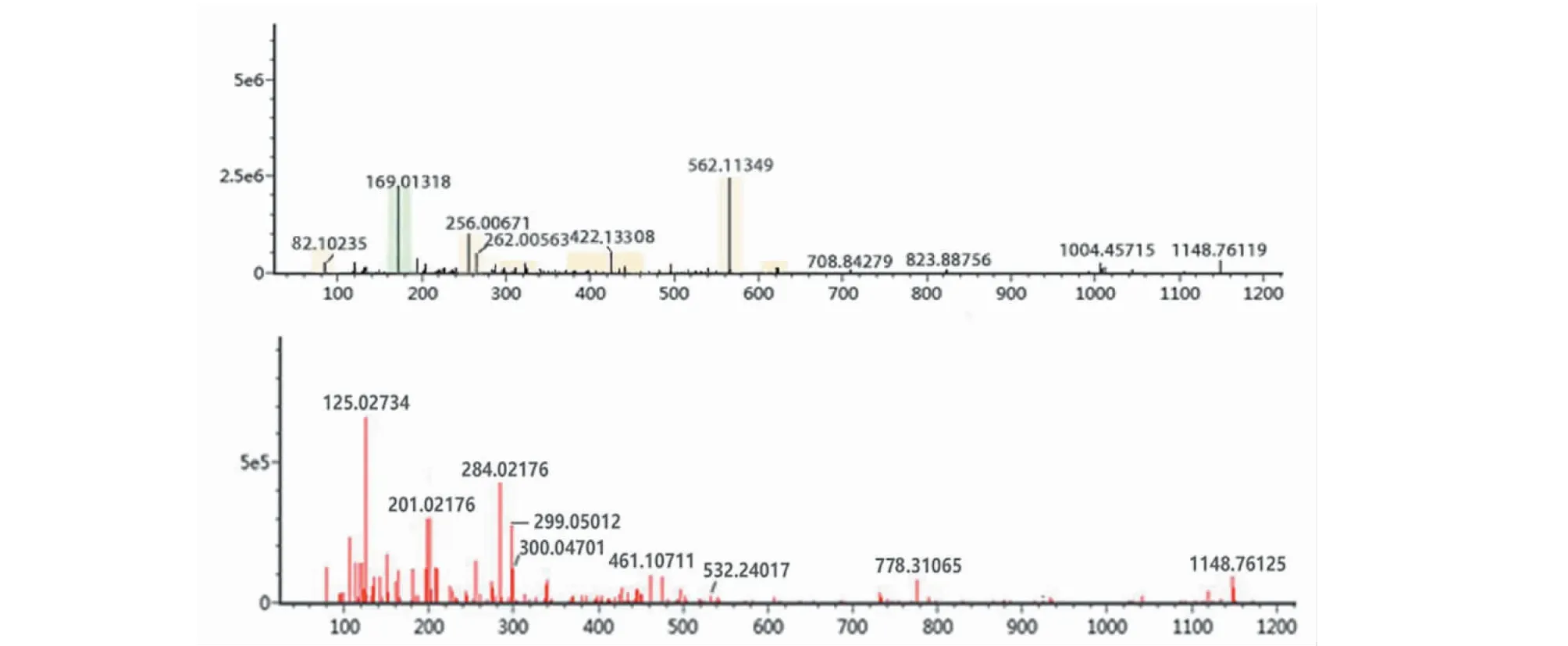
图5 没食子酸的一、二级质谱图Fig.5 Primary and secondary mass spectra of gallic acid
2.2.2.2 鞣质类化合物
鞣质是由没食子酸葡萄糖(多元醇)酯或其衍生物聚合物组成的多元酚,易失去H2O、CO2、CO和Glc等碎片峰,没食子酸也是鞣质的特征碎片[44]。本研究中化合物4、6、8、9、13、16、17为该类化合物。
化合物4:准分子离子峰为m/z331.064 7[M-H]-,推断其分子式为C13H16O10,在裂解过程中首先脱去一分子葡萄糖基形成m/z169.011 6[M-H-Glc]-特征性碎片离子,随后再脱去1分子CO2形成m/z125.006 4[M-H-Glc-COOH]-特征性碎片离子,通过对照品比对和参照文献[10]确定化合物4为没食子苷。
化合物6和8:化合物6和8的准分子离子峰分别为m/z483.078 0[M-H]-和m/z483.077 6[M-H]-,推断其分子式为C20H20O14,确定化合物互为同分异构体,但其碎片离子存在较大差异。化合物6在裂解过程中先失去一分子没食子酰基,形成m/z331.042 5[M-H-C7H4O4]-特征性碎片离子,再失去一分子葡萄糖基形成m/z169.022 4[M-H-C7H4O4-Glc]-特征性碎片离子,最后失去一分子CO2,形成m/z125.064 8[M-H-C7H4O4-Glc-CO2]-特征性碎片离子,参考文献[10]确定化合物6为双-O-没食子酰基葡萄糖。而化合物8的碎片离子是m/z179.012 2,可能是由m/z483.077 6[M-H]-失去两分子没食子酰基形成的,参考文献[14]推断化合物8为金缕梅单宁。
化合物9:准分子离子峰为m/z633.072 3[M-H]-,推断分子式为C27H22O18,在裂解过程中首先失去一分子没食子酸得到m/z463.059 8[M-H-C7H6O5]-特征性碎片离子,再失去一分子葡萄糖基,得到m/z301.001 4[M-H-C7H6O5-Glc]-特征性碎片离子,经过对照品比对和参照文献[10]确认化合物9为诃拉里京。
化合物13:准分子离子峰为m/z635.087 7[M-H]-,推断分子式为C27H24O18,在裂解过程失去一分子没食子酰基形成m/z483.016 9[M-H-C7H4O4]-特征性碎片离子,再失去一分子H2O形成m/z465.074 6[M-H-C7H4O4-H2O]-特征性碎片离子,又失去一分子没食子酰基形成m/z313.046 1[M-H-C7H4O4-H2O-C7H4O4]-特征性碎片离子,继而失去糖基部分,形成m/z169.189 6[M-H-C7H4O4-H2O-C7H4O4-C6H8O4]-特征性碎片离子,最后失去一分子CO2,形成m/z125.081 4[M-H-C7H4O4-H2O-C7H4O4-C6H8O4-CO2]-,参考文献[16]确定化合物13为1,3,6-三没食子酰葡萄糖,其一、二级质谱图为图6。
化合物16和17:准粒子峰为m/z625.155 3[M+HCOO]-和m/z625.156 6[M+HCOO]-,推断其分子式为C30H28O12,其碎片离子基本相似,确定化合物可能互为同分异构体,其裂解规律可能先失去一分子H2O,形成m/z561[M-H-H2O]-特征性碎片离子,再失去一分子C15H12O5,形成m/z289[M-H-H2O-C15H12O5]-特征性碎片离子,继而失去一分子CO2,形成m/z245[M-H-H2O-C15H12O5-CO2]-特征性碎片离子,最后失去一分子C2H2O形成m/z203[M-H-H2O-C15H12O5-CO2-C2H2O]-,参考文献[18]推断化合物16和17可能为gambiriin A2和其同分异构体。
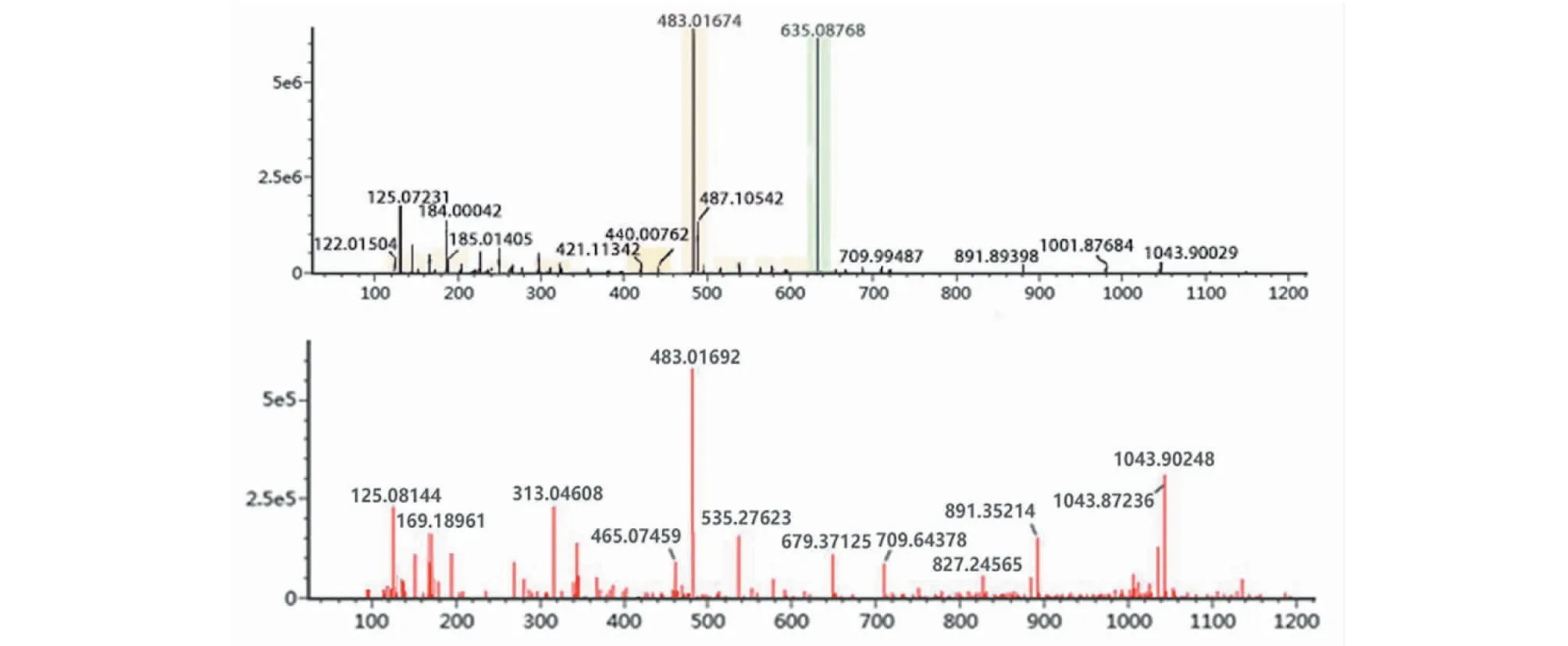
图6 1,3,6-三没食子酰葡萄糖的一、二级质谱图Fig.6 Primary and secondary mass spectrums of 1,3,6-trigalloyl glucose
2.2.3 三萜类化合物
三萜类化合物裂解方式多见为丢失H2O、CO等基团,并且糖苷键也容易发生断裂,中性丢失葡萄糖、鼠李糖等糖基[45]。本研究中化合物45、54~57、59、62为该类化合物。以化合物56为例,准分子离子峰为m/z487.340 5[M-H]-,推断分子式为C30H48O5,在裂解过程中直接丢失一分子CO2形成m/z443.337 6[M-H-CO2]-特征性碎片离子,或首先脱去一分子H2O形成m/z469.310 8[M-H-H2O]-特征性碎片离子,再丢失一分子CO2形成m/z425.342 6[M-H-H2O-CO2]-特征性碎片离子,参考文献[24]确定化合物56为蔷薇酸。
2.2.4 苯丙素类化合物
苯丙素类化合物是指母核含一个或几个C6-C3单元的天然有机化合物类型,质谱裂解主要发生糖基、酰基等结构部分的丢失[46]。本研究中化合物15、20、61、63为该类化合物。以化合物20为例,准分子离子峰为m/z325.092 5[M-H]-,推断分子式为C15H18O8在裂解过程中,首先失去一分子葡萄糖基得到m/z163.072 0[M-H-Glc]-特征性碎片离子,再脱去一分子H2O形成m/z145.015 3[M-H-Glc-H2O]-特征性碎片离子,通过参照文献[21]确认化合物20为草木樨苷。
2.2.5 有机酸类化合物
从苦水玫瑰干花醇提物中还鉴定出化合物1、3、44、49、50、51、58、60为该类化合物。以化合物3为例,其准分子离子峰为m/z173.045 5[M-H]-,推断其分子式为C7H10O5,在裂解过程中首先失去一分子H2O形成m/z155.032 2[M-H-H2O]-特征性碎片离子,随后失去一分子CO2形成m/z111.0442[M-H-H2O-CO2]-特征性碎片离子,再失去一分子CO形成m/z83.038 2[M-H-H2O-CO2-CO]-特征性碎片离子,通过参照文献[12]鉴定化合物3为莽草酸。
2.2.6 环烯醚萜类及挥发类化合物
本文在苦水玫瑰中还鉴定出1个环烯醚萜类和1个挥发油类化合物,分别为异缬草素(化合物48)和香茅醇乙酸酯(化合物53)。
3 讨论与结论
本研究采用UPLC-Q-TOF-MS技术具有高灵敏度、高精度、高分辨率等特点,可以更全面、更快速的完成对苦水玫瑰化学成分鉴定。本课题组在研究之前考察了负离子模式下玫瑰花水提物和醇提物的质谱出峰情况和离子响应,综合出峰情况,发现苦水玫瑰醇提物在(-)ESI-MS质谱离子流图的分离度较好,响应较高,所以采用UPLC-Q-TOF-MS对苦水玫瑰醇提取物中的化学成分进行系统分析,进一步完善苦水玫瑰化学成分的鉴定。
本研究从苦水玫瑰醇提物中鉴定出26个黄酮类、11个多酚类(包含4个酚酸类及7个鞣质类)、7个三萜类、4个苯丙素类、1个环烯醚萜类、1个挥发油类和8个有机酸类化合物。其中,酚酸类、鞣质类和黄酮类化合物是其主要有效成分。结果可见,鉴定出的黄酮类化合物主要以槲皮素和山奈酚为苷元的化合物,这与前人鉴定结果[47,48]的相似。所鉴定出的4个酚酸类化合物都属于没食子酸类,具有燥湿收敛、清热消炎、凉血止血等功效[49]。鞣质类化合物除化合物16和17外,也都为没食子酸类鞣质,与黄酮类化合物都具有抗肿瘤和抗氧化等药理活性[50,51]。且多酚类化合物在质谱中具有较高响应值,再次证明了苦水玫瑰具有很好的抗氧化和抗肿瘤功效。据文献报道,玫瑰中还含有色素类化合物,如矢车菊素-3,5-双葡糖苷、飞燕草花色素-3-葡糖鼠李糖苷等[52,53],但在本研究结果中并未鉴定出,这可能与苦水玫瑰的处理或液质条件有关,还有待进一步研究。并且从苦水玫瑰负离子模式TIC图中也发现,还有些响应峰值较高的化合物由于在线数据库所匹配的结构式不合理,都未能鉴定出其准确结构信息,如峰10、14、21、24和43,表明苦水玫瑰还有一些未知化合物,且可能是苦水玫瑰的主要成分,还需进一步研究分析。
本研究建立了苦水玫瑰的UPLC-Q-TOF-MS技术的快速分析方法,根据精确相对分子质量,质谱碎片信息,结合相关文献及数据库,更全面地分析和鉴定了苦水玫瑰的化学成分,鉴定出58个化合物,其中28个化合物为首次从该属得到鉴定。为苦水玫瑰的药理作用及药效活性成分等基础研究提供了参考和科学依据。
