不同寄主桑寄生中化学成分的差异性分析
2022-08-01袁嘉欢王文辛蔡芷辰殷圣鑫陈海杰刘训红
袁嘉欢,吴 楠,王文辛,蔡芷辰,殷圣鑫,陈海杰,刘训红,2*,黎 理
1南京中医药大学;2江苏省经典名方工程研究中心,南京210023;3广西中医药大学,南宁 530200
桑寄生Taxilli Herba为桑寄生科植物桑寄生Taxilluschinensis(DC.) Danser的干燥带叶茎枝;为广西著名道地药材[1],主要分布于广西的桂南、桂中、桂东地区;收载于2020版《中国药典》,具有祛风湿、补肝肾、强筋骨、安胎元之功效,用于治疗风湿痹痛,腰膝酸软,筋骨无力等症[2]。现代研究表明,桑寄生主要含有黄酮类[3,4]、有机酸类[5]、萜类[6]等多种类型化学成分,具有抗炎镇痛[7]、降血糖[8]、抗肿瘤[9,10]等多重药理作用。桑寄生属于半寄生性植物,寄主多达36科150多种[11]。《中国药典》对桑寄生的寄主植物没有明确规定,目前市场上流通和使用的多为多寄主基源药材,质量参差不齐。不同历史时期的本草学已有不同寄主对桑寄生药材质量影响的详实记载,并已注意到不同寄主桑寄生药材的毒性、药效均有不同[12-14]。近年来,寄主与桑寄生药材质量关系的研究表明,不同寄主来源桑寄生中总黄酮、槲皮素和槲皮苷含量存在明显差异[15-18],桑寄生会以一定的形式累积寄主植物的特征性成分[19,20],同时不同寄主来源桑寄生中挥发性成分的种类和含量也存在差异[21]。Xia等[22]发现桑树寄主桑寄生水提物无肝损伤,漆树、油茶、柳树、苦楝和夹竹桃5种寄主桑寄生表现出不同程度的肝损伤。Zhang等[23]发现各寄主来源桑寄生均具有降压作用,寄主对桑寄生的降血压作用存在影响。
目前对于不同寄主来源桑寄生的研究多集中于总黄酮含量的变化[16,17]、HPLC特征指纹图谱研究[24]及应用红外光谱方法[25]区分不同寄主桑寄生,对不同寄主来源桑寄生中化学成分的差异性研究尚未见报道。因此,对不同寄主来源桑寄生差异性化学成分进行研究,对完善其质量控制体系具有重要意义。本实验借鉴植物代谢组学的研究思路与方法[26],采用超快速液相色谱-三重四极杆飞行时间串联质谱(UFLC-Triple TOF-MS/MS)技术分析不同寄主来源桑寄生化学成分的差异性,并通过多元统计分析找出差异显著的化学成分及其变化规律,旨在为揭示寄主植物对桑寄生代谢产物合成和积累的影响规律及探讨桑寄生药材的品质形成机制提供基础资料。
1 材料与方法
1.1 仪器与材料
Triple TOFTM5600 System-MS/MS 高分辨四极杆飞行时间质谱仪(配有Peakview 1.2 数据处理系统,美国AB Sciex 公司);SIL-20A XR 超快速液相色谱仪(日本 Shimadzu公司);Q-500B高速多功能粉碎机(上海冰都电器有限公司);ME36S型电子分析天平(1/100万,德国赛多利斯公司);BSA224S型电子分析天平(1/1万,德国赛多利斯公司); PT-124/85S型电子分析天平(1/10万,华志电子科技有限公司);Milli-Q超纯水制备仪(美国Millipore公司);KQ-500B超声波清洗机(超声功率500W,40kHz,昆山超声仪器有限公司);H1650-W高速离心机(湖南湘仪实验室仪器开发有限公司)。
对照品:槲皮素 3-O-β-D-葡萄糖醛酸苷(批号DST200703-055)、异樱花素(批号DST201227-161)购于南京良纬生物科技有限公司;金丝桃苷(批号P12S11F124379)、(+)-儿茶素(批号P21J11F11 8380)购自上海源叶生物科技有限公司;山奈苷(批号AF21020202)购自成都埃法生物科技有限公司;槲皮苷(批号111538-200302)购于中国药品生物制品检定所,化合物纯度均大于98%。甲醇、乙腈、甲酸均为色谱纯,购于Merck公司。实验用水为Milli-Q超纯水。
桑寄生采集于广西境内,来源于10个寄主,每个寄主上的桑寄生样品采集4份,样品信息见表1。药材干燥方式为实验室烘箱干燥,采收后均立即干燥。药材经南京中医药大学药学院刘训红教授鉴定为桑寄生科植物桑寄生Taxilluschinensis(DC.) Danser的带叶茎枝。留样凭证保存于南京中医药大学中药鉴定实验室。

表1 桑寄生药材样品信息

续表1(Continued Tab.1)
1.2 测试条件
1.2.1 色谱条件
色谱柱:Agilent ZORBAX SB-C18柱(4.6 mm × 250 mm,5 μm);流动相:甲醇:乙腈(1∶1,A)-水(含0.4%甲酸,B);梯度洗脱:0~5 min,2%→6% A;5~6 min,6%→10% A;6~8 min,10%→15% A;8~12 min,15%→18% A;12~18 min,18%→21% A;18~21 min,21%→23%A;21~26 min,23%→25% A;26~30 min,25%→27% A;30~33 min,27%→40% A;33~38 min,40%→50% A;38~40 min,50%→2% A;40~45 min,2%→2% A;柱温30 ℃;流速1.0 mL/min;进样量10 μL。
1.2.2 质谱条件
电喷雾离子源(ESI)负离子模式;离子源温度(TEM)600 ℃;喷雾电压(IS)-4 500 V;脱簇电压(DP)-100 V;质量扫描范围50~1 500m/z;气帘气压力(CUR)40 L/min;雾化气压力(GS1)60 L/min;辅助气压力(GS2)60 L/min。
1.3 溶液的制备
1.3.1 供试品溶液的制备
取桑寄生药材样品,粉碎,过50目筛。精密称定0.5 g,置于具塞锥形瓶中,加入15 mL 50%甲醇,密闭,称定质量,室温下超声提取30 min,放置冷却,再次称定质量,用50%甲醇补足失重,过滤,滤液以13 000 r/min离心10 min,取上清液,过0.22 μm微孔滤膜,即得供试品溶液。
1.3.2 对照品溶液的制备
分别精密称取槲皮素3-O-β-D-葡萄糖醛酸苷、异樱花素、金丝桃苷、(+)-儿茶素、山奈苷、槲皮苷对照品适量,置于10 mL容量瓶中,加适量70%甲醇,超声使溶解。再分别精密吸取各对照品溶液适量,加70%甲醇定容至5 mL,配制混合对照品溶液。
1.4 统计分析
将质谱数据导入MarkerView 1.2.1软件进行峰匹配、峰对齐和滤噪处理,结果进一步导入SIMCA-P 13.0软件进行分析。首先采用PCA初步观察各样品的聚集情况,直观地表达不同寄主桑寄生的化学组成差异;在主成分分析基础上,再用PLS-DA对各样品分类,其中R2X、R2Y越接近1表示模型越稳定,Q2>0.5表示预测率高。根据PLS-DA模型得到的变量权重值(VIP>1)找到潜在的差异化学成分。采用t检验验证多维统计中找到的差异化学成分是否在单维统计中具有显著性差异,其中P<0.05则表示有显著性差异。
1.5 差异化学成分的鉴定
通过一级质谱确定精确相对分子质量,二级质谱获得裂解信息,结合CNKI(https://www.cnki.net/),SciFinder (https://scifinder.cas.org/)和HMDB(http://www.hmdb.ca/)数据库搜索、对照品比对及已报道文献,对VIP>1且P<0.05的差异化学成分进行结构鉴定。共有差异化学成分的量以各样品对应的峰面积表示,通过对不同寄主桑寄生样品间同一物质峰面积的平均值和标准差进行计算,得到差异成分在不同寄主样品间的相对含量变化。
2 结果
2.1 条件的优化
2.1.1 样品处理方法的优化
供试品溶液的制备中考察了甲醇、80%甲醇、70%甲醇、60%甲醇、50%甲醇、40%甲醇、30%甲醇7种溶剂,结果表明50%甲醇为溶剂时的色谱峰峰型优于其他6种溶剂。同时考察了固液比(1∶10、1∶20、1∶30、1∶40、1∶50)和超声时间(15、30、45、60、75、90 min),最终结果表明当固液比为1∶30,溶剂为50%甲醇,超声时间为30 min时得到的相对峰面积较大。
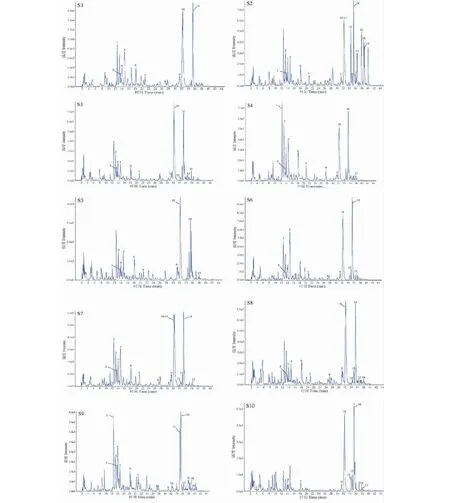
图1 不同寄主来源桑寄生样品的UFLC-Triple TOF-MS/MS基峰图Fig.1 UFLC-Triple TOF-MS/MS base peak chromatogram of Taxilli Herba from different host plants注:图中编号S1~S10与表1中一致。Note:S1~S10 in Fig.1 were the same as those in Table 1.
2.1.2 色谱、质谱条件的优化
流动相的选择分别考察了甲醇-水、乙腈-水、甲醇-0.4%甲酸水、乙腈-0.4%甲酸水,甲醇∶乙腈(1∶1)-0.4%甲酸水及梯度洗脱条件下对样品中各峰分离度的影响。结果表明,以甲醇:乙腈(1∶1)-0.4%甲酸水溶液为流动相进行梯度洗脱时,各色谱峰具有较好的峰形和分离效果。前期研究发现,桑寄生中主要含有黄酮类和有机酸类化学成分,在负离子模式下有较好的响应,因此选择负离子模式进行质谱检测。
根据优化的色谱质谱条件,对不同寄主来源的桑寄生样品进行UFLC-Triple TOF-MS/MS分析。结果显示,10个不同寄主来源桑寄生样品在负离子模式下的基峰图基本相似,但某些色谱峰的离子强度存在显著的差异,说明不同寄主来源的桑寄生样品在化学成分是大致相似的,但在含量上有明显的区别(见图1)。
2.2 PCA分析
采用PCA多变量模式识别方法对10个寄主来源的桑寄生样品进行降维分析。结果显示,模型验证结果(R2X= 0.947,Q2= 0.892)表明该模型稳定,预测能力较强。10个寄主桑寄生PCA分析的散点图(t[1] = 0.636;t[2] = 0.191)示于图2,可以看出,10个寄主来源的桑寄生样品各自聚为一类,分类结果较为理想,说明10个寄主的样品在化学成分的种类和相对含量上存在一定的差异。10个寄主桑寄生相比较,桑树寄主与其他寄主桑寄生分布距离较远,表明在化学成分上差异较大,单独分布在PC1轴负半轴和PC2轴正半轴;大叶冬青、山里红、鸡蛋果和无患子寄主样品分布在PC1轴正半轴和PC2轴正半轴,四者之间在化学成分上差异较小,同理,柿子树和黄皮树寄主的样品,沙梨、假黄皮和松树寄主的样品也分别在化学成分种类和含量上较为相似。
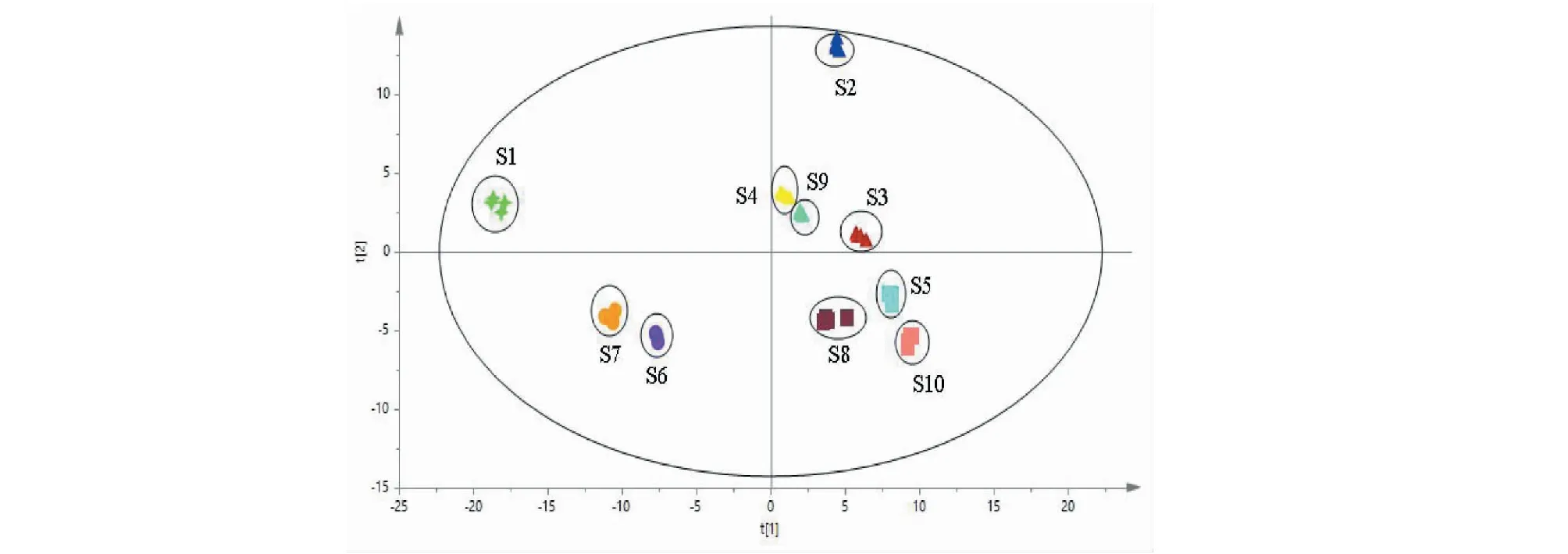
图2 不同寄主桑寄生在负离子模式下PCA得分图Fig.2 The principal component analysis (PCA) scores scatter plot of Taxilli Herba from different host plants in negative mode
2.3 PLS-DA分析
PLS-DA作为一种有监督的模式识别方法,在本文中用于确定10个寄主来源桑寄生样品之间的差异化学成分。本文将目前临床最为常用的桑树寄主来源桑寄生样品与其他9个寄主来源的桑寄生样品分别进行PLS-DA分析,结果示于图3,桑树寄主和其他9个寄主来源的桑寄生样品沿着PC1轴明显分开。模型验证结果(R2Y和Q2)显示模型有效可靠,对两组分类贡献较大的差异性成分(VIP>1)数据列于表2。
2.4 差异化学成分的鉴定与相对定量
通过一级质谱确定精确相对分子质量,二级质谱获得裂解信息,结合数据库搜索、对照品比对及已报道文献,对VIP>1且P<0.05的差异化学成分进行结构鉴定,初步鉴定出19个化学成分,结果见表3。其中4种成分为共有差异成分,分别为(+)-儿茶素、金丝桃苷、槲皮素 3-O-β-D-葡萄糖醛酸苷、槲皮苷。以共有差异化学成分在各样品中对应的峰面积作为相对含量,得到差异成分在不同寄主样品间的相对含量变化。如图4所示,桑树寄主来源桑寄生样品中这4种成分的相对含量均高于其他9个寄主,黄皮树寄主来源的桑寄生排名第二,无患子寄主来源的桑寄生中槲皮素3-O-β-D-葡萄糖醛酸苷和金丝桃苷的相对含量最低。


图3 桑树寄主与其他寄主桑寄生样品的PLS-DA得分图(a)和VIP>1得分图(b)Fig.3 PLS-DA scores plot (a) and VIP>1 plot (b) of samples from Morus alba L.and other host plants

表2 不同寄主来源桑寄生样品PLS-DA分析结果
3 讨论与结论
桑寄生在我国具有十分丰富的资源,历代以桑树为寄主的桑寄生得到广泛认同和使用。由于其半寄生性和广寄性的显著特征,桑寄生药材的寄主植物来源复杂多样,而关于不同寄主来源桑寄生药材的质量研究多局限于总黄酮含量的测定,未见对不同寄主来源桑寄生化学成分的差异性报道。本实验基于UFLC-Triple TOF-MS/MS结合多元统计分析技术分析不同寄主来源桑寄生化学成分的差异性,结果表明10个寄主来源桑寄生样品在PCA模型中的分类效果较为理想,进一步通过PLS-DA分析得到19个差异化学成分,其中(+)-儿茶素、金丝桃苷、槲皮素3-O-β-D-葡萄糖醛酸苷和槲皮苷为共有差异化学成分。桑树寄主桑寄生中这4种成分的相对含量均高于其他9个寄主,其次为黄皮树和柿子树来源的桑寄生,槲皮素3-O-β-D-葡萄糖醛酸苷和金丝桃苷在无患子寄主的桑寄生样品中最低,为区分不同寄主来源桑寄生提供重要的辨认信息。4种共有差异化学成分均为黄酮类化合物,但在不同寄主来源桑寄生中含量差异明显,提示寄主是影响桑寄生药材质量的关键因素,至于含量差异引起的临床疗效变化仍待探索。

表3 不同寄主来源桑寄生中差异化学成分的鉴定
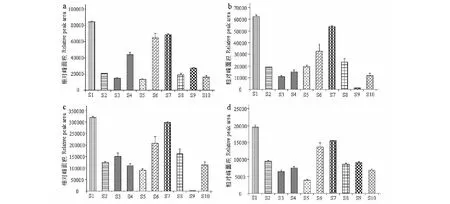
图4 不同寄主来源桑寄生中共有差异化学成分的相对含量变化Fig.4 Relative contents of common differential chemical constituents in Taxilli Herba from different host plants注:a.(+)-儿茶素;b.金丝桃苷;c.槲皮素 3-O-β-D-葡萄糖醛酸苷;d.槲皮苷。Note:a.(+)-Catechin;b.Hyperoside;c.Quercetin 3-O-β-D-glucuronide;d.Quercitrin.
综上,本研究借鉴植物代谢组学的研究思路,对10个不同寄主来源桑寄生中化学成分的差异性进行分析,研究结果可为揭示寄主植物对桑寄生代谢产物合成和积累的影响以及探讨桑寄生药材品质形成机制提供基础资料。
