加味桂枝茯苓丸治疗前列腺增生症的网络药理学及实验研究
2022-08-01陈亚飞刘柘君于淑俊刘桂敏汤轶波刘振权
刘 丹,陈亚飞,刘柘君,唐 田,于淑俊,刘桂敏,汤轶波*,刘振权*
1北京中医药大学中药学院;2北京中医药大学中医学院,北京 100029
良性前列腺增生症(benign prostatic hyperplasia,BPH)简称前列腺增生症,临床发病群体多为中老年男性,据统计,BPH发病率随年龄增长而增加,80岁时达80%,且数据仍在逐年递增[1]。BPH的治疗手段有西药和手术治疗,但西药疗法会对神经认知和性功能造成损伤,外科手术则伴随术后并发症,所以探索BPH新的治疗途径刻不容缓。
中医讲究整体观和辨证论治,在疾病治疗上有丰富经验和独特优势。桂枝茯苓丸出自汉代医圣张仲景,本研究中的加味桂枝茯苓丸(modified Guizhi Fuling Pill,MGFP)由桂枝、茯苓、桃仁、牡丹皮、赤芍、王不留行、乌药、水蛭8味中药组成,是课题组前期基于数据挖掘提取出的国医大师王琦院士治疗BPH的核心组方[2]。根据中医理论,BPH的发病病机是“肾气亏虚、瘀血阻滞”,MGFP善散瘀血、消癥积、通水道,临床使用有显著疗效,但中药复方成分复杂,对其作用机制研究造成极大阻碍。
近年来,网络药理学广泛用于中药药理学的研究,其理念围绕有效药物治疗疾病以相互连接网络中的多个分子为靶点,这恰好与中药的多成分、多靶点、多途径理论相契合。基于此,本研究利用网络药理学和分子对接技术探讨MGFP对BPH的潜在作用机制,并建立BPH模型大鼠对其中结合能最优的靶点进行验证,以期为临床治疗提供数据支撑。
1 MGFP治疗BPH的网络药理学研究
1.1 MGFP相关靶点筛选
1.1.1 植物药相关靶点筛选
通过TCMSP数据库(https://tcmspw.com/tcmsp.php)、TCMID数据库(http://119.3.41.228:8000/tcmid/)寻找桂枝、茯苓、桃仁、牡丹皮、赤芍、王不留行、乌药7味植物类中药的化学成分。利用口服利用度(oral bioavailability,OB)≥ 30%及类药性(drug-likeness,DL)≥ 0.18两个ADME属性值对候选成分进行初步筛选。在PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)中下载候选化合物二维构象的sdf格式文件,再导入PharmMapper数据库(http://www.lilab-ecust.cn/pharmmapper/)进行潜在靶点的预测,并将“normalized fit score”排前10的靶点确定为最终结果。筛选结束后,将所有靶点剔除重复值,利用UniProt蛋白质数据库(https://www.uniprot.org)对上述靶点信息进行标准化处理。
1.1.2 动物药相关靶点筛选
由于水蛭是动物药,无法在TCMSP数据库中检索到,故通过国内外相关文献[3,4]搜索其候选成分。参照“1.1.1”项,在PubChem、PharmMapper中筛选潜在靶点,并对靶点信息进行规范化命名。
1.2 BPH相关靶点筛选
选择“prostatic hyperplasia”“benign prostatic hyperplasia”等与BPH相关的疾病作为关键词,挖掘GeneCards数据库(https://www.genecards.org)、OMIM数据库(http://www.omim.org)、TTD数据库(http://bidd.nus.edu.sg/group/cjttd)、DisGeNET数据库(https://www.disgenet.org/)以及DRUGBANK数据库(https://www.drugbank.ca)中BPH的潜在靶点。由于GeneCards数据库靶点过多,而该数据库中score值越高代表此靶点与疾病联系越密切,根据经验,设定score值≥中位数的目标靶点为BPH的潜在靶点,合并5个疾病数据库靶点后,删除重复值得到BPH最终靶点。
1.3 构建药物候选成分目标网络
将8味药筛选出的候选成分与靶点基因导入Cytoscape 3.7.1,利用插件Network Analyzer计算degree值,并构建MGFP药物-候选成分-靶点的网络图。
1.4 MGFP成分-BPH靶点PPI网络构建
提取MGFP成分与BPH疾病的交集靶点,并通过在线作图工具Draw Venn Diagram网站(http://bioinformatics.psb.ugent.be/webtools/Venn/)绘制韦恩图。再将交集靶点导入STRING 11.0平台(https://string-db.org/)分析靶点基因间的相互作用关系,最后将数据导入Cytoscape 3.7.1软件建立蛋白质相互作用(protein-protein interaction,PPI)网络图。
1.5 GO功能注释和KEGG通路富集分析
将“1.4”MGFP与BPH的交集靶点导入Metascape(https://metascape.org/gp/index.html#/main/step1)数据库及KOBAS 3.0(http://kobas.cbi.pku.edu.cn/kobas3)数据库[5],分别进行GO细胞组成(cellular component,CC)富集分析、生物过程(biological process,BP)富集分析、分子功能(molecular function,MF)富集分析及KEGG富集分析,并在Cytoscape 3.7.1软件中构建“成分-靶点-通路”网络图。
1.6 分子对接验证
选取“成分-靶点-通路”网络中degree值排名前5的MGFP核心成分与BPH关键靶点进行分子对接。具体操作如下:(1)制备小分子配体:首先从TCMSP数据库下载MGFP核心成分的.mol2格式文件,再利用AutodockTools加氢、设为配体、确定扭矩中心、选择扭转键,导出为.pdbqt格式。(2)制备受体分子:蛋白质的晶体结构来自RCSB PDB网站(http://www.rcsb.org/),选择具有一种或多种共结晶配体及低“分辨率”值晶体结构的人类蛋白,保存为.pdb格式,利用AutoDockTools去水加氢,设为受体并导出为.pdbqt格式。(3)分子对接:AutoDock是一款基于模拟退火和遗传算法实现受体分子和配体盲对接的工具,盲对接是高通量筛选和反向对接的关键部分,可以发现受体和配体的最佳结合位置与构象,用半经验的自由能计算方法来评价两者的匹配情况[6]。通过AutoDock 4.2.6软件调整Grid Box参数直至盒子将受体分子全部包裹住,采用盲对接的方法寻找活性位点,导出格点参数文件(GPF),运行Autogrid4,设置对接参数及算法进行半柔性对接,运行Autodock4,查看结果。(4)利用PyMOL 2.2.0软件将对接结果可视化处理。
2 MGFP治疗BPH的动物实验验证
2.1 药物与试剂
MGFP剂量参照王琦院士临床用药经验,由桂枝10 g、茯苓10 g、桃仁9 g、牡丹皮10 g、赤芍10 g、王不留行20 g、乌药20 g、水蛭3 g组成,购自北京同仁堂股份有限公司新悦都店。玉米油购自中粮福临门食品营销有限公司(批号:Q/02A3097S);丙酸睾酮注射液购自宁波第二激素厂(批号:200801);非那雄胺片购自浙江仙琚制药股份有限公司(批号:201207);癃闭舒胶囊购自石家庄科迪药业有限公司(批号:J2011201);兔抗BAX购自美国Cell Signaling Technology公司(批号:14796S);免疫组化试剂盒购自北京中杉金桥公司(批号:SP-9001)。
2.2 动物
选用SPF级健康成年雄性SD大鼠48只,体质量200~220 g,购自维通利华实验动物技术有限公司,大鼠饲养于温度23~25 ℃、湿度50%±10%的环境中,照明时间为12 h/d,自由饮水和进食,在新环境适应性饲养7 d后开始实验。
2.3 仪器
旋转蒸发仪(瑞士BUCHI,R-220PRO);荧光倒置生物显微镜(日本NIKON,TS-2);电热鼓风干燥箱(上海申光仪器仪表有限公司,101AB-1);石蜡切片机(德国莱卡,LEICA-RM2165)。
2.4 分组及给药
SD大鼠适应性饲养7天后,随机选取6只为空白组,6只为假手术组,空白组大鼠不做手术处理,假手术组大鼠打开阴囊后挤出睾丸再放回缝合,其余36只大鼠随机分为模型组、MGFP低、中、高剂量组、非那雄胺组以及癃闭舒胶囊组,每组6只,均采用去势手术联合丙酸睾酮注射建立BPH模型。操作方法:先用10%水合氯醛(3 mL/kg)腹腔注射麻醉大鼠,常规消毒后打开阴囊,挤出睾丸,小心剥离脂肪组织后摘除双侧睾丸,在伤口处撒入适量青霉素固体粉末防止感染,然后结扎止血缝合。术后让大鼠恢复7天,选取去势后状态良好的大鼠,皮下注射丙酸睾酮5 mg/kg(丙酸睾酮溶解于玉米油中),1次/天,空白组和假手术组皮下注射等体积玉米油,连续28天。BPH大鼠模型建立成功后开始给药治疗,MGFP低、中、高剂量组分别灌胃6.57、13.14、26.28 g/kg(相当于临床给药剂量的5、10、20倍),非那雄胺组灌胃0.71 mg/kg,癃闭舒胶囊组灌胃0.257 g/kg,空白组、假手术组及模型组灌胃等量蒸馏水,1次/天,连续28天。实验期间,每3天称重一次,根据大鼠体重变化调节给药剂量。
2.5 取材
末次给药后24 h,水合氯醛麻醉,剖开大鼠腹部充分暴露腹腔内脏器,找到大鼠膀胱,前列腺与膀胱相连,位于膀胱背侧,将前列腺与膀胱一同剪取,然后小心分离摘取前列腺,用滤纸吸去多余水分,然后置于4%多聚甲醛固定,用于后续检测。
2.6 免疫组化法检测大鼠前列腺组织中BAX蛋白的表达
固定24 h后,将上述前列腺组织从4%多聚甲醛溶液中取出,依次进行修块、常规乙醇脱水、石蜡包埋、切片(5 μm)、烤片、脱蜡至水操作。蒸馏水中清洗2次,每次5 min;滴加内源性过氧化物酶阻断剂15 min,洗涤;浸入柠檬酸钠抗原修复液并置于微波炉95 ℃加热5 min,进行抗原修复,自然冷却,洗涤;滴加5%山羊血清,室温封闭30 min,甩除免洗;滴加一抗工作液(1∶400),4 ℃孵育过夜,洗涤;滴加二抗辣根过氧化物酶标记的山羊抗兔IgG,室温孵育15 min,洗涤;再依次进行DAB显色、苏木精复染、脱水、透明、封片、晾干并置于显微镜下观察并采集图像。用Image-Pro Plus 6.0图像分析系统测定BAX,BAX的平均光密度值(average optical density,AOD)=累积光密度值(integrated optical density,IOD)/阳性表达面积,AOD值越大表示BAX蛋白表达水平越高。
2.7 统计分析
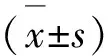
3 结果
3.1 MGFP候选成分及其靶点信息
检索出MGFP化学成分共计713种,包括桂枝224种、茯苓34种、桃仁66种、牡丹皮55种、赤芍119种、王不留行26种、乌药128种、水蛭61种。经“1.1.1”筛选后,最终得到MGFP的候选成分共计133种,包括桂枝7种、茯苓11种、桃仁19种、牡丹皮6种、赤芍18种、王不留行4种、乌药9种、水蛭59种,删除重复值后得MGFP成分靶点317个。MGFP候选成分的基本信息见表1。
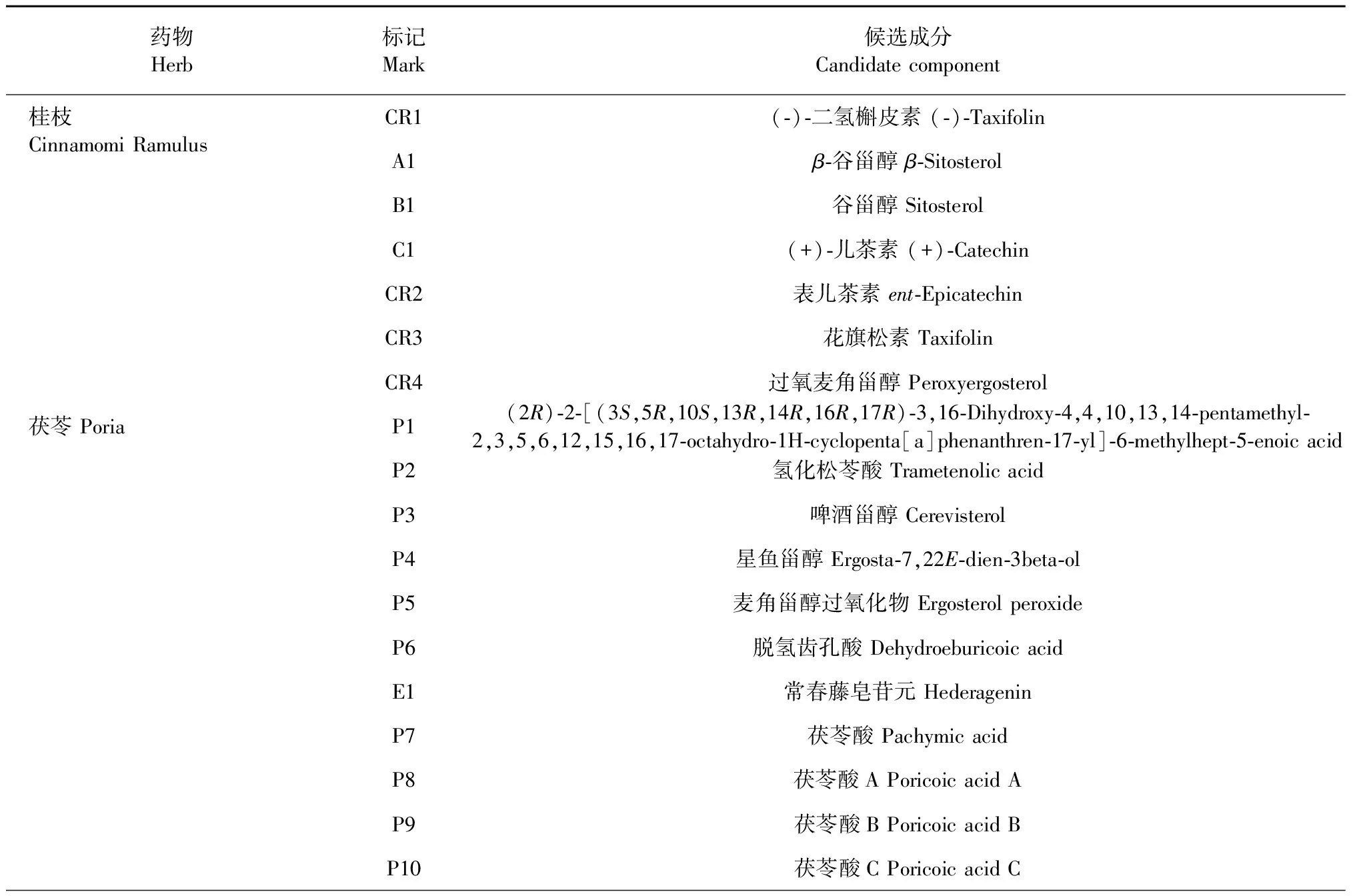
表1 MGFP候选成分

续表1(Continued Tab.1)

续表1(Continued Tab.1)

续表1(Continued Tab.1)
3.2 BPH相关靶点
通过检索GeneCards、OMIM、TTD、DisGeNET以及DRUGBANK五大疾病数据库中BPH的相关靶点,合并、删除重复值后,共获取到BPH的疾病靶点3 026个。
3.3 MGFP药物-候选成分-靶点网络图
将MGFP所含8味中药、133种候选成分以及靶点信息导入Cytoscape 3.7.1进行可视化分析,药物-候选成分-靶点网络图由448个节点和1 825条边组成(见图1)。结果显示,degree值较高的成分是F1(槲皮素)、A1(β-谷甾醇)、D1(豆甾醇)、MDP2(山奈酚)和E1(常春藤皂苷元),表明其可能是MGFP治疗BPH的主要成分,而degree值较高的靶点是PTGS2、CA2、NCOA2、PTGS1、PGR、BMP2、MAOB、GABRA1、PIM1、CDK2,表明MGFP治疗BPH将通过调控多个靶点来发挥作用。
3.4 MGFP成分-BPH靶点PPI网络构建
将筛选后的317个MGFP成分靶点与3 026个BPH疾病靶点取交集,并通过Draw Venn Diagram网站绘制韦恩图,最终得到交集靶点212个(见图2)。将交集靶点导入STRING 11.0平台,设置置信度为medium confidence 0.400,获取PPI网络图的TSV文件,输入Cytoscape 3.7.1,并利用Bisogenet 3.0.0插件在线检索蛋白质相互作用数据库,构建成分疾病的交集靶点PPI网络(见图3)。网络A由211个节点、4 272条边组成,说明交集靶点基因之间存在复杂的相互作用关系,网络B、C分别通过度中心性(degree centrality,DC)≥32、DC≥59筛选核心网络,最终的核心网络C由54个节点、1 233条边组成。根据degree值降序排列,54个核心靶点分别为AKT1、ALB、TP53、IL6、VEGFA、TNF、EGFR、EGF、JUN、MMP9、MYC、CASP3、MAPK1、SRC、MAPK8、ESR1、PTGS2、CXCL8、CCND1、PTEN、FOS、IL1B、HSP90AA1、MMP2、CCL2、IL10、ERBB2、MAPK14、CAT、ANXA5、NOS3、AR、SERPINE1、BCL2L1、ICAM1、PPARG、CYCS、SPP1、RELA、IL2、CASP8、STAT1、HMOX1、VCAM1、TGFB1、KDR、CDKN1A、PLG、HIF1A、CAV1、IFNG、MMP1、MPO、CASP9。

图1 MGFP药物-候选成分-靶点网络图Fig.1 Network diagram of MGFP herbs-candidate components-targets注:圆形节点代表中药;六边形节点代表候选成分;菱形节点代表靶点。Note:Circular node represents the herb;Hexagonal node represents candidate component;Rhombic node represents target.

图2 MGFP成分靶点与BPH疾病靶点韦恩图Fig.2 Venn diagram of the intersection targets of MGFP component and BPH disease

图3 MGFP-BPH核心靶点的筛选图Fig.3 Screening diagram of MGFP-BPH core targets注:A有211个节点和4 272条边;B有106个节点和2 825条边;C有54个节点和1 233条边。Note:A contains 211 nodes and 4 272 edges;B contains 106 nodes and 2 825 edges;C contains 54 nodes and 1 233 edges.
3.5 GO功能注释和KEGG通路富集分析
将212个交集靶点导入Metascape数据库,依次选择GO-CC、GO-BP、GO-MF进行GO功能富集分析,设置P<0.01,count≥3,最终分别得到100、2 489、186条信息。筛选P排名最小的前20条GO生物功能信息,将相关数据导入微生信网站(http://www.bioinformatics.com.cn/)绘制GO生物功能气泡图(见图4)。图中气泡颜色越红越亮表示靶点的P越小,即富集越显著,气泡面积越大表示靶点数越多。结果显示,MGFP主要参与的生物学进程显著性富集于血管生长相关过程、氧化应激相关过程、凋亡相关过程、凝血相关过程及免疫相关过程,见图4B。其中血管生长相关过程包括脉管系统发育进程(vasculature development)、心血管系统发育进程(cardiovascular system development)、血管发育进程(blood vessel development)、血管形态发生(blood vessel morphogenesis);氧化应激相关过程包括对无机物的应答(response to inorganic substance)、活性氧代谢进程(reactive oxygen species metabolic process)、对活性氧的应答(response to reactive oxygen species)、细胞氧化应激应答(cellular response to oxidative stress)。另外,在GO-BP的富集过程中,利用MCODE算法挖掘出三个核心子模块,具体富集分析结果见表2。
相关靶点调控BPH的功能则主要富集于转录因子结合(transcription factor binding)、核受体活性(nuclear receptor activity)、蛋白激酶活性(protein kinase activity)、细胞因子受体结合(cytokine receptor binding)、肾上腺素能受体活性(adrenergic receptor activity)、RNA聚合酶II转录因子结合(RNA polymerase II transcription factor binding)等(见图4C),由此可见,多个靶点的功能与BPH的发生机制密不可分[7]。
将212个交集靶点导入KOBAS 3.0数据库,选择KEGG进行富集分析,得到254条通路,其中P>0.001的通路有172条。运用KOBAS 3.0数据库进行可视化分析,绘制出KEGG信号通路水平柱状图(见图5)。图5A每个节点表示一个富集项,每条边表示两个富集项之间的连接,图中显示出两个富集项的基因重叠比率大于特定界限值(默认值>0.35)的8个cluster,不同颜色的cluster代表结构网络中特定拓扑社区的节点。图5B纵轴表示MGFP治疗BPH的相关KEGG通路,横轴表示富集率,计算方式为“输入靶点数/背景靶点数”,图5B条状图的颜色与图5A的8个cluster对应,条形长度越长代表富集率越高,每个cluster显示富集率最高的5条KEGG通路。KEGG分析结果表明,MGFP可能通过糖尿病并发症AGE-RAGE信号通路(AGE-RAGE signaling pathway in diabetic complications)、PI3K-AKT信号通路(PI3K-AKT signaling pathway)、细胞凋亡(apoptosis/apoptosis-multiple species)、IL-17信号通路(IL-17 signaling pathway)、Th17细胞分化(Th17 cell differentiation)、TNF信号通路(TNF signaling pathway)、VEGF信号通路(VEGF signaling pathway)、MAPK信号通路(MAPK signaling pathway)、Ras信号通路(Ras signaling pathway)、Rap1信号通路(Rap1 signaling pathway)等信号通路在治疗BPH中发挥作用,交集靶点在PI3K-AKT信号通路中的情况见图6[8]。
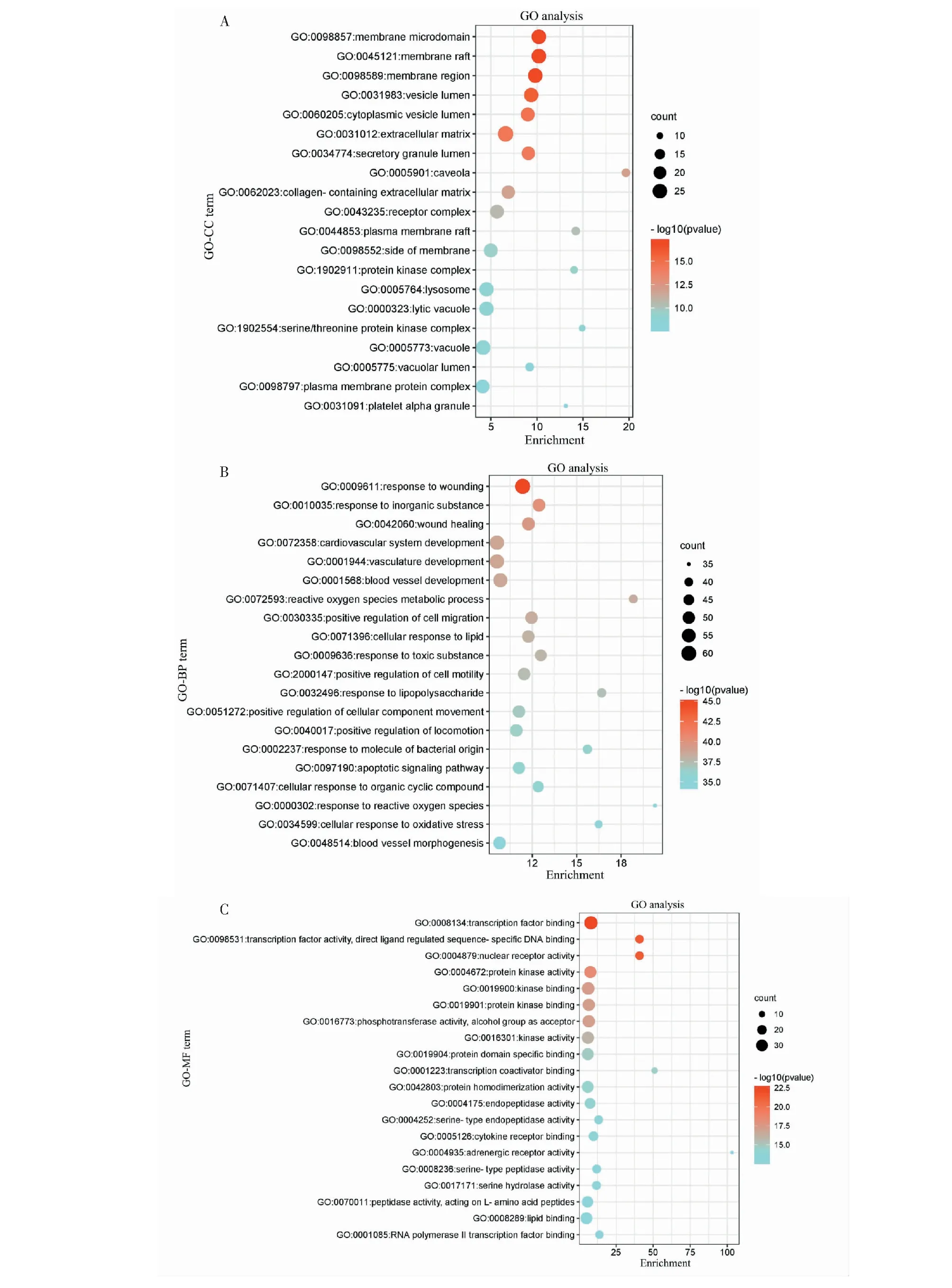
图4 GO功能注释富集分析Fig.4 GO function annotation enrichment analysis注:A:细胞组成分析;B:生物过程分析;C:分子功能分析。Note:A:Cellular component analysis;B:Biological process analysis;C:Molecular function analysis.

表2 子模块GO-BP富集分析基本信息(Top3)

图5 KEGG信号通路富集分析Fig.5 KEGG signaling pathway enrichment analysis注:A:KEGG信号通路模块富集网络图;B:KEGG通路分析水平柱状图。Note:A:Module enrichment network diagram of KEGG signaling pathway;B:Histogram of KEGG pathway enrichment analysis.
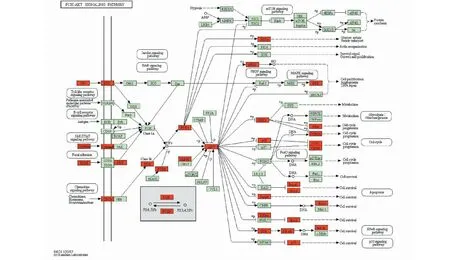
图6 MGFP-BPH的交集靶点在PI3K-AKT信号通路中的情况Fig.6 The intersection targets of MGFP-BPH in PI3K-AKT signaling pathway注:红色矩形代表MGFP-BPH的交集靶点;绿色矩形代表通路中的基础靶点。Note:Red rectangle represents the intersection targets of MGFP-BPH;Green rectangle represents the basic targets in the pathway.

图7 MGFP治疗BPH的“成分-靶点-通路”网络图Fig.7 Network diagram of “component-target-pathway” of MGFP in the treatment of BPH注:蓝色方形代表靶点;绿色圆形代表主要候选成分;红色V形代表通路。Note:Blue square represents the target;Green circle represents the main candidate component;Red V-shape represents the pathway.
此外,利用KOBAS 3.0分析结果中的核心通路反向匹配出相应靶点和成分,并将相关信息导入Cytoscape 3.7.1构建“成分-靶点-通路”网络图(见图7)。结果显示,槲皮素、β-谷甾醇、山奈酚、黄芩素、鞣花酸五种化合物及MAPK1、CASP3、RELA、CASP9、AKT1、BAX、BCL2、PRKCA、TP53、JUN、TGFB1、CASP8、TNF、IL6、VEGFA、EGFR、MAPK8、CHUK、MAPK14、CDKN1A 20个靶点的degree值处于较高水平,参照文献发现AKT1、BAX、BCL2、JUN、TGFB1、TNF、IL6、VEGFA、EGFR是与BPH发病机制密切相关的靶点,该结果也与“3.4”中PPI网络中筛选出的核心靶点相符,故选取上述5种核心成分、9个关键靶点用于后续分子对接。
3.6 MGFP核心成分与关键靶点分子对接
下载MGFP核心成分槲皮素(MOL000098)、β-谷甾醇(MOL000358)、山奈酚(MOL000422)、黄芩素(MOL002714)、鞣花酸(MOL001002)与关键靶点蛋白AKT1(PDBID:4EJN)、BAX(PDBID:3WZE)、BCL2(PDBID:5IF4)、JUN(PDBID:3OY1)、TGFB1(PDBID:5VQP)、TNF(PDBID:2AZ5)、IL6(PDBID:1ALU)、VEGFA(PDBID:5HHC)、EGFR(PDBID:5CAS)的相关文件,使用AutoDock 4.2.6软件进行分子对接,结果见表3。以结合能为参考指标,活性分子与靶点蛋白的最低结合能< 0,说明配体与受体均可自发结合,而结合能越小,二者间的结合能力越强。本研究选取结合能≤ -20 929 J/mol作为筛选依据,其中AKT1、BAX、JUN、TNF、VEGFA靶点与5种核心成分对接结果良好,表明相互间结合能力较优,潜在生物活性高。
以对接结果最好的BAX与β-谷甾醇为例,两者间结合能为-37 966 J/mol,受体蛋白BAX与β-谷甾醇配体小分子之间的结合模式见图8。其中氨基酸残基GLU-815与β-谷甾醇配体小分子形成氢键相互作用,氢键长度为0.19 nm。

表3 MGFP核心成分与关键靶点的分子对接结合能

图8 BAX和β-谷甾醇的分子对接示意图Fig.8 Molecular docking diagram of BAX and β-sitosterol
3.7 MGFP对BPH模型大鼠前列腺组织中BAX蛋白表达的影响
图9所示为各组大鼠前列腺组织中BAX免疫组化结果,观察切片,空白组和假手术组大鼠的前列腺腺体排列规整,上皮细胞排列紧密,腺腔规则平整,腔内基本无炎性细胞浸润。模型组大鼠前列腺腺体向腔内呈乳头状凸起,腺腔显著缩小,腺上皮细胞排列紊乱,呈复层或假复层柱状增生,腔内可见少量炎性细胞,腔外部分平滑肌组织被破坏,排列不紧密,提示造模成功。其余各给药组与模型组相比,前列腺壁厚均有不同程度的减轻。
免疫组化半定量结果见表4。连续给药28天后,空白组大鼠前列腺组织中BAX的表达与假手术组相比无显著差异(P> 0.05)。与假手术组相比,模型组大鼠前列腺组织中BAX的表达显著降低(P< 0.01)。与模型组相比,MGFP低、中、高剂量组、非那雄胺组以及癃闭舒胶囊组均可显著升高BAX的表达(P< 0.01),其中MGFP高剂量组及非那雄胺组效果更好。

表4 MGFP对BPH模型大鼠前列腺组织中BAX蛋白表达的影响
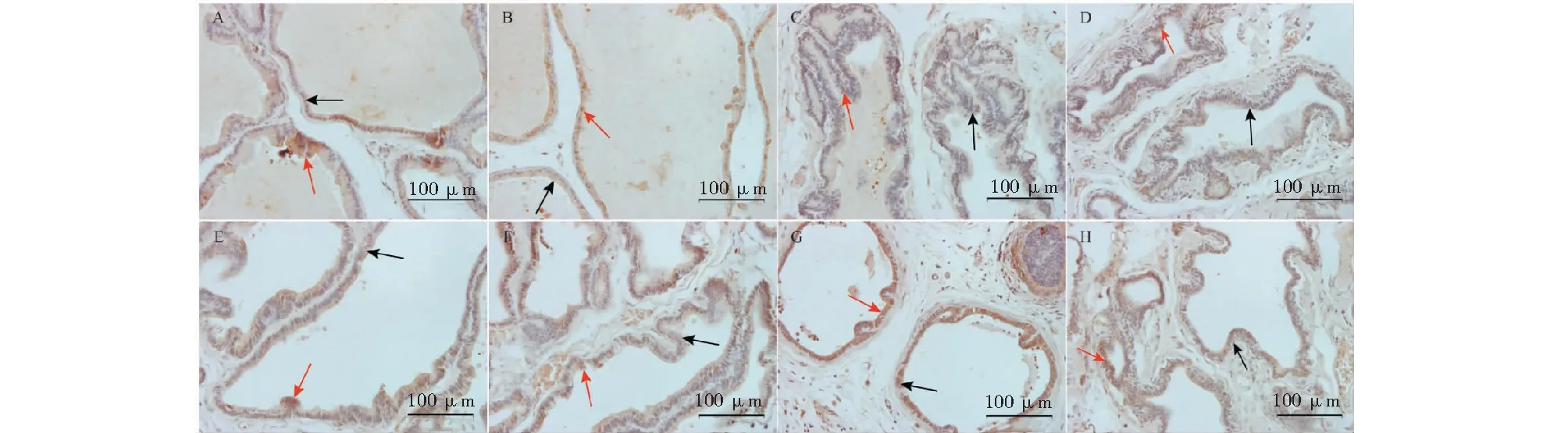
图9 各组大鼠前列腺组织中BAX蛋白表达情况(×200)Fig.9 Expression of BAX protein in prostate tissue of rats in each group (×200)注:A:空白组;B:假手术组;C:模型组;D:MGFP低剂量组;E:MGFP中剂量组;F:MGFP高剂量组;G:非那雄胺组;H:癃闭舒胶囊组。红色箭头表示免疫组化阳性表达区域;黑色箭头表示前列腺组织壁厚。Note:A:Control group;B:Sham operation group;C:Model group;D:MGFP-L group;E:MGFP-M group;F:MGFP-H group;G:Finasteride group;H:Longbishu group.Red arrow indicates immunohistochemical positive expression area;Black arrow indicates the wall thickness of prostate tissue.
4 讨论与结论
据报道,BPH的发病机制主要与性激素、生长因子、炎症反应、细胞凋亡异常等有关[9],其主要病理特征表现为前列腺上皮细胞和基质细胞的增殖。MGFP此方寒温并用,有活血消癥、软坚利水之效,能够明显改善“肾气亏虚、瘀血阻滞”所致的BPH。现代药理研究表明,桂枝茯苓丸的成分主要包括丹皮酚、芍药苷、桂皮醛、茯苓素及苦杏仁苷等,其通过改善血液流变学参数可以降低血液黏稠度,一般用于治疗瘀血(浊)蕴结所致的BPH[10]等疾病。另外还发现,王不留行既能延长血瘀证模型大鼠的凝血时间,又能降低大鼠全血黏度[11];水蛭所含水蛭素具有抗血凝、抗血栓的作用[12];而乌药的主要成分挥发油又能上宣肺气,下输膀胱以缓解泌尿系统结石潴留,从而通利小便[13]。由此可见,MGFP中的化学成分可以通过一定途径达到治疗BPH的目的,体现了中药复方多成分、多靶点、多通路的作用机制。
本研究通过韦恩图得到交集靶点212个,再根据KOBAS分析结果中的核心通路反向匹配出MGFP治疗BPH的核心靶点,结合degree值排名、文献,得到与BPH发病机制联系密切的核心靶点,包括AKT1、BAX、BCL2、JUN、TGFB1、TNF、IL6、VEGFA、EGFR。上述靶点主要与细胞凋亡、血管生长以及炎症有关。据报道,AKT是一种丝氨酸/苏氨酸蛋白激酶,在AKT亚型中,AKT1可抑制凋亡和促进细胞生长、存活,参与BPH的发展[14]。VEGFA是具有高度特异性的血管内皮细胞有丝分裂素,与前列腺新生血管的形成和维持密切相关,活化的AKT磷酸化eNOS以产生NO,促进VEGFA诱导的内皮细胞迁移、血管舒张、血流量增加和血管生成[15]。IL-6是一种功能广泛的多效性细胞因子,在前列腺组织中,IL-6经自分泌途径促进前列腺基底上皮细胞的增殖,造成机体内前列腺细胞增殖和凋亡失衡,从而诱导BPH的发生[16]。
本研究通过GO功能注释分析发现,MGFP参与的生物学进程主要富集在血管生长相关过程、氧化应激相关过程、凋亡相关过程、凝血相关过程及免疫相关过程等,其调控BPH的分子功能主要富集在转录因子结合、核受体活性、蛋白激酶活性、细胞因子受体结合、肾上腺素能受体活性、RNA聚合酶II转录因子结合等。
本研究通过KEGG通路富集分析发现,MGFP对AGE-RAGE信号通路、PI3K-AKT信号通路、细胞凋亡、IL-17信号通路、Th17细胞分化、TNF信号通路、VEGF信号通路、MAPK信号通路、Ras信号通路、Rap1信号通路等有调控作用。研究表明,AGE-RAGE可以刺激促炎因子的产生,从而使细胞过度增殖,导致BPH进一步发展[17]。PI3K-AKT信号通路的激活会导致促凋亡蛋白磷酸化,进而阻断其与抗凋亡分子BCL-2、BCL-XL的结合,使BPH中细胞凋亡减少[18]。IL-17信号通路、Th17细胞分化和TNF信号通路均可介导免疫炎症反应,报道称,感染刺激引起BPH基质细胞产生促炎因子IL-6、IL-8和TNF,从而激活浸润性CD4+T细胞,并通过分泌IL-12、IL-23促进其在Th1、Th17效应细胞中的分化;而活化的Th1、Th17淋巴细胞则会产生促炎细胞因子,如IL-17,促进免疫炎症反应,导致前列腺细胞增生[19]。VEGF是一种由PI3K-AKT信号通路介导的血管生成因子,可促进间质组织中的血管生成和细胞增殖,在BPH发展中也起关键作用[20],再结合核心靶点的结果和图6所示,我们推测PI3K-AKT信号通路和VEGF信号通路间有密切关联。MAPK、Ras信号通路参与调控细胞的基本生物学活动,包括增殖、凋亡、分化和衰老,MAPK级联反应具有Ras依赖性,其异常激活会造成机体细胞增殖/凋亡失衡[21]。另外,还发现Rap1信号通路的激活会促进细胞增殖和迁移,进而使前列腺体积增大[22]。由此推测,MGFP可能通过调节多条信号通路来影响炎症反应、细胞凋亡和增殖,起到治疗BPH的目的。
本研究通过分子对接发现,MGFP的核心成分槲皮素、β-谷甾醇、山奈酚、黄芩素、鞣花酸与AKT1、BAX、BCL2、JUN、TGFB1、TNF、IL6、VEGFA、EGFR的结合能均小于0,说明相互间可以自发结合,而槲皮素、β-谷甾醇、山奈酚、黄芩素、鞣花酸与AKT1、BAX、JUN、TNF、VEGFA的结合能均小于-20 929 J/mol,具有较强的结合能力,以BAX与β-谷甾醇的对接结果最优。研究表明,β-谷甾醇是一种植物甾醇,会干扰多种细胞信号通路,对细胞周期、细胞凋亡、增殖、血管生成等过程造成影响,临床常用于心脏病、肺结核、宫颈癌等疾病[23]。在细胞凋亡过程中,促凋亡的BAX易位到线粒体并与线粒体外膜整合,诱导线粒体外膜通透化释放出细胞色素c,使细胞正常死亡[24]。Sharmila等[25]建立二乙基亚硝胺诱导的大鼠肾癌模型,结果发现,β-谷甾醇治疗组大鼠BAX蛋白表达显著增加。另外,一项多中心、安慰剂对照、双盲的研究显示β-谷甾醇对BPH也有明显改善作用,但其作用机制尚不明确[26]。
本研究通过建立BPH大鼠模型探讨前列腺组织中BAX的表达情况,结果表明,与假手术组相比,模型组大鼠腺上皮细胞增生,腺腔显著缩小,而其余各治疗组与模型组相比,前列腺壁厚均有不同程度的减轻,提示MGFP对BPH模型大鼠有一定治疗效果。免疫组化半定量结果显示,空白组与假手术组大鼠前列腺组织中BAX的表达无显著差异;与假手术组相比,模型组大鼠前列腺组织中BAX的表达显著降低(P< 0.01),表明BPH可能通过抑制前列腺组织中BAX表达,造成细胞凋亡异常。与模型组相比,MGFP低、中、高剂量组、非那雄胺组以及癃闭舒胶囊组均可显著升高BAX的表达(P< 0.01),可能是MGFP调节线粒体依赖性凋亡通路,使与促进细胞凋亡相关的基因BAX表达升高,抑制细胞增殖,且作用效果呈剂量依赖性。
综上所述,MGFP可能通过槲皮素、β-谷甾醇、山奈酚、黄芩素、鞣花酸等核心成分调节AKT1、BAX、JUN、TNF、VEGFA等靶点以及PI3K-AKT信号通路、VEGF信号通路等进而调控机体前列腺血管生长、凋亡、氧化应激等相关生物学过程,发挥治疗BPH的作用。分子对接初步预测到核心成分与关键靶点的最优结合模式为β-谷甾醇-BAX,并通过动物实验探究了MGFP对BAX的作用,为MGFP的广泛应用提供药效学基础。鉴于数据库对化学成分收录不足的局限性且中药炮制后成分发生的变化,后续可通过指纹图谱技术对MGFP的化学成分进行深入研究,有助于提高网络药理学预测结果的可靠性。
