阴地翠雀花的化学成分研究
2022-08-01郭秋菊杨传轮郭春生张纯姑
郭秋菊,杨传轮,陈 琳,黄 帅,郭春生,张纯姑*
1西南交通大学生命科学与工程学院;2西南交通大学物理科学与技术学院,成都 610031;3黄河三角洲京博化工研究院有限公司,滨州 256500
翠雀属(Delphinium)为毛茛科(Ranuculaceae)多年生或一、二年生草本植物,在全球约有300种,广泛分布于北半球地区,我国有近220种[1]。在我国,翠雀属多种植物具有悠久的药用历史,可治疗跌打损伤、风湿、牙痛和肠炎等疾病[2]。二萜生物碱是一类结构复杂的天然产物,广泛存在于翠雀属植物中,基本骨架主要分为C18-、C19-和C20-二萜生物碱[3];现代药理研究表明二萜生物碱具有抗炎、镇痛、抗肿瘤和抗心律失常等药理活性[4]。有研究证明乌头碱型C19-二萜生物碱forrestline F,以及阿替生型C20-二萜生物碱songorine具有一定的抗炎活性[5,6];牛扁碱型C19-二萜生物碱delbrunine和delpheline,以及阿替生型C20-二萜生物碱delphatisine C具有一定的抗肿瘤活性[7]。阴地翠雀花(DelphiniumumbrosumHand.-Mazz.)为毛茛科翠雀属植物,产于云南西北部(中甸至德钦一带),生长在海拔3 500~3 900 m间山地草坡或林下[8]。目前,未见阴地翠雀花的化学成分及生物活性研究报道。因此,为了补充阴地翠雀花的研究空白,为其开发利用提供理论指导。本文对阴地翠雀花的生物碱成分进行系统研究,并测试了部分化合物对脂多糖诱导小鼠RAW 264.7巨噬细胞产生NO的抑制作用,以及所有化合物对小鼠乳腺癌4T1细胞的抗肿瘤活性。
1 材料与方法
1.1 材料
1.1.1 仪器与试剂
核磁共振波谱仪(Bruker AV 400和600,TMS为内标,CDCl3为溶剂);超高效液相色谱(ACQUITY UPLCI-Class)与四级杆飞行时间质谱(Xevo G2-S QTof)联用仪(Waters 公司);RE-2000A 旋转蒸发仪(上海亚荣);ZF-20C 紫外光谱仪、电子分析天平(托利多上海仪器有限公司)。薄层层析硅胶 GF254(青岛海洋化工厂);柱层析硅胶G和H(200~400目,青岛海洋化工厂);显色剂为改良碘化铋钾溶液和碘蒸气;石油醚、二氯甲烷、乙酸乙酯、甲醇、二乙胺等试剂均为分析纯。
全自动酶标仪(Molecular仪器公司);CO2培养箱(Panasonic公司);旋涡混合器(金怡仪器科技有限公司);脱色摇床仪(百岛生物公司);显微镜(麦克奥迪实业集团有限公司)。培养基、胎牛血清和脂多糖(Natocor公司);RAW 264.67细胞(ATCC 细胞库);NO检测试剂盒(碧云天生物公司)。
1.1.2 实验药材
所使用的阴地翠雀花样品于2020年8月采自云南省迪庆州香格里拉市虎跳峡镇,经云南中医学院李国栋副教授鉴定为阴地翠雀花(DelphiniumumbrosumHand.-Mazz.),标本(2020HS00002)留存于西南交通大学生命科学与工程学院。
1.2 方法
1.2.1 提取与分离
将干燥的阴地翠雀花全草部分(10.0 kg),粉碎后用95%乙醇浸提5天(4次),回收滤液、减压浓缩得总浸膏1.2 kg,用温水溶解浸膏后,加入稀释的盐酸水溶液,调节pH至2~3,用石油醚(4.0 L)萃取4次,萃取液进行减压浓缩。随后水层用氨水调节pH至9~10,二氯甲烷萃取至无生物碱,减压浓缩萃取液,得总生物碱73.0 g。
阴地翠雀花的总生物碱经正相硅胶柱层析初步分离,选用洗脱剂(二氯甲烷∶甲醇100∶1→0∶1)进行梯度洗脱,得到A~D四个部分。B部分通过硅胶柱层析(石油醚∶乙酸乙酯∶二乙胺50∶1∶0.03→0∶1∶0.03)洗脱得到B1和B2两个部分。B1部分通过硅胶柱层析(石油醚∶乙酸乙酯30∶1→0∶1)梯度洗脱,得到B1-1、B1-2和B1-3三个部分;B1-2部分通过硅胶柱层析(石油醚∶二乙胺15∶1→4∶1)梯度洗脱,得到化合物14(120.0 mg);B1-3部分通过硅胶柱层析(二氯甲烷∶甲醇80∶1→10∶1)梯度洗脱,得到化合物4(13.0 mg),化合物5(19.0 mg),化合物11(230.0 mg)和化合物12(50.0 mg)。B2部分通过硅胶柱层析(石油醚∶二乙胺20∶1→0∶1)梯度洗脱,得到化合物6(16.0 mg)。C部分通过硅胶柱层析(二氯甲烷∶甲醇60∶1→0∶1)洗脱得到C1、C2、C3和C4四个部分。C1部分经硅胶柱层析(石油醚∶二乙胺15∶1→3∶1)洗脱得到化合物10(180.0 mg);C2部分通过硅胶柱层析(乙酸乙酯∶二乙胺50∶1→8∶1)梯度洗脱得到化合物2(140.0 mg)和化合物9(50.0 mg);C3部分经硅胶柱层析(石油醚∶乙酸乙酯∶二乙胺30∶1∶0.1→0∶1∶0.1)洗脱得到化合物1(113.0 mg);C4部分通过硅胶柱层析(二氯甲烷∶甲醇40∶1→5∶1)梯度洗脱得到化合物3(6.0 mg)。D部分通过硅胶柱层析(二氯甲烷∶甲醇70∶1→0∶1)洗脱得到D1、D2和D3三个部分。D2部分通过硅胶柱层析(乙酸乙酯∶二乙胺40∶1→5∶1)洗脱得到化合物7(22.0 mg)和化合物13(6.0 mg);D3部分通过硅胶柱层析(石油醚∶乙酸乙酯∶二乙胺30∶1∶1→5∶1∶1)洗脱得到化合物8(287.0 mg)。
1.2.2 体外抗炎活性测试
采用MTT法测定所有化合物对小鼠单核巨噬RAW 264.7细胞的存活率[9]。将RAW 264.7细胞以100 μL/孔(每孔含6×103个细胞)接种至96板孔中培养12 h。加入含药培养基(40 μmol/L,100 μL/孔),正常组和空白组加入含1% DMSO的培养基(100 μL/孔)培养24 h后,加入5 mg/mL MTT(20 μL/孔)培养4 h,弃去上清液,加入DMSO(150 μL/孔),摇床震荡10 min后,采用酶标仪在492 nm处读取吸光值(A)。
细胞存活率=
[(A样品-A空白)/(A正常对照-A空白)]×100%
采用Griess法考察部分化合物的抗炎活性,测定其对由脂多糖诱导的小鼠单核巨噬RAW 264.7细胞炎症的抗炎作用[10,11],以塞来昔布(10 μmol/L)为阳性对照。将RAW 264.7细胞以100 μL/孔(每孔含2×104个细胞)在96板孔中培养12 h,用LPS(1 μg/mL)和含药培养基(40 μmol/L,100 μL/孔)预处理24 h,模型组与空白组加入培养基。按NO试剂盒说明书进行操作,并用酶免疫测定仪在540 nm处测量吸光值(A)。
NO生成抑制率=
[(A模型-A样品)/(A模型-A空白)]×100%
1.2.3 体外抗肿瘤活性测试
采用MTT法测定化合物对小鼠乳腺癌4T1细胞的生长抑制率[12,13],以紫杉醇(10 μmol/L)为阳性对照。将4T1细胞以100 μL/孔(每孔含2×104个细胞)在96板孔中培养12 h,加入含药培养基(40 μmol/L,100 μL/孔),正常组和空白组加入含1% DMSO的培养基(100 μL/孔)培养24 h,于96板孔中重新加入5 mg/mL MTT(20 μL/孔)和培养基培养4 h,弃去上清液,加入DMSO(150 μL/孔),摇床震荡10 min后,采用酶标仪在492 nm处读取吸光值(A)。
细胞生长抑制率=
[(A正常对照-A样品)/(A正常对照-A空白)]×100%
2 实验结果
2.1 结构鉴定

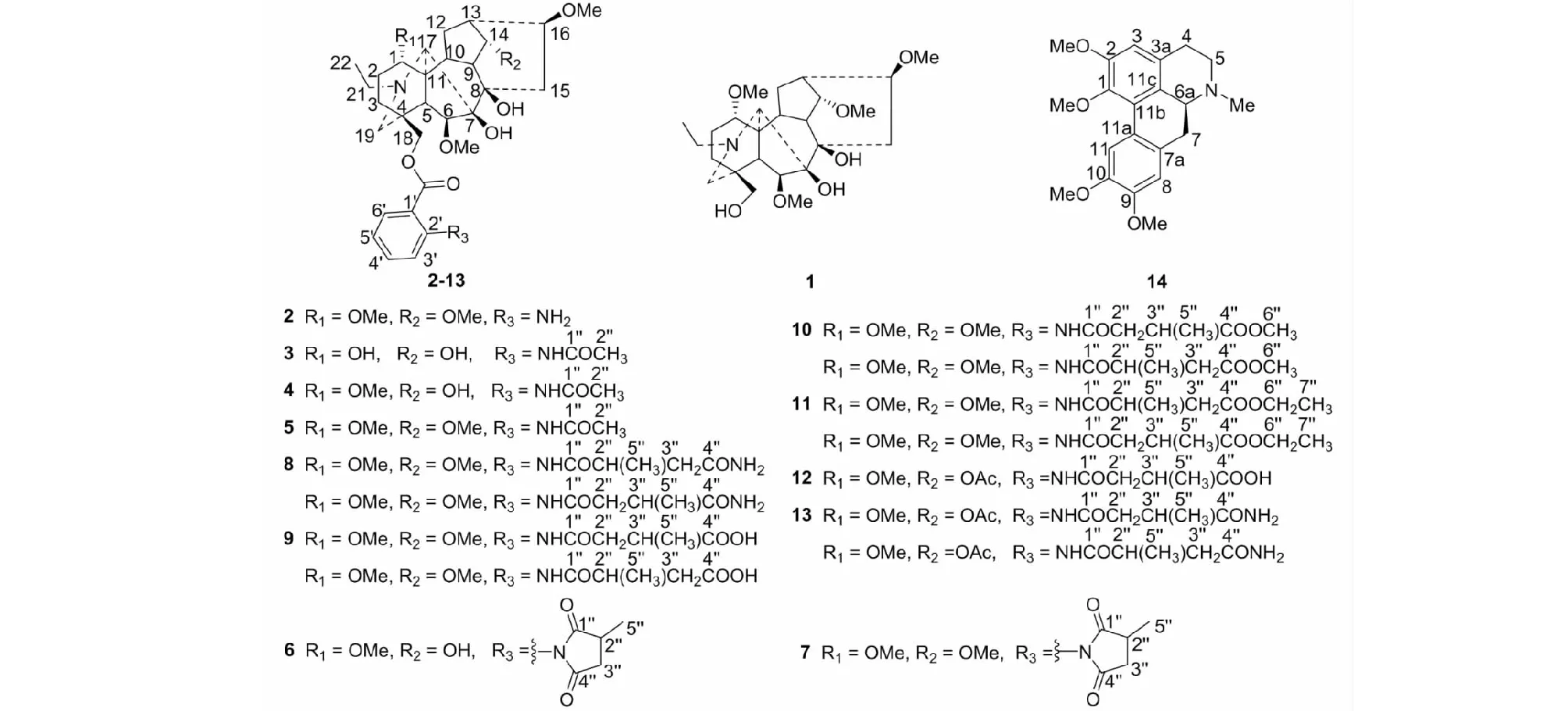
图1 化合物1~14的化学结构Fig.1 The chemical structures of compounds 1-14
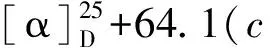

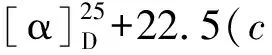


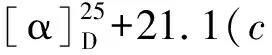
化合物8白色无定形粉末,碘化铋钾溶液呈阳性反应;HR-ESI-MS:m/z700.381 8 [M+H]+(calcd for C37H54N3O10,700.380 9),分子式C37H53N3O10。1H NMR(400 MHz,CDCl3)δ:11.05/11.15(1H,br s,NH),7.09~8.68(4H,m,Ar-H),3.59(1H,t,J=4.8Hz,Hβ-14),3.38,3.36,3.32,3.24(各3H,s,4×OMe),1.04(3H,t,J=7.2Hz,N-CH2CH3);13C NMR(100 MHz,CDCl3)δ:84.0(d,C-1),26.1(t,C-2),32.3(t,C-3),37.6(s,C-4),43.3(d,C-5),91.0(d,C-6),88.6(s,C-7),77.6(s,C-8),50.5(d,C-9),38.1(d,C-10),49.1(s,C-11),28.7(t,C-12),46.1(d,C-13),84.0(d,C-14),33.7(t,C-15),82.6(d,C-16),64.6(d,C-17),69.9(t,C-18),52.4(t,C-19),51.1(t,C-21),14.2/14.3(q,C-22),55.9(q,1-OCH3),57.9(q,6-OCH3),58.2(q,14-OCH3),56.4(q,16-OCH3),168.0(s,OCOAr),115.0(s,C-1′),141.8(s,C-2′),120.8(d,C-3′),134.9(d,C-4′),122.8(d,C-5′),130.4(d,C-6′),173.9/170.7(s,C-1′′),39.5/42.0(d/t,C-2′′),39.2/36.5(t/d,C-3′′),174.8/178.1(s,C-4′′),18.2/17.8(q,C-5′′)。以上数据与文献报道[21, 22]基本一致,故鉴定化合物8为一对区域异构体,德尔色明A和B。
化合物9白色无定形粉末,碘化铋钾溶液呈阳性反应;HR-ESI-MS:m/z701.365 8 [M+H]+(calcd for C37H53N2O11,701.364 9),分子式C37H52N2O11。1H NMR(400 MHz,CDCl3)δ:10.97/11.05(1H,br s,NH),7.06~8.73(4H,m,Ar-H),3.38,3.34,3.32,3.23(各3H,s,4×OCH3),1.04(3H,t,J=7.2 Hz,N-CH2CH3);13C NMR(100 MHz,CDCl3)δ:83.9(d,C-1),26.2(t,C-2),32.3(t,C-3),37.6(s,C-4),43.3(d,C-5),91.0(d,C-6),88.6(s,C-7),76.6(s,C-8),50.5(d,C-9),38.2/37.9(d,C-10),49.1(s,C-11),28.7(t,C-12),46.2(d,C-13),84.0(d,C-14),33.8(t,C-15),82.6(d,C-16),64.6(d,C-17),69.5/69.8(t,C-18),52.4/53.5(t,C-19),51.1(t,C-21),14.2(q,C-22),55.9(q,1-OCH3),57.9(q,6-OCH3),58.1(q,14-OCH3),56.4(q,16-OCH3),168.0/167.9(s,OCOAr),114.6(s,C-1′),142.0/142.3(s,C-2′),120.5(d,C-3′),134.9(d,C-4′),122.4/122.3(d,C-5′),130.4(d,C-6′),171.8(s,C-1′′),42.0/38.6(t/d,C-2′′),37.9/41.4(d/t,C-3′′),177.8/176.0(s,C-4′′),18.1/18.2(q,C-5′′)。以上数据与文献报道[21]基本一致,故鉴定化合物9为一对区域异构体,delavaine A free acid和delavaine B free acid。
化合物10白色无定形粉末,碘化铋钾溶液呈阳性反应;HR-ESI-MS:m/z715.378 7 [M+H]+(calcd for C38H55N2O11,715.380 6),分子式C38H54N2O11。1H NMR(400 MHz,CDCl3)δ:11.15/11.03(1H,br s,NH),7.09~8.69(4H,m,Ar-H),3.39,3.37,3.33,3.25(各3H,s,4×OCH3),1.05(3H,t,J=7.2 Hz,N-CH2CH3);13C NMR(100 MHz,CDCl3)δ:84.0(d,C-1),26.2(t,C-2),32.3(t,C-3),37.6(s,C-4),43.3(d,C-5),91.0(d,C-6),88.6(s,C-7),77.6(s,C-8),50.5(d,C-9),38.2(d,C-10),49.2(s,C-11),28.8(t,C-12),46.2(d,C-13),84.0(d,C-14),33.8(t,C-15),82.6(d,C-16),64.6(d,C-17),69.8(t,C-18),52.5(t,C-19),51.1(t,C-21),14.2(q,C-22),55.9(q,1-OCH3),57.9(q,6-OCH3),58.2(q,14-OCH3),56.4(q,16-OCH3),168.1(s,OCOAr),114.8/114.7(s,C-1′),142.0/141.7(s,C-2′),120.8(d,C-3′),135.0(d,C-4′),122.6(d,C-5′),130.4(d,C-6′),172.6/170.0(s,C-1′′),41.5/39.1(t/d,C-2′′),39.1/37.6(d/t,C-3′′),174.2/176.1(s,C-4′′),18.0/17.2(q,5′′),51.8/52.1(q,C-6′′)。以上数据与文献报道[23]基本一致,故鉴定化合物10为一对区域异构体,德拉瓦印A和B。
化合物11白色无定形粉末,碘化铋钾溶液呈阳性反应;HR-ESI-MS:m/z729.397 8 [M+H]+(calcd for C39H57N2O11,729.396 2),分子式C39H56N2O11。1H NMR(400 MHz,CDCl3)δ:11.14/11.02(1H,br s,NH),7.08~8.70(4H,m,Ar-H),3.39,3.36,3.32,3.24(各3H,s,4×OCH3),1.05(3H,t,J=7.2 Hz,N-CH2CH3);13C NMR(100 MHz,CDCl3)δ:82.7(d,C-1),26.2(t,C-2),32.3(t,C-3),37.7(s,C-4),43.4(d,C-5),91.1(d,C-6),88.6(s,C-7),77.6(s,C-8),50.6(d,C-9),38.2(d,C-10),49.2(s,C-11),28.8(t,C-12),46.2(d,C-13),84.0(d,C-14),33.8(t,C-15),82.7(d,C-16),64.6(d,C-17),69.9/69.8(t,C-18),52.5(t,C-19),51.1(t,C-21),14.1(q,C-22),55.9(q,1-OCH3),57.9(q,6-OCH3),58.2(q,14-OCH3),56.4(q,16-OCH3),168.1(s,OCOAr),114.8(s,C-1′),141.8/142.0(s,C-2′),120.8(d,C-3′),135.0(d,C-4′),122.6(d,C-5′),130.4(d,C-6′),172.1/170.1(s,C-1′′),39.2/41.6(d/t,C-2′′),38.0/36.1(t/d,C-3′′),174.3/175.6(s,C-4′′),18.0/17.2(q,5′′),60.7(t,C-6′′),14.2(q,C-7′′)。以上数据与文献报道[24]基本一致,故鉴定化合物11为一对区域异构体,拉翠碱A和B。
化合物12白色无定形粉末,碘化铋钾溶液呈阳性反应;HR-ESI-MS:m/z729.359 1 [M+H]+(calcd for C38H53N2O12,729.359 9),分子式C38H52N2O12。1H NMR(400 MHz,CDCl3)δ:11.05(1H,br s,NH),7.09~8.68(4H,m,Ar-H),3.41,3.36,3.23(各3H,s,3×OCH3),1.06(3H,t,J=7.2 Hz,N-CH2CH3);13C NMR(100 MHz,CDCl3)δ:83.8(d,C-1),25.9(t,C-2),32.0(t,C-3),37.7(s,C-4),50.2(d,C-5),90.8(d,C-6),88.5(s,C-7),77.3(s,C-8),43.6(d,C-9),45.7(d,C-10),49.0(s,C-11),28.2(t,C-12),37.9(d,C-13),74.8(d,C-14),33.1(t,C-15),83.3(d,C-16),64.6(d,C-17),69.8(t,C-18),52.5(t,C-19),51.1(t,C-21),14.1(q,C-22),55.9(q,1-OCH3),58.3(q,6-OCH3),57.9(q,16-OCH3),168.1(s,OCOAr),114.8(s,C-1′),141.6(s,C-2′),120.8(d,C-3′),135.0(d,C-4′),122.8(d,C-5′),130.4(d,C-6′),170.4(s,C-1′′),41.3(t,C-2′′),36.0(d,C-3′′),179.8(s,C-4′′),17.1(q,C-5′′)。以上数据与文献报道[25]基本一致,故确定该化合物为umbrosumine C。
化合物13白色无定形粉末,碘化铋钾溶液呈阳性反应;HR-ESI-MS:m/z728.375 8 [M+H]+(calcd for C38H54N3O11,728.375 8),分子式C38H53N3O11。1H NMR(600 MHz,CDCl3)δ:11.18/11.07(1H,br s,NH),7.12~8.70(4H,m,Ar-H),3.43,3.38,3.25(各3H,s,3×OCH3),1.07(3H,t,J=7.2 Hz,N-CH2CH3);13C NMR(150 MHz,CDCl3)δ:84.0(d,C-1),26.1(t,C-2),31.6(t,C-3),37.8(s,C-4),50.5(d,C-5),91.0(d,C-6),88.7(s,C-7),77.4(s,C-8),43.7(d,C-9),45.9(d,C-10),49.1(s,C-11),28.2(t,C-12),37.9(d,C-13),74.8(d,C-14),33.2(t,C-15),83.4(d,C-16),64.6(d,C-17),70.0(t,C-18),52.5(t,C-19),51.2(t,C-21),14.2(q,C-22),55.9(q,1-OCH3),58.3(q,6-OCH3),57.9(q,16-OCH3),170.9(s,14-OCOCH3),168.1(s,OCOAr),115.1(s,C-1′),141.8(s,C-2′),120.8(d,C-3′),135.0(d,C-4′),122.8(d,C-5′),130.5(d,C-6′),174.8(s,C-1′′),42.1/39.6(t/d,C-2′′),36.5/39.3(d/t,C-3′′),177.8/173.7(s,C-4′′),17.9/18.4(q,C-5′′)。以上数据与文献报道[26]基本一致,故鉴定化合物13为一对区域异构体,umbrosumines A和B。
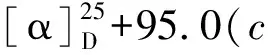
2.2 结构鉴定分析
经结构鉴定,确定以上化合物8、9、10、11、13均为一对区域异构二萜生物碱的混合物,二者碳谱十分相似,主要区别在于苯环侧链的甲基连接位置不同,分别连接在C-2′′和C-3′′位,进而导致C-2′′和C-3′′位的化学位移及峰型发生了变化,两者峰型相反。化合物8中区域异构体的比例可由氢谱11 ppm处NH的积分比例呈现,其比例为3∶1,由于甲基(C-5′′)连接位置的变化[CH3(C-2′′→C-3′′)],导致化合物8中区域异构体的C-2′′、C-3′′的峰型截然相反,由此确定化合物8为一对区域异构二萜生物碱的混合物。同理,确定化合物9、10、11、13也均为一对区域异构二萜生物碱,其比例分别为1.7∶1、1.2∶1、1.6∶1及1.3∶1。
2.3 活性测试结果
化合物浓度在40 μmol/L时,测试了化合物(3~8、10~13)对脂多糖诱导小鼠RAW 264.7巨噬细胞产生NO的抑制作用,以及化合物(1~14)对小鼠乳腺癌4T1细胞的抗肿瘤作用,结果显示所有测试化合物均无明显抗炎及抗肿瘤活性。
3 结论
本研究对阴地翠雀花全草进行了生物碱成分的研究,共分离得到14个生物碱,其中包括13个牛扁碱型C19-二萜生物碱,1个异喹啉类生物碱,化合物1~14均为首次从该植物中分离得到。本研究补充了阴地翠雀花的研究空白,为其植物化学分类提供了参考依据,为后续寻找活性生物碱成分提供了物质基础。测试了化合物对小鼠RAW 264.7巨噬细胞的抗炎作用,以及对小鼠乳腺癌4T1细胞的抗肿瘤作用,结果表明所有测试化合物均无明显抗炎及抗肿瘤活性。
