甲状腺癌热消融治疗指南及研究进展
2022-08-01陈延玮陈宝定赵双双张政杨海珍
陈延玮,陈宝定,赵双双,张政,杨海珍
(江苏大学附属医院超声医学科,江苏 镇江 212001)
长期以来,传统的甲状腺切除术一直被认为是甲状腺癌的临床一线治疗方法。然而,患者术后难免会留下颈部瘢痕影响美观,并且终身服药也在一定程度上影响了患者的生活质量[1]。如今,甲状腺结节热消融术(thermal ablation,TA)作为一种安全、易行的微创手术方法正在全球范围内广泛应用,成为继传统开放式手术、内镜下切除术、131I消融术以及乙醇消融术后的新一代甲状腺结节治疗方式[2]。
目前,临床上常用的甲状腺结节热消融技术包括射频消融(radiofrequency ablation,RFA)、微波消融(microwave ablation,MWA)和激光消融(laser ablation,LA)。Beer等[3]早在1910年就曾报道经膀胱镜下采用射频消融方式治疗一例膀胱肿瘤患者,但直到2000年才开始在甲状腺组织中进行热消融试验,并于两年后陆续尝试将其应用于甲状腺结节的治疗中,随后逐渐在临床上推广应用。甲状腺结节热消融术凭借其操作简便、安全有效、手术时间短以及并发症少等优势,现已常规应用于部分良性甲状腺结节的治疗中,在术后的短期和长期随访中均显示出良好的治疗效果,并显著改善了伴有食道气管受压、局部疼痛以及吞咽困难患者的严重压迫症状[4-5]。甲状腺癌(thyroid carcinoma,TC)约占全部甲状腺肿瘤的7%~15%,随着高分辨率超声仪的普及、分子标志物检测的开展,甲状腺癌的检出率逐年升高,热消融术也随之被用于部分甲状腺癌的治疗中[6]。但相较于良性甲状腺结节,恶性结节的热消融有着严格的适应证,谨慎的患者筛选和术前评估尤为重要,例如在术前常规检查基础上还需要获得无甲状腺包膜外侵犯、淋巴结转移等影像和病理学上的证据。近年来,部分研究已经证实了热消融术在对不适合手术且并发症发生率极低的甲状腺微小乳头状癌(papillary thyroid microcarcinoma,PTMC)和低危的甲状腺乳头状癌(papillary thyroid carcinoma,PTC)治疗中的有效性和安全性[7],但由于缺乏高质量的证据和长期的随访研究,其在临床上广泛应用还面临着一定的挑战。
2018年,韩国甲状腺放射学会发布了国际上首个甲状腺癌射频消融指南,随后欧洲、美洲等地的相关协会也相继推出了各自的标准。近些年,中国医师协会和中国肿瘤协会根据目前国内甲状腺癌热消融治疗发展情况牵头制定了相关指南,旨在提高我国甲状腺癌热消融的诊治水平。
本文将从甲状腺癌热消融的适应证、禁忌证、设备技术、术后疗效和并发症等方面,系统阐述甲状腺癌热消融相关指南,总结甲状腺癌热消融的临床治疗最新进展。旨在为临床医生更好地把握各指南相关要点,为推动甲状腺癌热消融治疗的规范化发展提供一定的参考。
1 甲状腺结节热消融术
热消融技术是一种局部热疗方式,通过在靶组织内短暂地升高温度(通常在50 ℃~80 ℃ )来实现肿瘤灭活[8],其产生的热能导致结节发生凝固性坏死,凝固的坏死组织细胞被水解酶溶解液化,再由淋巴细胞和血管吸收,表现为消融区域逐渐减小,甚至完全消失。各种消融方式具有其鲜明的特点,例如虽然MWA加热更加快速高效,有着持续的组织高温、更短的手术时长,适合大体积肿瘤的消融,但其天线容易过热,需要冷却机制来保护沿线的表面结构,设备较为笨重[9];尽管RFA加热范围通常在电极周围的几毫米内,对周围正常组织的影响较小,然而其受到血流冷却效应的影响较为明显,对靠近血管的肿瘤效果欠佳;虽然LA消融区域更加精准可控、误差小,对病变周围正常结构几乎无损伤,然而紧邻激光纤维的组织容易发生炭化,严重限制了光的穿透。但可以明确的是,相比传统手术治疗方法,热消融术的侵入性更小,感染风险更低,恢复时间更短,引起的并发症更少。
2 甲状腺癌热消融指南解读
由于甲状腺癌热消融目前尚属临床研究阶段,缺乏大样本量的长期随访研究,迄今为止尚未形成统一的标准。近些年国内外各甲状腺协会和该领域的专家学者在多年的临床实践中总结出一些经验,编写成指南以供临床医生参考。目前国内外较为权威的甲状腺癌热消融相关指南包括韩国甲状腺放射学会(Korean Society of Thyroid Radiology,KSTR)发表的《2017甲状腺射频消融指南》,欧洲甲状腺协会(European Thyroid Association,ETA)、欧洲心血管和介入放射学会(Cardiovascular and Interventional Radiological Society of Europe,CIRSE)发布的《甲状腺恶性病变微创治疗的临床实践指南》,美国头颈学会(American Head and Neck Society,AHNS)、英国内分泌和甲状腺外科医师协会(British Association of Endocrine and Thyroid Surgeons,BAETS)等多组织联合编写的《射频消融及相关超声引导消融技术治疗良恶性甲状腺疾病》国际多学科共识声明,中国医师协会甲状腺肿瘤消融治疗技术专家组制定的《甲状腺良性结节、微小癌及颈部转移性淋巴结热消融治疗专家共识(2018版)》以及由中国医师协会超声分会牵头编写的《甲状腺微小乳头状癌热消融诊疗指征专家共识》[10-14]。本节主要阐述当今国内外指南对于热消融术应用于各类甲状腺癌时在适应证、禁忌证等方面的观点,旨在指导临床医生准确把握热消融的适用范围及预后情况,为患者制定个体化的消融方案。
2.1 复发性甲状腺癌
复发性甲状腺癌一般好发于手术后的甲状腺区和颈部淋巴结处,可导致吞咽呼吸困难和声音嘶哑等临床症状。由于术后解剖结构变形以及瘢痕组织引起的纤维化,同时部分高龄患者伴有严重的心脑血管疾病,其本身一般情况较差,再次手术有一定难度,发生并发症的风险较高。鉴于此,各指南推荐可以采用热消融术或姑息疗法治疗复发性甲状腺癌(表1)。其中,当其作为治疗目的时,必须在术前经过谨慎的影像学评估以确认肿瘤具备完全清除的可能性且无颈外转移病灶。研究表明,当复发性肿瘤的数量小于3~4个且肿瘤的最大直径小于1.5~2.0 cm时,术后疗效较好。同时,当认为行热消融治疗后能够减轻患者症状和改善患者生活质量时,即使无法完全清除病灶,也可以酌情选择。相关研究已证实热消融术通常可以成功治疗复发性甲状腺癌且发生并发症的风险较低[15]。此外,欧洲指南也认为对于有手术风险或拒绝进一步手术的放射性碘难治性甲状腺癌颈部复发患者,热消融术可以作为外科手术的替代选择。同样地,对于伴有淋巴结广泛受累、中心位置、有放射性碘摄取证据以及临床和组织学提示具有侵袭性的复发性甲状腺癌,仅考虑热消融术用作姑息目的。多协会联合共识中则指出,在对转移性病灶行热消融之前,必须根据需要选择细针或粗针穿刺活检,用穿刺后的洗脱液检测甲状腺球蛋白以明确肿瘤性质,同时检测血清甲状腺球蛋白及其抗体水平以评估长期随访期间的疗效。中国共识则认为,对于根治性治疗后颈部淋巴结再次发生转移的、经过影像学和超声引导下细针穿刺活检证实的转移性淋巴结、经评估后认为患者不能耐受外科手术或拒绝外科手术治疗的、转移性淋巴结131I治疗无效或拒绝131I治疗的患者,在充分告知后可行热消融治疗。
在一项对肿瘤最大径<20 mm的复发性甲状腺癌患者的热消融术和手术对比研究中,27例患者接受了RFA治疗,46例则接受了手术治疗,两组的3年无复发生存率相似,分别为96.0%和92.6%,主要并发症仅发生在手术组[15]。另一项长期回顾性研究中,两组各70例局部复发性甲状腺癌患者接受了RFA或再次手术。RFA组和手术组的无复发生存率相似,6年时分别为89.4%和94.5%,治疗后血清甲状腺球蛋白水平没有显著差异,而手术组的低钙血症和总体并发症发生率显著高于RFA组(RFA组7例,手术组27例)[16]。而在Chung等[17]的一项RFA治疗复发性PTC的长期随访研究中,回顾性分析了接受RFA治疗的46例复发性PTC患者且随访时间均超过5年。结果显示行RFA治疗后肿瘤体积显著缩小,从消融前的(0.25±0.42)mL缩小至最终评估时的(0.01±0.08)mL(P<0.001),平均体积减小99.5%±2.9%。其中42个(91.3%)病灶在最后一次随访时完全消失。血清甲状腺球蛋白水平从(2.55±4.7) ng/dL降至(0.75±1.83) ng/dL(P<0.001),随访期间没有出现与RFA相关的并发症。上述研究表明,热消融术用于治疗局部复发性甲状腺癌是安全有效的。
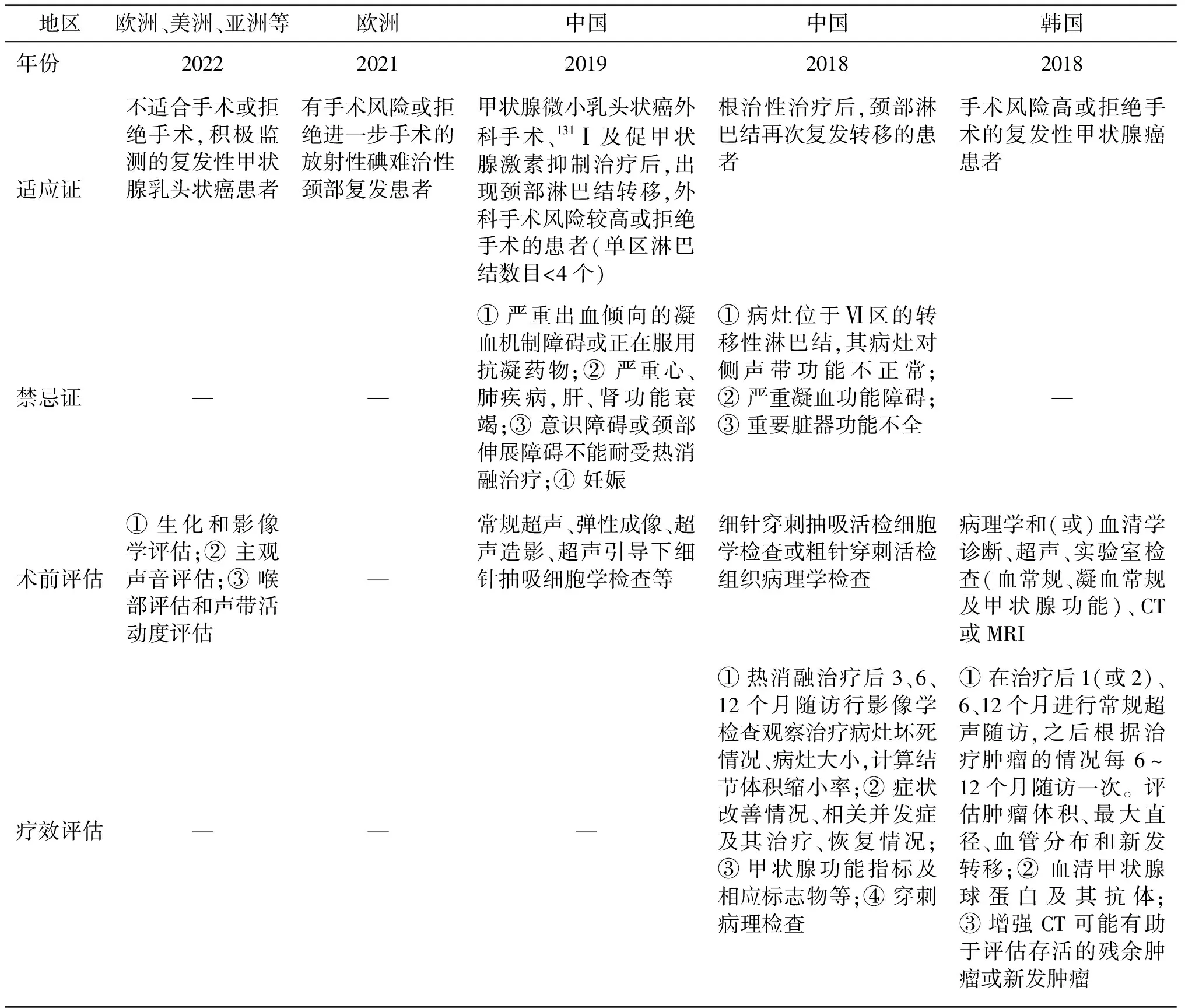
表1 甲状腺热消融指南对复发性甲状腺癌治疗的观点对比
2.2 甲状腺微小乳头状癌
甲状腺微小乳头状癌(PTMC)是指直径≤10 mm的PTC,其发病率自1980年以来在世界范围内迅速增高[18]。2015年美国甲状腺学会(American Thyroid Association, ATA)在《2015美国甲状腺学会成人甲状腺结节与分化型甲状腺癌诊治指南》中指出,PTMC侵袭性较低、预后良好,对于低危PTMC患者,可考虑积极监测而不必立即手术[19],然而部分患者对肿瘤携带状态存在不同程度的焦虑和不安,其中一些患者更愿意接受相对积极的干预措施而不仅仅是积极监测。各指南和共识一致认为手术仍是原发性甲状腺癌的首选治疗方法,故不推荐将热消融术作为PTMC治疗的常规手段,但对于拒绝手术或不能耐受手术的部分PTMC患者,在符合适应证的前提下,热消融术可作为手术的替代方案。因此,目前各种热消融方法已被引入临床实践(表2)。2019年中国《甲状腺微小乳头状癌热消融诊疗指征专家共识》中特别指出,热消融术操作简便、定位精确、安全有效,在肿瘤进展前通过热消融术灭活肿瘤以缓解患者心理压力十分必要。该共识中重点关注了PTMC热消融的适应证和禁忌证,并对术前PTMC的诊断做了详细和完整的阐述。近两年的欧洲指南和多协会联合共识中同样提及在偶然发现的低风险PTMC治疗中,对于不符合手术条件或拒绝手术的患者,热消融术可作为立即手术或积极监测的替代选择[20]。在此基础上,进一步明确了热消融术的适应证和禁忌证,联合共识指出对局限于甲状腺内的单个微小病灶,无甲状腺外侵犯或包膜侵犯的证据、细胞学证实非侵袭性亚型的PTC、无淋巴结转移证据和高风险不适合或拒绝手术的患者可以考虑行热消融治疗。欧洲指南明确了热消融术的禁忌证,认为如果细胞学上怀疑侵袭性甲状腺癌亚型(例如高细胞型、岛状和柱状细胞型),影像学检查发现存在甲状腺外侵犯或多个肿瘤病灶,存在淋巴结或远处转移以及高危分子亚型(例如存在TERT启动子或TP53突变)的患者禁止热消融治疗[21]。

表2 甲状腺热消融指南对甲状腺微小乳头状癌治疗的观点对比

续表
在Cao等[22]牵头的一项多中心回顾性研究中,725例经活检证实的PTMC患者接受了MWA或RFA治疗,消融后随访第6、12、18、24、36和48个月的肿瘤最大径和体积相较消融前显著降低,515例(71.0%)患者在超声检查中显示PTMC完全消失,19例(2.6%)患者在消融后的随访期间出现并发症。主要并发症为声音嘶哑,次要并发症为血肿形成和咳嗽,均可在数月后自行恢复。在另一项RFA与传统手术治疗的对比研究中,Zhang等[23]回顾了174例孤立性PTMC患者,其中94例患者选择RFA,80例患者选择传统手术治疗。结果显示,经过5年随访后,在评价预后情况的肿瘤复发以及淋巴结转移这两个方面,手术组和RFA组无显著差异(P=0.363,P=0.460)。与RFA组相比,手术组手术时间更长、住院时间更长、费用更高(P均<0.001)。手术组出现3例并发症,2例(2.5%)为永久性喉返神经损伤,1例(1.3%)为永久性甲状旁腺功能减退症,而RFA组则没有出现并发症(P=0.095)。关于生活质量的评分表显示,手术组治疗后患者的生活质量相较RFA组偏低。上述研究表明,对于经过谨慎评估的低风险PTMC,热消融术在术后疗效上并不亚于传统开放手术,并且对患者术后生活质量的影响更小,是PTMC患者的一种有效且安全的治疗选择。
2.3 分化型甲状腺癌远处转移
尽管大多数分化型甲状腺癌(differentiated thyroid carcinoma,DTC)预后良好,但仍然有一部分DTC表现出侵袭性,早期发生远处转移,常转移到肺、肝、骨、脑等部位,是导致DTC患者死亡的主要原因[24]。欧洲指南指出可以考虑在以下三种情况采取热消融治疗:① 用于疼痛性骨转移的姑息治疗,消融可以单独或与骨强化和体外放射治疗(external beam radiation therapy,EBRT)结合使用以改善疗效;② 考虑单独使用热消融治疗或与EBRT联合使用,以局部治愈<20 mm的骨转移;③ 考虑优先在多模态治疗背景下,热消融治疗残留的放射性碘难治性寡转移性DTC肺转移灶(<2 cm)和肝转移灶(<3 cm)。用于远处转移的热消融目的是控制寡转移或寡进展患者的局部病灶或以最小的侵入性来缓解疼痛。先前的研究已证实热消融术在转移癌治疗中的价值,例如de Baère等[25]报道了应用RFA治疗1 037例肺转移癌患者,结果显示治疗中未见严重并发症,无进展生存期和局部肿瘤进展率在1年和4年时分别为40.2%、13.1%和5.9%、11.0%。脊柱是甲状腺癌最常见的骨转移部位,严重影响患者的生活质量,多可致局部神经系统症状和病理性骨折。在一项前瞻性多中心研究中[26],骨转移患者在RFA后的第3个月随访时,患者的疼痛程度显著减轻。继发性骨折是骨肿瘤消融后最常见的主要并发症[27],因此热消融术应与骨成形术或接骨术等骨强化治疗相结合,特别是对负重骨行热消融治疗时[28]。此外,少数甲状腺癌也会发生肝脏转移。对于恶性肿瘤的肝转移病灶,热消融术有着较为满意的疗效。例如,一项对512例结直肠癌肝转移患者进行RFA的研究表明,RFA后10年时局部肿瘤无进展生存率和总生存率分别为72%和30%,15年时分别为72%和28%[29]。更主要的是,热消融术后主要并发症很少见(1%~7%)[30],并且经皮热消融安全性高,可以与其他治疗方式同时进行。综上所述,对于有手术风险且其他治疗方式无效的DTC患者可以考虑行热消融治疗。
3 甲状腺癌热消融治疗相关研究进展
除上述指南中提及的甲状腺癌热消融术适应证外,对于某些无法手术的患者,热消融也单独或联合多种治疗方式用于其他分型甲状腺癌的治疗中,例如T1b期甲状腺乳头状癌、甲状腺髓样癌和甲状腺未分化癌等。以下主要介绍热消融治疗甲状腺癌的最新研究进展,重点关注热消融对其治疗的有效性和安全性。
3.1 T1b期甲状腺乳头状癌
根据美国癌症联合委员会第八版TNM肿瘤分期系统,T1期甲状腺肿瘤(最大径≤2 cm)可分为T1a期(最大径≤1 cm)和T1b期(最大径>1 cm且≤2 cm)[31]。研究发现T1a和T1b期有着相似的预后,似乎T1a期和T1b期的区别对预后没有影响[32]。现有研究已经证实热消融治疗PTMC时在肿瘤复发以及淋巴结转移方面有着不亚于手术的效果,因此有理由认为热消融治疗低风险T1b期PTC同样会取得满意的疗效。Xiao等[33]近期报道了一项RFA与手术治疗临床孤立性T1bN0M0期PTC的对比研究,共有182例患者接受了RFA或手术治疗。结果显示在RFA组中,4例患者出现局部肿瘤进展(4.4%,3例复发和1例淋巴结转移);在手术组中,有2例患者(2.2%)发生了淋巴结转移,两组在肿瘤局部进展方面无显著差异。手术组中4例患者(4.4%)出现永久性甲状旁腺功能减退,而RFA组未观察到轻微或严重并发症。He等[34]在此基础上进一步根据年龄将T1bN0M0期PTC患者分为两个亚组来研究年龄对预后的影响。结果中<45岁患者与≥45岁患者的亚组分析显示,不同治疗组内或不同治疗组之间的肿瘤进展和并发症发生率没有显著差异。综上,现有研究表明热消融治疗T1bN0M0期PTC是可行、有效且安全的,因此可以考虑在不适合或拒绝手术的患者中行热消融术以替代手术治疗。
3.2 甲状腺髓样癌
甲状腺髓样癌(medullary thyroid carcinoma,MTC)起源于甲状腺滤泡旁C细胞,占所有甲状腺癌的1%~3%,发病年龄通常在40~60岁[35]。通常,肿瘤伴有血清降钙素水平升高,大约50%可触及MTC局部淋巴结转移。手术仍然是MTC的标准治疗方法,但对于无法接受手术的MTC患者,热消融术也可作为手术的替代方法。2019年Biamonte等[36]报道了一例经皮超声引导射频消融治疗MTC患者,由于该老年女性患者伴有多种并发症且麻醉风险高,患者拒绝手术并选择RFA作为替代治疗方法。排除了嗜铬细胞瘤的可能性后,在超声实时引导下采用30 W功率进行射频消融。术后甲状腺功能正常(TSH=2.71 mU/L,正常值为0.25~4.20 mU/L),第一次随访时发现的亚临床甲状腺功能减退症在后期的随访中自行恢复。RFA后每3个月测量血清降钙素水平和癌胚抗原,并在第1、6和12个月时进行甲状腺超声检查。结果显示在前6个月内血清降钙素水平降至15 pg/mL,之后缓慢增加,在第15个月的随访时达到49 pg/mL。同样,癌胚抗原水平呈上升趋势,12个月时为4.3 ng/mL,15个月时为5.5 ng/mL(正常值<10 ng/mL)。在超声评估中,由于最初肿瘤内部发生纤维化,结节的回声略有增加,彩色多普勒血流显像未见血流信号,超声造影未见增强。以上研究表明RFA对无法接受手术的MTC患者是一种安全有效的治疗措施。需要注意在随访期间血清降钙素降低但未正常化,表明MTC可能无法治愈,存在发生淋巴结转移的风险[37]。因此,原发性MTC患者行热消融治疗后需要进行严格的超声检查和生化指标随访,以早期发现MTC的复发或转移。
3.3 甲状腺未分化癌
甲状腺未分化癌(anaplastic thyroid carcinoma,ATC)是一种罕见的高度恶性肿瘤。ATC起病突然、早期诊断困难、进展迅速,多数病例发现时就已经发生广泛周围侵犯和远处转移,5年生存率低于5%。迄今为止尚没有针对ATC的标准治疗方案,常规治疗以外科切除结合放疗为主,辅以化疗、免疫、分子靶向及姑息治疗等[38]。相关文献报道了热消融对某些ATC治疗的可行性。Jeong等[39]对2例无法接受手术的ATC患者行RFA治疗,在术后10 d的随访期内未见颈部肿块体积缩小或症状改善,2例患者相继于RAF后3个月内死亡。Cakir等[40]报道了一例85岁高龄ATC患者行RFA治疗,术中采用5 W消融功率对病灶持续消融300 s,术中无相关并发症,术后患者呼吸困难症状有所减轻,2周后死于下肢深静脉血栓引起的肺栓塞。综上,热消融治疗对ATC引起的压迫症状有轻微的短期影响,但尚无研究证实其能够显著缩小病灶体积或延长患者生存期,这可能与ATC的快速生长及早期转移密切相关。因此,热消融术在ATC中的应用有待商榷,无其他治疗手段的患者才应考虑热消融姑息治疗。
4 总结
过去几十年,全球范围内甲状腺癌的患病率和检出率逐年增加,尽管其中许多病例侵袭性很低、生长非常缓慢,但迄今为止,传统的甲状腺叶切除术和颈部中央区淋巴结清扫术仍然是初诊甲状腺癌患者的主要治疗手段[41]。虽然手术方式不断改良,但仍有不同程度的术后并发症发生[2]。
随着医疗技术水平的提高和社会经济的发展,在如今的诊疗过程中,患者不仅仅满足于疾病的治疗效果,还抱有对美观度的期待,更注重诊疗过程中的体验以及治疗后的恢复过程。目前,热消融术作为一种微创治疗方案,因其诊疗体验更佳、诊疗风险更低从而更容易被患者接受。热消融术最初应用于良性肿瘤的临床实践[42],为了扩大其适应证,近年对其应用于复发性甲状腺癌和原发性低风险PTC的理论和实验研究层出不穷,并取得了令人满意的疗效。在某些情况下,同样可以考虑使用热消融术对晚期甲状腺癌行减瘤治疗,以达到姑息治疗的目的。相较传统的外科手术,热消融术具有诸多优势,比如治疗过程中不需要全身麻醉、术后甲状腺和甲状旁腺功能减退的风险可以忽略不计以及无颈部瘢痕等[43],暂时或永久性的声带损伤风险也明显低于传统手术;而与积极监测(例如仅通过定期超声检查等方式动态观察病灶进展状态)相比,热消融则能够在一定程度上帮助患者应对确诊癌症后带来的心理压力。与此同时,应当注意的是,严格把握适应证、术前准确评估、术中规范操作以及术后密切随访在甲状腺癌热消融治疗中尤为关键。总体而言,初步临床研究已经证明热消融术是治疗某些甲状腺癌的可行、安全的手术替代方案并且正在逐步改变部分甲状腺癌患者的管理方式,但目前仍有许多研究空白需要填补,还需要进行多中心临床试验以及更长期的随访作进一步研究探索。
