早期胃食管结合部癌行内镜黏膜下剥离术后非治愈切除的危险因素分析
2022-08-01黄小杰林晓露梁玮林瀛程辉杨士杰林海宁郑炜平邓万银
黄小杰,林晓露,梁玮,林瀛,程辉,杨士杰,林海宁,郑炜平,邓万银
(1. 福建中医药大学中西医结合学院,福建 福州 350122; 2. 福建省立医院消化内镜中心,福建 福州 350001)
胃食管结合部(gastroesophageal junction,GEJ)癌指GEJ上下5 cm以内的肿瘤[1]。既往GEJ癌在我国和日本等发病率较低,但随着幽门螺杆菌感染率的下降,GEJ癌发病率较过去40年增加了2.5倍,并呈逐年上升的趋势[2]。内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)是早期胃癌的首选治疗方式,其提高了早期胃癌患者治愈性切除率,并使治愈性切除在特殊部位(如GEJ)的肿瘤成为可能[3]。与早期胃癌相比,ESD治疗早期GEJ癌的治愈性切除率低、手术时间较长、手术难度较大[4]。为了减少不必要的内镜下治疗,在选择治疗方案之前需要评估非治愈性切除的可能。目前关于早期GEJ癌非治愈性切除的危险因素尚不清楚,因此,本研究旨在评估与ESD术后产生非治愈性切除的相关的预测因素。
1 对象与方法
1.1 病例资料
选择2016年10月至2020年9月于福建省立医院消化内镜中心行胃镜检查时检出的早期GEJ癌患者114例,均行ESD术。其中,男93例,女21例,平均年龄(63.1±7.6)岁。
纳入标准:年龄≥18岁;GEJ上方5 cm和下方5 cm以内的肿瘤;病理提示腺癌、高级别上皮内瘤变;有完整的临床资料。排除标准:超声内镜或CT显示肿瘤进展或可疑转移;多发原位癌;残胃癌;病理类型为鳞癌、低级别上皮内瘤变。本研究方案获得我院伦理委员会批准。
1.2 数据收集
收集患者性别、年龄、肿瘤直径、肿瘤形态、病理类型、浸润深度以及是否合并溃疡,是否脉管浸润,是否治愈性切除,是否追加手术治疗等。所有胃镜图片均由1名10年以上经验丰富的内镜医师进行评估,评估内容包括:肿瘤直径,参照胃镜先端部直径目测计算;Paris分型[5],分为隆起型病变(0-Ⅰ)、平坦型病变(0-Ⅱ)和凹陷型病变(0-Ⅲ);周边黏膜炎症状态;是否存在溃疡或者溃疡后疤痕;是否存在黏膜下纤维化及纤维化程度;是否并发深在性囊性胃炎。具体示例如图1所示。
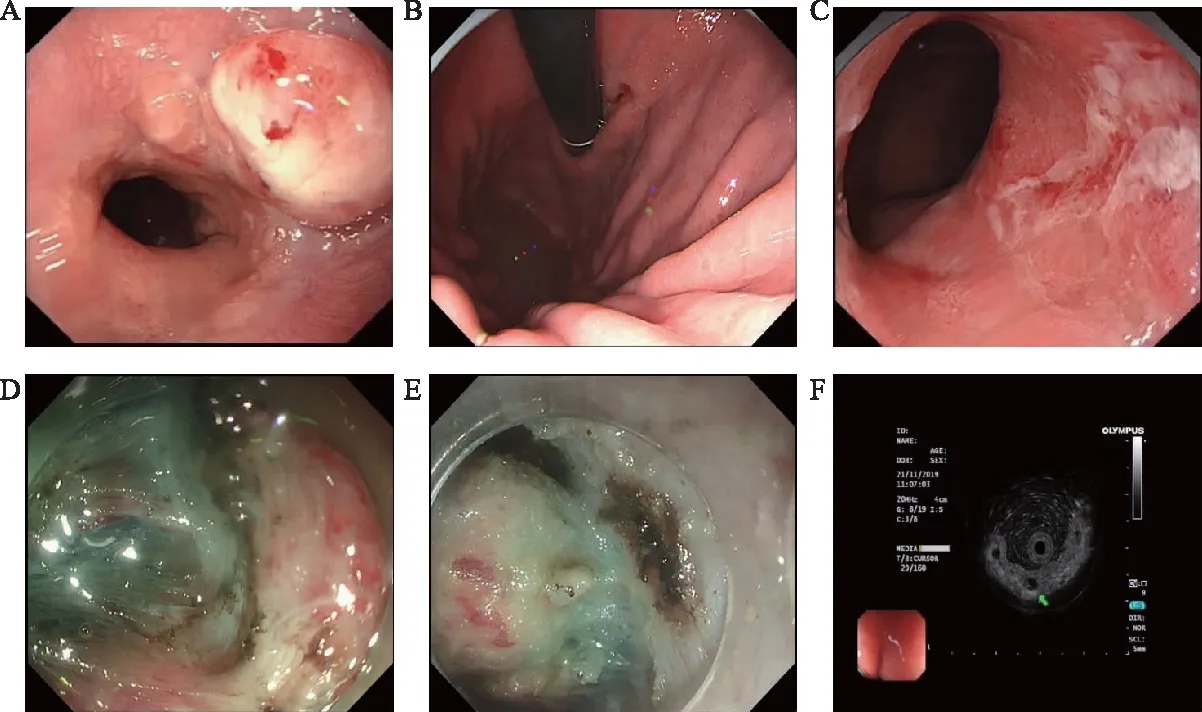
A:隆起型(0-Ⅰ)GEJ癌;B:背景黏膜炎症状态;C:贲门一浅凹溃疡,底覆白苔;D:轻度纤维化,在蓝色的黏膜下层中出现白色的网状结构;E:重度纤维化,黏膜下层与白色的固有肌层分界不清;F:超声胃镜提示合并深在性囊性病变
1.3 ESD手术方案及病理取材
操作均由具备10年以上ESD手术经验的医师完成,所有患者均予全麻下行ESD,氩气刀予病灶周围标记(术前据白光内镜和窄带成像放大内镜明确分界线),黏膜下注射使病灶隆起,环状切开黏膜,行病灶黏膜下剥离,最后创面预防电凝止血。
1.4 样本处理和诊断
所有ESD术后标本间隔2 mm取材,所有病理切片均由本院1位10年以上经验丰富的病理科主任医师对其组织类型、浸润深度、水平切缘、垂直切缘和淋巴血管侵犯等进行评估诊断。
诊断内容主要如下。早期GEJ癌:局限于黏膜层或黏膜下层,而不论有无淋巴结转移的GEJ癌。早期癌分类:未分化型包括低分化腺癌、黏液腺癌、印戒细胞癌;分化型包括中、高分化的管状腺癌、乳头状腺癌[6]。整块切除:病灶在内镜下整块切除,并获得单块标本。完全切除:水平和垂直切缘均为阴性的整块切除。治愈性切除:病灶整块切除,直径≤2 cm、垂直切缘与水平切缘阴性、无合并溃疡且无脉管浸润的分化型黏膜内癌;相对治愈性切除:病灶整块切除、垂直切缘与水平切缘阴性、无脉管浸润且满足下列条件的早期GEJ癌:直径>2 cm,无溃疡的分化型黏膜内癌;直径≤3 cm,可伴溃疡的分化型黏膜内癌;直径≤2 cm,无溃疡的未分化型黏膜内癌;直径≤3 cm,分化型浅层黏膜下癌[7];非治愈性切除:指除治愈性切除和相对治愈性切除以外的内镜下切除。
根据术后病理检查等结果将患者分为治愈性切除组和非治愈性切除组,对其性别、年龄、肿瘤直径、肿瘤形态、病理类型、浸润深度以及是否合并溃疡等进行比较。
1.5 统计学方法
2 结果
2.1 两组临床病理参数比较
114例患者,整块切除率为99.1%(113/114),完全切除率为89.5%(102/114),非治愈性切除率为17.5%(20/114)。两组在性别、年龄、病变形态、病灶位置、深在性囊性胃炎、背景炎症方面差异均无统计学意义(P均>0.05),而肿瘤直径、黏膜下浸润、溃疡、病理类型、黏膜下纤维化差异有统计学意义(P均<0.05)。见表1。
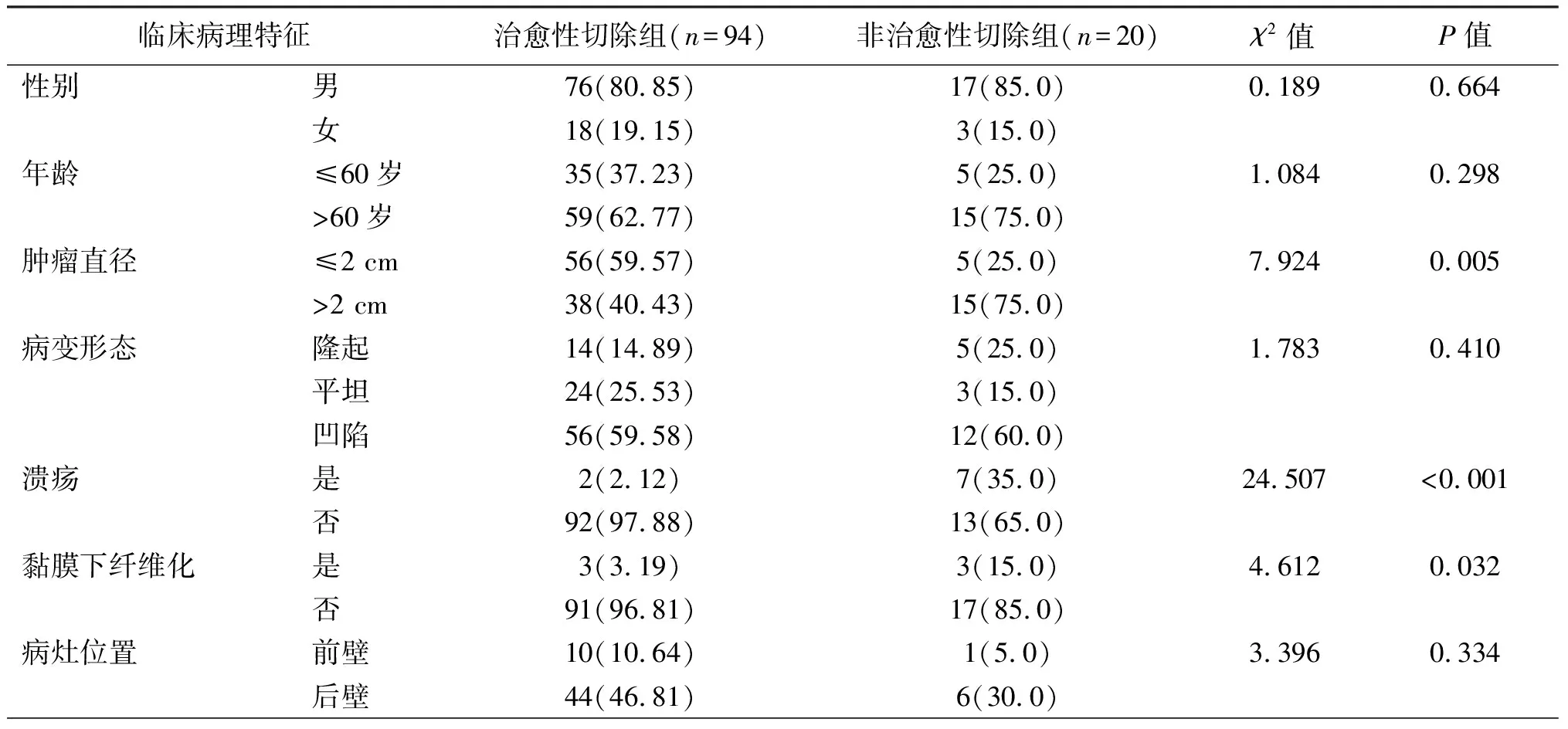
表1 内镜下治愈性切除组与非治愈性切除组临床病理特征比较 例(%)
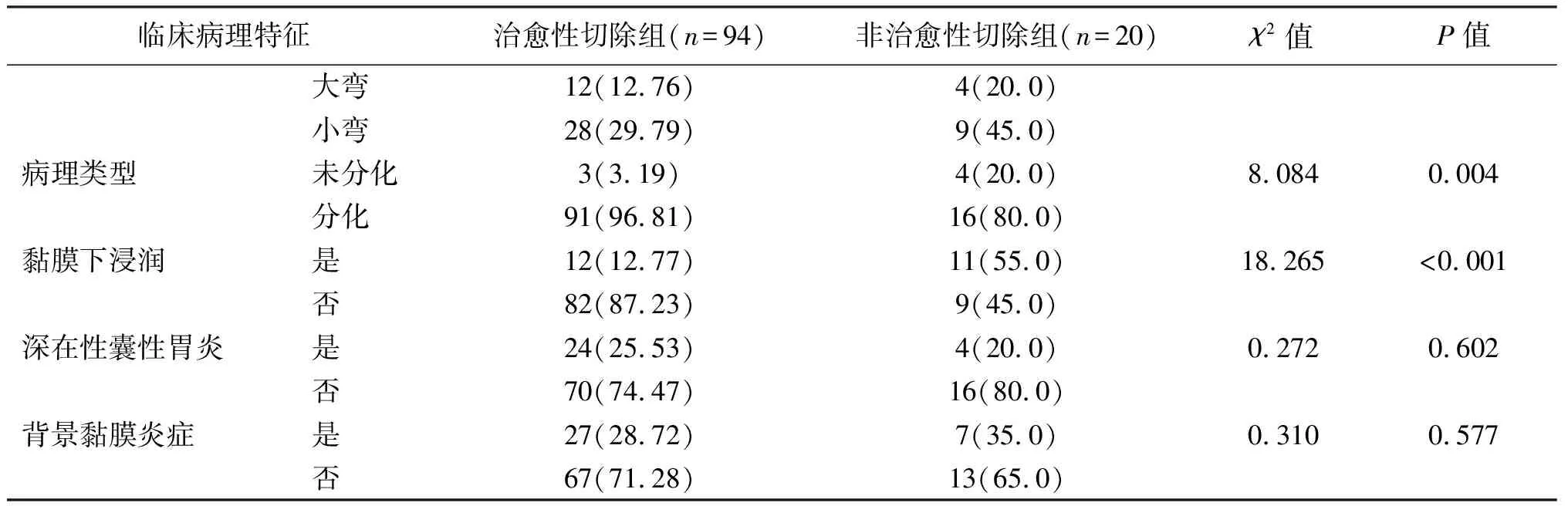
续表
2.2 内镜下非治愈性切除相关危险因素的多因素分析
将表1中有统计学差异的指标纳入Logistic回归分析,结果显示,肿瘤直径(OR=4.421,P=0.008)、黏膜下浸润(OR=8.352,P<0.001)、溃疡(OR=24.769,P<0.001)和未分化癌(OR=7.583,P=0.012)为非治愈性切除的独立危险因素。见表2。
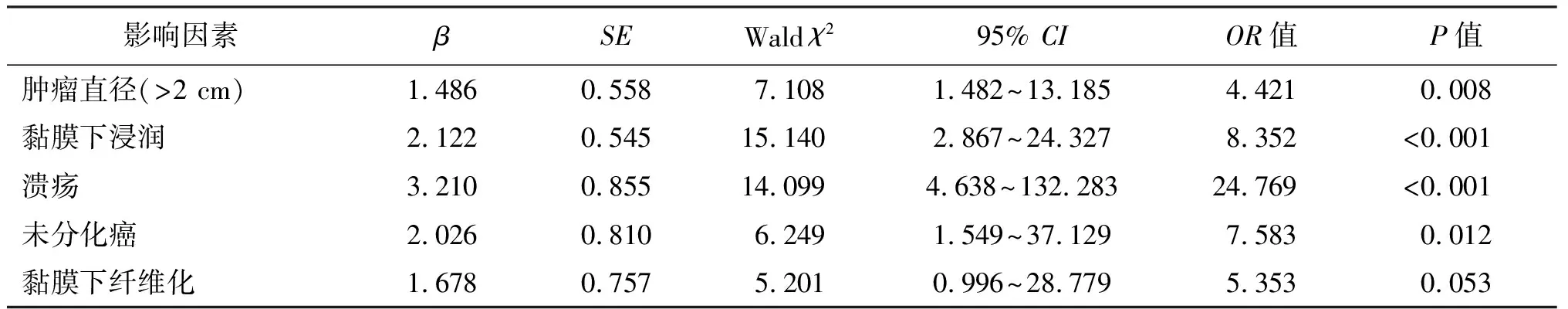
表2 非治愈性切除相关危险因素的多因素分析
2.3 危险因素数量与非治愈性切除发生率的相关性分析
独立危险因素的数量与术后非治愈性切除发生率相关(rs=0.492,P<0.01)。见表3。
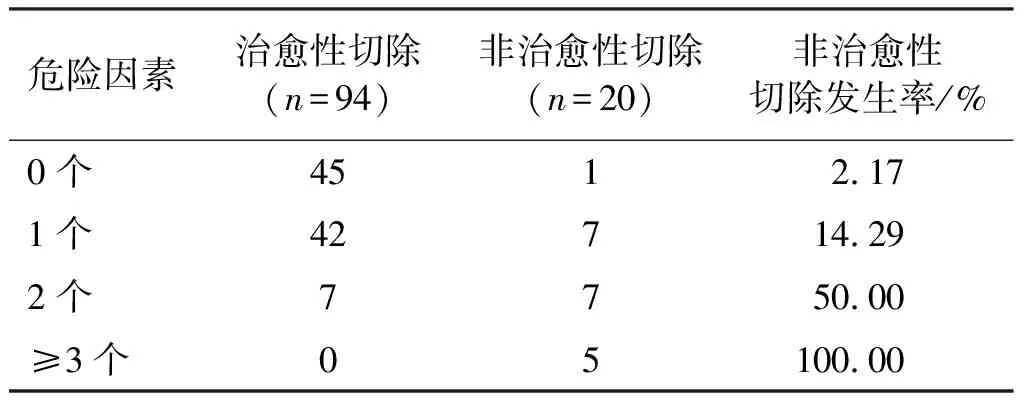
表3 非治愈性切除的影响因素
2.4 术后随访
20例非治愈性切除患者中,3例失访,平均随访时间(32.8±16.1)个月,4例为eCura C-2级,2例追加外科手术,其中1例经手术病理证实为淋巴结转移。在未追加全胃切除术的随访患者中,未发现复发病例。
3 讨论
本研究114例接受ESD治疗的早期GEJ癌患者中,非治愈性切除率为17.5%(20/114)。日本一项多中心回顾性研究结果显示,早期GEJ癌的完整切除率为82.5%(307/372)[2]。研究显示,早期GEJ癌的整块切除率为100%,非治愈性切除率为21%[8]。本研究结果与其相似。
深在性囊性胃炎是一种相对少见的疾病,其特征是胃腺增生,囊性向下生长到黏膜下层。这种情况往往可能导致内镜下的隆起表现,从而影响内镜下判断浸润深度的过估情况存在。本研究中24.6%(28/114)病例伴有黏膜下囊性病变,与非治愈性切除无明显相关(P>0.05)。研究发现,背景炎症状态是黏膜下囊性病变的独立危险因素(OR=2.683,P=0.030)[9]。所以,临床上选择是否做ESD治疗的时候应考虑是否伴发深在性囊性胃炎及周边炎症存在对判断浸润深度的影响。
肿瘤直径(>2 cm)是非治愈性切除的独立危险因素,可能与病变大操作难度大、边界定义困难等相关。Gotoda等[10]研究表明,病变大小与淋巴结转移风险相关。Jang等[11]对82例贲门(GEJ线以上1cm及GEJ线以下2 cm)早期癌患者进行回顾性分析,结果显示,病灶直径>2 cm、黏膜下层浸润导致治愈性切除率降低。本研究中浸润至黏膜下层的非治愈性切除患者共11例,可能与术中粘连及病变巢状黏膜下深层浸润等相关。研究报道,早期GEJ癌黏膜下层浸润导致淋巴结侵犯风险由2.2%上升至17.9%[10]。一项纳入44例早期GEJ癌患者的回顾性研究表明,非治愈性切除病例中未分化癌、黏膜下浸润及淋巴脉管浸润多见[12],也证实黏膜下浸润可作为独立危险因素。
本研究结果显示,溃疡是非治愈性切除的独立危险因素。研究表明,溃疡可造成黏膜下层结构不清、剥离困难及术前浸润深度判断困难,导致非完全切除[13]。未分化癌生长方式与分化癌有所不同,尤其是印戒细胞癌,容易出现淋巴结转移、腹膜转移及远处转移。因此,对于未分化癌,ESD的选择应该更加慎重及需要较大的安全侧缘。此外,本研究发现危险因素越多的患者,其ESD术后非治愈性切除的风险越高。由Hatta等[14]建立的eCura系统对早期胃癌ESD术后患者依据危险因素权重积分进行危险分层和指导术后随访和治疗,分级越高的患者非治愈性切除的风险越高,eCura C-2级患者均需进一步外科手术。本研究20例非治愈性切除患者中,4例为eCura C-2级,2例追加外科手术,其中1例经手术病理证实为淋巴结转移,显示肿瘤直径(>2 cm)、黏膜下浸润、未分化癌3个危险因素。由于本研究病例数较少,故仅研究危险因素数量与ESD术后非治愈性切除的关系,未采用eCura评分系统进一步深入分析。因此,如术前发现患者有多个危险因素,临床医师应更倾向采用外科根治术。
本研究存在的局限性主要如下:首先,本研究为回顾性、非随机且单中心,存在一定的选择偏差;其次,非治愈性切除患者平均随访时间较短,不能确定非治愈性切除拒绝外科手术患者的临床结果。
综上所述,肿瘤直径(>2 cm)、黏膜下浸润、溃疡、未分化癌是非治愈性切除的预测因素。此外,随着危险因素的增加,非治愈性ESD的风险也随之增加。对于有多个危险因素的患者,在考虑ESD之前,临床医师应该仔细选择合适的GEJ癌治疗方法。
