辅酶Q10对脓毒血症休克大鼠血管平滑肌细胞功能的影响
2022-08-01廖文筠张莹莹陈睦虎刘英刘济滔阳凤彭林尹德锋钟武
廖文筠,张莹莹,陈睦虎,刘英,刘济滔,阳凤,彭林,尹德锋,钟武
作者单位:西南医科大学附属医院,a急诊医学部,b老年医学科,四川 泸州 646000
由各种因素所致感染的脓毒血症休克死亡率在致死性疾病榜单中排前10 位[1-2]。目前对脓毒症休克病人进行补液复苏治疗,尽管血容量已经补足,甚至使用血管活性药物后病人仍然普遍出现无法解释的持续性动脉低血压[3-4]。因此,本实验大胆地假设顽固性动脉低血压发生机制可能与动脉中膜平滑肌细胞(SMC)表型转变相关,即在国内外首次提出脓毒症可致血管中膜平滑肌细胞表型改变的假设,并通过实验进行理论验证。辅酶Q10 是细胞自身产生的天然抗氧化剂和细胞代谢启动剂,具有保护和恢复生物膜结构的完整性、清除自由基功能,预防血管壁脂质过氧化等能力,已被大量研究证明具有改善线粒体氧化呼吸链功能障碍的功效[6-8]。脂多糖(LPS)导致脓毒血症休克可明显刺激SD大鼠血管平滑肌细胞产生过多的氧化应激产物,从而导致血管病理化发展。顽固性休克的病理生理特征是血管对儿茶酚胺刺激的反应受损和病理性血管舒张不受控制。收缩型平滑肌细胞是正常情况下血管壁的重要组成部分,而疾病病理血管则表现为合成型,本研究自2020 年2—8 月研究辅酶Q10 对脓毒血症中大鼠血管平滑肌细胞功能的影响,为脓毒血症休克的病理性血管形成提供理论基础。
1 材料和方法
1.1 材料 40 只健康成年SD 大鼠,雄性,平均4 月龄,体质量(200±10)g(西南医科大学动物实验室提供);DMEM/F12 培养基,特级胎牛血清,胰蛋白酶,青霉素,链霉素(美国GIBCO 公司);平滑肌肌动蛋白(α-actin)抗体,骨桥蛋白(OPN)抗体,甘油醛-3-磷酸脱氢酶(GAPDH)一抗、二抗及蛋白质印迹(Western blotting)试剂盒(Sigma 公司);丙二醛(MDA)检测试剂盒(南京建成生物制剂研究所);胆囊收缩素/缩胆囊素八肽(CCK-8)检测试剂盒(美国GLPBIO公司)。
1.2 脓毒症休克动物模型建立、VSMC 的分离、培养及鉴定 采用SD 大鼠尾静脉注射LPS 5.0 mg/kg的方法建立脓毒症休克动物模型,造模后观察大鼠的一般情况:主要包括大鼠的外观形态,精神状态,活动情况,有无出血,口唇和掌趾颜色及温度。造模成功的标准为:最初表现有竖毛,蜷缩及弓背,大鼠活动量和灵活性下降,走路无力,并发现大鼠寒战,精神倦怠,乏力的表现,逐渐出现反应迟缓,呼吸急促和口唇发绀,给予刺激时躲闪迟钝或无躲闪动作,较少有进食水者;后续观察到大鼠逐渐出现内眦和口鼻处出血伴有深慢呼吸表现,掌趾颜色苍白及触摸时发凉,给予刺激时无任何反应,并发现有昏迷状态。有休克表现后(统一12 h 后),脊椎脱臼法处死,固定于动物解剖台,迅速分离取出主动脉,采用0.2%胶原酶消化分离平滑肌细胞,自然纯化及差速贴壁纯化血管平滑肌细胞,DMEM 培养基及10%胎牛血清(FBS)培养细胞。取第4 代细胞进行免疫荧光鉴定。收集第4~6代的细胞,裂解并提取总蛋白,Western blotting 检测平滑肌特异性的α-actin和OPN的表达情况。
1.3 CCK-8 检测各实验组VSMC 增殖 将两组SMC 消化,调整细胞密度为2×108/L,接种到2 个96孔板中,每个孔板设置4个时间点,每个时间点设置5 个复孔,每孔加入100 µL 细胞悬液。在培养6、12、24、48 h 后,分别在每组每个时间点加入10 µL的细胞计数试剂盒8(cell counter kit-8,CCK-8)试剂,然后在细胞培养箱中培养1.5 h后用酶标仪检测吸光度(absorbance,A)值,检测波长为450 nm。
1.4 检测各实验组VSMC 的丙二醛MDA 浓度将两组SMC 分别培养6、12、24、48 h,从6 孔板中消化,调整细胞密度为2×108/L 后制作细胞匀浆,按MDA 试剂盒说明书操作,在532 nm 处测各管吸光度值。
1.5 蛋白质免疫印迹法检测各组VSMC 中α-actin和OPN 的表达水平 将分离后的SMC 分别接种到96 孔板中,将实验分为四组,分别为:正常对照组、正常对照组+辅酶Q10、LPS 组、LPS+辅酶Q10 组,细胞培养48 h 后,收集SMC,提取总蛋白,离心去除细胞碎片后收集上清,用BCA 法测定蛋白浓度,调节蛋白浓度,以2 g/L 的浓度进行电泳,结束后将蛋白进行转膜。在37 ℃下用封闭液封闭膜2 h,加入一抗兔抗鼠α-actin,4 ℃摇床过夜,PBST 洗膜3次。将膜用显影液显影3 min,蒸馏水冲洗终止显色。其他种类蛋白检测操作步骤一致。
1.6 统计学方法 采用SPSS 22.0 软件对实验数据进行统计,以±s 表示计量资料,两组间比较采用独立样本t 检验,多组间比较采用单因素方差分析,组间两两比较采用LSD-t 检验,以P<0.05 表示差异有统计学意义。
2 结果
2.1 细胞培养及免疫荧光鉴定 取长势良好的第4代细胞进行α-actin 免疫荧光染色,镜下可见细胞质内大量绿色阳性染色(×400)。见图1。
2.2 Western blotting 检测平滑肌肌动蛋白的表达 取第4~6代的正常对照组细胞,进行裂解并提取总蛋白,Western blotting 检测P4、P5、P6 组平滑肌细胞α-SM-actin 的相对表达量分别为1.75±0.02、1.74±0.03、1.76±0.01,结果显示VSMC特异性的肌动蛋白(α-SM-actin)均呈阳性表达,α-SM-actin 的相对表达量计算公式:α-SM-actin 的表达量/GAPDH 的表达量,且各组间比较均差异无统计学意义(F=0.65,P=0.537)。
2.3 CCK-8 检测各实验组SMCs 增殖 正常对照组SMCs 在6、12、24、48 h 的OD 值呈逐渐增加趋势,LPS 组SMCs 的OD 随时间变化而逐渐降低;正常对照组的OD值明显高于LPS组(P<0.01)。见表1。
表1 CCK-8检测两组SMCs增殖情况/±s

表1 CCK-8检测两组SMCs增殖情况/±s
组别正常对照组LPS组t值P值重复次数55 6 h 0.74±0.03 0.46±0.03 25.86<0.001 12 h 0.93±0.02 0.35±0.01 60.03<0.001 24 h 1.52±0.16 0.28±0.03 36.22<0.001 48 h 2.35±0.20 0.19±0.03 32.71<0.001
2.4 检测各实验组SMCs的MDA浓度
2.4.1 正常对照组与LPS 组SMCs 的MDA 浓度 正常对照组SMCs的MDA值随着时间增加并没有明显的改变,但是LPS 组MDA 值随着时间变化而逐渐增高,并且明显高于正常对照组(P<0.05)。见表2。
表2 两组SMCs的MDA浓度变化/(µmol/L,±s)
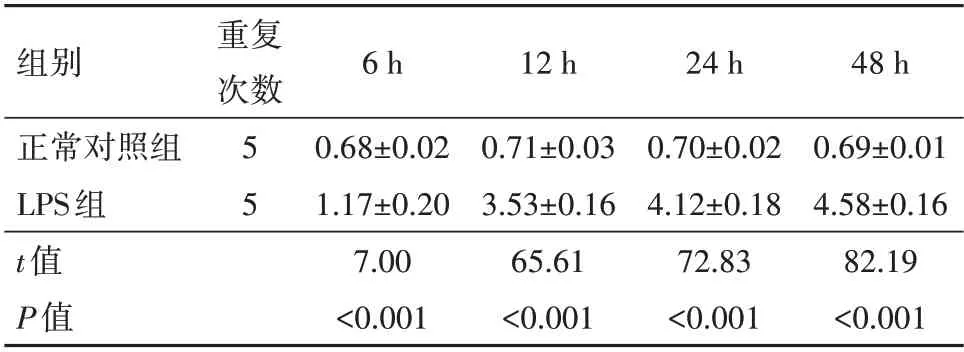
表2 两组SMCs的MDA浓度变化/(µmol/L,±s)
组别正常对照组LPS组t值P值重复次数55 6 h 0.68±0.02 1.17±0.20 7.00<0.001 12 h 0.71±0.03 3.53±0.16 65.61<0.001 24 h 0.70±0.02 4.12±0.18 72.83<0.001 48 h 0.69±0.01 4.58±0.16 82.19<0.001
2.4.2 辅酶Q10 干预下SMCs 的MDA 含量 正常对照组与正常对照组+辅酶Q10 在6、12、24、48 h 四个时间点的MDA 值比较,差异无统计学意义(P>0.05);LPS+辅酶Q10 组在四个时间点的MDA 值均较LPS组明显降低(P<0.05)。见表3。
表3 各组SMCs的MDA浓度变化/(µmol/L,±s)

表3 各组SMCs的MDA浓度变化/(µmol/L,±s)
注:①与正常对照组比较,P>0.05。②与LPS组比较,P<0.01。
组别正常对照组正常对照组+辅酶Q10 LPS LPS组+辅酶Q10组F值P值48 h 1.06±0.10 1.05±0.06①4.62±0.13 2.20±0.18②232.87<0.001重复次数5555 6 h 0.72±0.01 0.72±0.02①1.26±0.15 0.84±0.01②52.35<0.001 12 h 0.86±0.01 0.84±0.02①3.23±0.11 1.51±0.02②17.86<0.001 24 h 0.88±0.02 0.90±0.01①3.58±0.12 1.97±0.09②791.55<0.001
2.5 蛋白质免疫印迹法检测各组VSMC 中α-肌动蛋白α-SM-actin、骨桥蛋白OPN 的表达水平 正常对照组与正常对照组+辅酶Q10 在48 h 时间点的两个蛋白的相对表达量差异无统计学意义(P>0.05);而在LPS+辅酶Q10 组中α-肌动蛋白在48 h 时间点的相对表达量较LPS 组上调了1.57 倍(P<0.05);骨桥蛋白OPN 的相对表达量下调了1.17 倍(P<0.05),蛋白相对表达量计算公式:该蛋白的表达量/GAPDH的表达量。见表4,图2。
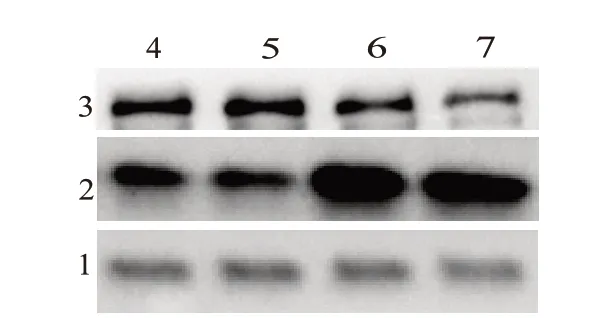
图2 蛋白质免疫印迹法检测各组VSMC中α-肌动蛋白α-SM-actin、骨桥蛋白OPN的表达水平
表4 各组平滑肌细胞α-SM-actin和OPN的相对表达量/±s

表4 各组平滑肌细胞α-SM-actin和OPN的相对表达量/±s
组别正常对照组正常对照组+辅酶Q10 t值P值LPS组LPS+辅酶Q10组t值P值重复次数3333 α-SM-actin 1.50±0.02 1.50±0.03 0.48 0.644 0.83±0.03 1.30±0.02 35.43<0.001 OPN 0.76±0.06 0.75±0.01 0.25 0.809 1.54±0.04 1.32±0.05 9.59<0.001
3 讨论
目前严重感染及其相关的感染性休克和多器官功能障碍综合征是临床上病死率居高不下的重要因素,特别高发于普外科急诊手术及ICU 病人[5]。脓毒症休克死亡率在致死性疾病榜单中排前10位。辅酶Q10 是细胞自身产生的天然抗氧化剂和细胞代谢启动剂,具有保护和恢复生物膜结构的完整性、清除自由基功能,预防血管壁脂质过氧化等能力,已被大量研究证明具有改善线粒体氧化呼吸链功能障碍的功效[6-8]。通过大量文献验证,辅酶Q10在浓度为50µmol/L时,对细胞培育时的抗氧化功效最强,故后续实验采用此浓度[9-10]。
LPS 可明显刺激SD 大鼠血管平滑肌细胞产生过多的氧化应激产物MDA,因而测试MDA 的量可反映机体脂质过氧化的程度,间接地反映出细胞损伤的程度。发生机制可能是LPS影响线粒体电子传递链,导致其内部电子发生“逃逸”,生成大量的活性氧类(ROS)。超出机体清除范围的活性氧类可使脂质过氧化,最终形成MDA,其在体外影响线粒体呼吸链复合物及线粒体内关键酶活性。 辅酶Q10是电子传递链的重要辅助因子,存在于多数真核细胞中,尤其是线粒体,参与电子传递链活动。因此,辅酶Q10 可通过提高线粒体电子传递链功能,减少电子“逃逸”而减轻氧化应激损伤。
在实验中采用正常对照组对比LPS 组,正常对照组对比正常对照组+辅酶Q10,LPS+辅酶Q10 组对比LPS 组,检测在6、12、24、48 h 四个时间点的MDA 水平,观察VSMC 氧化应激产物的生成情况。正常对照组和正常对照组+辅酶Q10 之间无明显差异;而正常对照组和LPS 组,LPS+辅酶Q10 组和LPS组,均存在明显差异,每个时间点LPS 组VSMC 产生氧化应激产物明显高于正常对照组,而每个时间点LPS+辅酶Q10组VSMC产生氧化应激产物明显少于LPS 组。上述结果表明,内毒素可明显刺激SD 大鼠血管平滑肌细胞产生过多的氧化应激产物,辅酶Q10 可以明显缓解LPS 带来的VSMC 氧化应激损伤。CCK-8检测各实验组SMCs增殖情况,我们发现LPS 组的OD 值明显低于正常对照组,证实LPS 可显著抑制平滑肌细胞增殖。这可能导致脓毒血症休克病人血管壁中膜平滑肌细胞数量减少,从而影响血管壁弹性回缩力。
目前对脓毒症休克病人进行液体复苏治疗,尽管血容量已经补足,甚至使用血管活性药物后病人仍然普遍出现无法解释的持续性动脉低血压。众所周知动脉血压的产生是由于血管腔内容量负荷和血管壁中膜平滑肌层弹性回缩力的共同效应,通过大量研究证实了有两种功能明显不同的VSMC:一种功能表现为收缩型,分化完全,含有较多的肌丝,是正常情况下血管壁的重要组成部分;另一种在胚胎发育中期和疾病病理血管中,功能表现为合成型,含肌丝极少,具有合成和分泌包括胶原蛋白、弹力蛋白等的功能[11-12]。大量具有VSMC 选择性和特异性的基因被确定用于标记分化成熟的收缩型VSMC,例如血管平滑肌α-肌动蛋白(smooth muscle α-actin,α-SM-actin),而至今尚未发现能特异性代表合成型细胞的基因,而是通过综合收缩型特征蛋白的表达以及与合成表型功能相关蛋白的增减情况来判定,例如指示合成型蛋白:黏附性糖蛋白—骨桥蛋白(OPN)[13-15]。正常状态下VSMC 胞质中α-SM-actin 含量占比高,表现为收缩型,是正常情况下血管壁的重要组成部分[16]。我们实验结果显示,培养48 h 后,正常对照组+辅酶Q10 和正常对照组比较α-SM-actin、骨桥蛋白OPN 的表达量均差异无统计学意义;LPS 组中α-SM-actin 表达量比正常对照组显著降低,LPS 组中OPN 表达量比正常对照组显著提高。证明了脓毒血症顽固性动脉低血压的机制可能为动脉中膜平滑肌细胞受到损伤后其收缩能力急剧降低所致,其原因可能是平滑肌细胞在内毒素刺激下表型发生转变,由收缩型转变为合成型,失去正常血管中膜应有的收缩能力。蛋白质免疫印迹法检测各组VSMC在48 h时间点的α-肌动蛋白α-SM-actin、骨桥蛋白OPN 的表达水平,显示辅酶Q10 对正常的VSMC 的α-SM-actin 表达无明显影响,而可显著提高因内毒素刺激的VSMC 中α-SMactin 蛋白表达水平。证明了辅酶Q10 可部分逆转平滑肌细胞因内毒素刺激而发生的表型转变。
综上所述,顽固性休克为伴有终末器官功能障碍的低血压,常需大剂量升压药维持,病死率高达60%。顽固性休克的病理生理特征是血管对儿茶酚胺刺激的反应受损和病理性血管舒张不受控制。收缩型平滑肌细胞是正常情况下血管壁的重要组成部分,而疾病病理血管则表现为合成型,辅酶Q10降低了因LPS 导致脓毒血症休克所致的VSMC 氧化应激损伤,而大量的氧化应激产物可能推动了血管病理性转化。本文为脓毒血症休克的病理性血管形成提供理论基础,辅酶Q10 可明显减低氧化应激产物的生成及上调α-actin 蛋白的相对表达量,缓解了因LPS 导致脓毒血症休克所致的血管病理化转变。后续仍需进行动物实验及临床试验进一步验证。
(本文图1见插图8-1)
