蜂蜜中苦参碱与氧化苦参碱的快速检测
2022-07-31荆辉华蒋登辉冯燕英王云昊王亮亮
荆辉华 向 俊,2 蒋登辉 冯燕英 王云昊 王亮亮
(1. 湖南省产商品质量检验研究院食品安全监测与预警湖南省重点实验室,湖南 长沙 410017;2. 中南大学化学化工学院,湖南 长沙 410083;3. 长沙理工大学物理与电子科学学院柔性电子材料基因工程湖南省重点实验室,湖南 长沙 410114)
苦参碱和氧化苦参碱主要从豆科植物苦参中提取,因具有消炎、抗病毒、抗过敏、抗心律失常等作用,常被应用于药学和医学领域[1-3]。在病虫防治方面,苦参碱和氧化苦参碱是一类植物生物碱杀虫剂,具有触杀、胃毒作用,对人畜低毒[4]。苦参碱在中国被允许用于柑橘、仁果类水果以及瓜类、芸薹属类蔬菜,是一种新型的相对安全的生物农药,但近一年来,欧盟国家曾多次通报中国出口蜂蜜中检出氧化苦参碱,产品被拒绝入境。根据欧盟(EC)第396/2005号规定,对于未经批准的物质,其最大残留限度一律设为10 μg/kg。据相关研究[5-7]显示,苦参碱与氧化苦参碱是天然植物内源性成分,在与苦参同属豆科槐属植物中广泛存在,如中国西北地区广泛分布的狼牙刺、西藏地区的砂生槐等蜜源植物均含有高含量的苦参碱与氧化苦参碱,因此部分蜂蜜中的苦参碱和氧化苦参碱可能是一种内源性成分而非农药残留。
目前,关于苦参碱和氧化苦参碱的检测方法研究多集中于其作为含量较高的原料和药物使用方面,如苦参作物[8-9]、中药饮片[10]、复方苦参汤[11]、抗妇炎胶囊[12]等,主要有液相色谱法和液相色谱—质谱法。在作为生物农药使用方面,可采用液相色谱串接质谱仪测定有机茶叶、蔬菜、水果、鱼肉及土壤中苦参碱和氧化苦参碱含量[13-16],相比于液相色谱法,高效液相色谱—质谱联用法灵敏度高,抗干扰能力强,更适用于蜂蜜中低含量的内源性成分[17]、生物农药等目标物的检测。目前,关于蜂蜜中苦参碱和氧化苦参碱检测的研究尚未见报道。
研究拟采用液液萃取结合超高效液相—串联质谱法建立一种蜂蜜中苦参碱和氧化苦参碱含量的检测方法,为蜂蜜中苦参碱和氧化苦参碱的风险评估提供依据,为中国蜂蜜质量安全提供技术支持。
1 材料与方法
1.1 材料与试剂
乙腈、甲醇、甲酸:色谱纯,上海安谱实验科技股份有限公司;
氨水、乙酸铵、氯化钠、无水硫酸镁:分析纯,国药集团化学试剂有限公司;
无水硫酸钠:分析纯,天津市致远化学试剂有限公司;
苦参碱(CAS号519-02-8,纯度99.87%)、氧化苦参碱(CAS号16837-52-8,纯度98.94%)标准品:北京坛墨质检科技股份有限公司;
蜂蜜:共45种,根据名称及蜜源进行分类,其中百花蜜13种,洋槐蜜11种,土蜂蜜8种,枇杷蜜3种,椴树蜜2种,柑橘蜜2种,紫云英蜜2种,野菊花蜜2种,荆条蜜1种,山乌桕蜜1种,市售。
1.2 仪器与设备
超高效液相色谱—串联质谱仪:Waters Xevo TQ-S micro型,美国Waters公司;
电子分析天平:BSA224s型,赛多利斯科学仪器(北京)有限公司;
高速离心机:TG16-WS型,长沙市湘仪仪器有限公司;
多管旋涡混合器:945066 数显型,美国Talboys公司;
多通道平行浓缩仪:M64型,北京莱伯泰科仪器有限公司;
超纯水机制备系统:Milli-Q型,美国Millipore公司。
1.3 试验方法
1.3.1 样品前处理 蜂蜜搅拌均匀,取试样1.00 g于15 mL 离心管中,加入3 mL超纯水涡旋振荡使蜂蜜充分溶解,加入6.0 mL 0.1%氨水—乙腈,加入无水硫酸钠1.5 g,涡旋振荡5 min,使0.1%氨水—乙腈与样品溶液充分萃取,10 000 r/min离心5 min,准确吸取3.0 mL上清液氮吹至近干,90%乙腈/水溶液(含0.1%甲酸)定容至1.0 mL,过0.22 μm有机滤膜,上机测试。
1.3.2 标准溶液的配制
(1) 标准储备溶液:准确称取一定量的苦参碱和氧化苦参碱标准品用甲醇溶解,分别配制成1 000 μg/mL标准储备溶液,再准确量取一定量的1 000 μg/mL标准溶液,用甲醇稀释成10 μg/mL的中间液,再将10 μg/mL的中间液稀释成1 μg/mL的混合标准使用溶液,于4 ℃冷藏保存。
(2) 纯溶剂标准溶液:分别移取一定体积的1 μg/mL的混合标准使用溶液,用90%的乙腈/水溶液(含0.1%甲酸)定容,配制质量浓度分别为1,5,10,20,50,80,100 ng/mL 的标准工作液。
(3) 基质标准溶液:用空白基质蜂蜜样品按前处理制得空白基质溶液,采用空白基质溶液配制成1,5,10,20,50,80,100 ng/mL的基质匹配标准工作液。
1.3.3 质谱条件 电喷雾离子源(ESI),正离子模式扫描;离子源温度150 ℃;喷雾电压2.0 kV;多重反应监测模式(MRM);加热气温度500 ℃;脱溶剂气1 000 L/h;苦参碱、氧化苦参碱特征离子对及碰撞能量参数见表 1,选用信号较高的离子为定量离子对,苦参碱的定量离子对为249.2>148.2,定性离子对为249.2>110.2,氧化苦参碱的定量离子对为265.2>205.2,定性离子对为265.2>148.2。

表1 苦参碱和氧化苦参碱的质谱参数†Table 1 Mass parameters for matrine and oxymatrine
1.3.4 色谱条件 Inspire HILIC色谱柱(150 mm×2.1 mm×3 μm);流动相A相为0.1%甲酸—5 mmol/L乙酸铵溶液,B相为乙腈;柱温35 ℃;进样量5.0 μL;梯度洗脱程序:0~2.0 min,10% A;2.0~3.0 min,10%~80% A;3.0~6.0 min,80% A;6.0~6.5 min,80%~10% A;6.5~10.0 min,10% A。
2 结果与分析
2.1 仪器条件优化
2.1.1 质谱条件 结果显示,正离子模式(ESI+)下,合成了准分子离子[M+H]+,苦参碱和氧化苦参碱的响应灵敏度高,通过改变碰撞能量可观察到信号较强的子离子,故采用MRM模式,对确定的子离子的碰撞能进行优化,以获得最佳的质谱参数。
2.1.2 色谱柱选择 结果显示C18柱中,需要较高比例的水相才能获得一定的保留,然而较高比例的水相不利于样品杂质组分的分离和洗脱,同时高比例水相不利于目标物蒸发电离,导致目标物的ESI-MS灵敏度下降。HILIC色谱柱采用极性较强的固定相,提高了极性化合物的保留,采用HILIC色谱柱测定苦参碱和氧化苦参碱,获得了满意的保留效果,且目标物峰型较好,因此选择HILIC柱为分离色谱柱。
2.1.3 色谱条件 结果显示,在0.1%甲酸中,目标物峰严重拖尾,且响应信号低。在0.1%甲酸中加入5 mmol/L的乙酸铵,峰型可得到明显改善,且响应信号增强,可能由于生物碱测定中碱基与色谱柱中阴离子硅醇官能团相互作用导致的拖尾效应[14],加入缓冲盐可降低其相互作用,明显改善目标化合物峰型。故采用0.1%甲酸—5 mmol/L 乙酸铵缓冲液和乙腈进行梯度洗脱,并在10 min 内完成单个样品的分析测试,采用优化好的色谱条件,样品基质对目标物检测干扰小,峰型良好,标准品、阳性样品及阴性样品的MRM图谱见图1。

图1 标准溶液、不同样品的MRM色谱图Figure 1 MRM chromatograms of the standard solution and different sample solution
2.2 提取条件优化
2.2.1 提取溶剂和盐析剂 液液萃取中,常用的萃取溶剂有正己烷、乙酸乙酯、乙腈等,正己烷和乙酸乙酯的极性较弱,对极性化合物的提取效果较差,乙腈对极性或非极性化合物的提取率较高,乙腈虽能与水互溶,但在水相体系中加入适量盐就能促使乙腈与水分离,使得目标物被富集于乙腈层中。根据苦参碱和氧化苦参碱易溶于极性溶剂的性质,选用乙腈体系作为萃取溶剂。
蜂蜜中含果糖和葡萄糖,在一定浓度下,其本身也能促使乙腈和水分离[18],因此,蜂蜜水—乙腈体系在不加盐的情况下也能相分离。考察无盐、NaCl、Na2SO4、MgSO4、QuEChERS试剂(4 g无水 MgSO4、1 g NaCl、0.5 g 柠檬酸氢二钠和1 g柠檬酸钠)对回收率的影响,结果见表2。若直接采用乙腈萃取,苦参碱和氧化苦参碱的回收率较低,由表2可知,除加入QuEChERS盐析剂后目标物的回收率分别为56.7%,54.4%外,其他几种盐析剂的回收率未超过50%。采用酸性乙腈提取时,加入MgSO4的回收率最高,其中苦参碱和氧化苦参碱的回收率分别为78.3%,76.0%。采用碱性乙腈提取时,苦参碱的回收率明显升高,未加盐和不同盐析剂下的回收率均>80%,其中Na2SO4的回收率最高达99.1%。盐析剂种类对苦参碱的影响较小,但对氧化苦参碱的影响较大。不加盐情况下氧化苦参碱回收率为35.9%,加入NaCl后回收率降低,可能是NaCl抑制氧化苦参碱从水相中转移至乙腈中,其他几种盐的回收率依次为Na2SO4>MgSO4>QuEChERS,Na2SO4的回收率达83.0%。苦参碱和氧化苦参碱为碱性化合物,萃取溶剂中加入碱能促使目标物化合物以分子形式存在,增加其在乙腈中的溶解度,从而提高回收率。比较0.1%,0.2%,0.5%,1.0%,2.0%氨水—乙腈对目标物提取效果的影响,发现氨水浓度对回收率无显著影响,综合考虑,以0.1%氨水—乙腈作为萃取溶剂,并采用Na2SO4作为盐析剂。

表2 不同萃取体系及盐种类的回收率Table 2 Recoveries of different extraction systems and salt species %
2.2.2 蜂蜜质量与加水量 蜂蜜含糖量一般为60%~80%,黏稠度较大。如直接用有机试剂提取,提取样品易呈现胶质状,目标物可能会被蜂蜜中糖分吸附,进而导致提取效果较差[19],故先用适量水溶解蜂蜜,使其成为均相体系。为保证试验参数一致,增加水量同时增加溶剂用量。由图2可知,加水稀释影响目标物的提取,其中对氧化苦参碱的影响大于苦参碱,当m蜂蜜∶V水<1∶3 (g/mL)时,样品中氧化苦参碱的回收率较低,继续加大水量,二者回收率均降低。加水量过多,目标物在水中溶解量增加难以萃取完全。因此,采用1 g蜂蜜加3 mL水进行溶解。

图2 蜂蜜质量与加水体积比例对回收率的影响Figure 2 Recoveries of different proportions of honey mass and water volume
2.2.3 萃取溶剂用量 由图3可知,随着萃取溶剂用量的提高,回收率增加,当萃取溶剂用量为6 mL时,回收率无明显增加,且溶剂用量继续提高会增加糖在萃取剂乙腈中溶解,故采用6 mL 0.1%氨水—乙腈进行萃取。

图3 萃取剂用量对回收率的影响Figure 3 Recoveries of different amounts of extraction solvent
2.2.4 盐析剂用量 由图4可知,随着Na2SO4用量的增加,回收率提高,当Na2SO4加入量>1.5 g时,二者回收率无明显增加,故盐析剂用量选1.5 g。
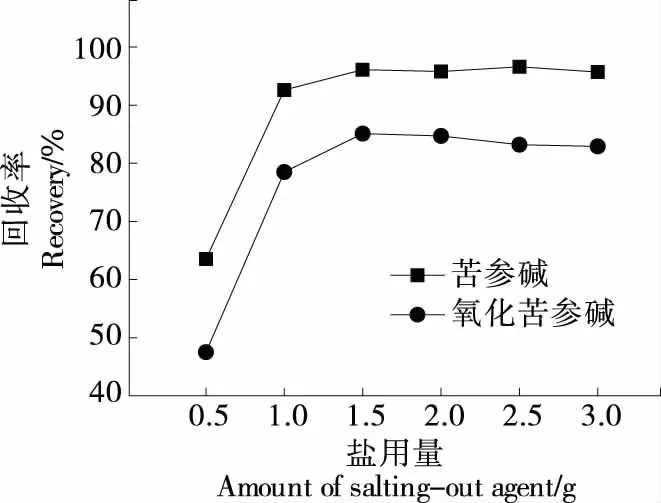
图4 盐析剂用量对回收率的影响Figure 4 Recoveries of different amounts of salting-out agent
2.3 基质效应
基质效应采用基质标准曲线斜率/溶剂标准曲线斜率评估[20],基质效应<100%表明存在基质抑制,基质效应>100%表明存在基质增强,基质效应为80%~120%,通常认定基质效应对定量检测的影响可被接受。由表3可知,苦参碱和氧化苦参碱的基质效应分别为91.5%,89.9%,均存在一定的基质抑制,但处于可被接受的范围内,常规检测可采用溶剂配制标准工作曲线进行定量分析。同时,试验发现流动相的组成和比例对基质效应有影响,适当提高溶剂极性,如适当提高流动相中水相比例能一定程度降低基质干扰,后续可考虑优化流动相比例降低基质效应的影响。这可能由于样品中某些极性化合物与目标物出峰时间相近,干扰目标物电离,适当提高水相比例,有助于杂质与目标物的分离,降低了其对样品分析的干扰。

表3 蜂蜜中苦参碱和氧化苦参碱的基质效应Table 3 Matrix effects of matrine and oxymatrine in honey
2.4 方法学验证
2.4.1 线性关系、检出限和定量限 由表4可知,苦参碱和氧化苦参碱的线性关系良好,相关系数均达到0.999以上,符合定量要求,定量限为0.3 μg/kg。

表4 标准曲线方程、相关系数、检出限和定量限Table 4 Linear equations, correlation coefficients (R2) and LODs and LOQs of analytes
2.4.2 回收率和精密度 由表5可知,苦参碱的加标回收率为90.9%~95.1%,相对标准偏差为2.98%~6.78%,氧化苦参碱的回收率为80.9%~84.3%,相对标准偏差为4.45%~5.06%,平均回收率和RSD均符合GB/T 27404—2008附录F的要求,说明该方法的准确性和重复性良好。

表5 阴性蜂蜜样品的加标回收率和相对标准偏差Table 5 Spiked recoveries and RSD of analytes in blank honey (n=6)
2.5 实际样品测定
采用试验建立的定性和定量分析方法对收集到的45批次蜂蜜进行测定,结果见表6。由表6可知,同一样品中一般苦参碱和氧化苦参碱同时检出,土蜂蜜和百花蜂蜜虽有检出,但含量较低,其中洋槐蜜11份,检出7份,检出率为63.6%,且检出样品的含量相对较高,苦参碱含量最高达58.40 μg/kg,氧化苦参碱含量最高达93.17 μg/kg,考虑内源性成分可能性大,因为狼牙刺、砂生槐类植物中含苦参碱和氧化苦参碱[6-7],洋槐与这两类植物同属豆科植物,花期和地理分布相近,洋槐蜜源容易遭受狼牙刺、砂生槐蜜源的影响,导致洋槐蜜中检出苦参碱和氧化苦参碱。
3 结论
建立了液液萃取结合UPLC-MS/MS检测蜂蜜中苦参碱和氧化苦参碱的分析方法。结果表明,该方法前处理简单,灵敏度高,回收率稳定,将该方法用于市售蜂蜜的测定,成功检测出蜂蜜中苦参碱和氧化苦参碱含量,方法可靠性高,快速准确,适用于蜂蜜样品的批量检测,可以成为蜂蜜中苦参碱和氧化苦参碱残留的常规检测技术。如何进一步提高氧化苦参碱的回收率是值得研究的问题,同时,后期将增加样本的种类和数量,系统地研究苦参碱、氧化苦参碱与蜜源的关系,为蜂蜜中苦参碱和氧化苦参碱的风险评估提供更为充分的依据。

表6 蜂蜜样品中苦参碱和氧化苦参碱含量分布†Table 6 Distribution of matrine and oxymatrine contents in different honey samples
