基于HS-SPME-GC-MS的薰衣草不同部位挥发性成分分析
2022-07-31陈国通马萍萍
陈国通 芦 云 马萍萍 范 蕊 杨 中 曹 续
(1. 新疆师范大学化学化工学院,新疆 乌鲁木齐 830054;2. 新疆维吾尔自治区新疆分析测试研究院,新疆 乌鲁木齐 830011;3. 新疆师范高等专科学校,新疆 乌鲁木齐 830043;4. 新疆农业大学食品科学与药学学院,新疆 乌鲁木齐 830052)
薰衣草(Lavender)是唇形科多年生亚灌木,有着悠久的种植和应用历史[1],因具有浓郁温和的香味,无毒副作用,作为重要的香料原料被广泛用于调制化妆品、皂用香精等[2-3]。作为药用植物,薰衣草具有镇静助眠、抑制肿瘤、抗菌、抗炎、抗氧化等作用[4-7]。同时薰衣草花茶饮料具有良好的抗氧化活性,可以清除体内自由基,预防疾病,抵抗衰老[8-9]。随着薰衣草应用范围的扩大,人们对薰衣草的栽培技术、精油提取、化学成分分析及应用等方面进行了广泛研究[10-11]。
由于挥发性成分含量不同,不同种类的薰衣草有不同的用途[2]。目前有关薰衣草挥发性成分的研究主要集中在薰衣草精油上,其主要提取方法有水蒸气蒸馏法[12]和超临界CO2萃取法[13],但两者均存在样本消耗大、耗时长、成本高等缺点。随着分析技术的发展,薰衣草中挥发性成分的直接测定越来越受到重视[14-15],如顶空固相微萃取(HS-SPME)[16]、吹扫捕集(P&T)[17]等分析方法。这些方法灵敏度高、操作简单、无溶剂污染、可实现在线测定。
研究拟通过单因素试验和正交试验优化顶空固相微萃取法(HS-SPME)提取薰衣草挥发性成分的相关条件,并在最佳条件下分析自然状态下代表性薰衣草品种法国蓝不同部位的挥发性成分,为后续薰衣草的综合利用提供依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
薰衣草:法国蓝,新疆伊犁盛花期薰衣草;
试验用水均为一级水。
1.1.2 主要仪器设备
手动固相微萃取装置:57330-U型,美国Supelco公司;
萃取头:50/30 μm CAR/DVB/PDMS型,美国Supelco公司;
植物样品粉碎机:FW80型,北京市永光明仪器公司;
电子天平:BSA124S型,德国Sartorius公司;
气相色谱质谱联用仪:GCMS-QP2010Plus型,日本岛津公司;
色谱柱:HP-5MS型(30 m×0.25 mm×0.25 μm),美国Agilent公司。
1.2 方法
1.2.1 供试植物预处理 将薰衣草各部位阴干后,用植物样品粉碎机粉碎,分别取一定量样品置于顶空样品瓶中,密封。
1.2.2 固相微萃取 根据文献[18]并修改。将处理后的1.0 g薰衣草各部位样品分别置于4个25 mL顶空瓶中压盖密封,室温下平衡20 min,将老化的萃取头插入顶空瓶中样品上方,将纤维头推出。萃取60 min后插入气相色谱进样口,250 ℃下热解吸5 min。首次使用前,需将萃取头于270 ℃老化0.5 h,后续使用前,萃取头仍需在该温度下老化处理5~10 min,确保萃取头能够在高温下解吸残余挥发性成分,避免对后续待测样品造成干扰。
1.2.3 GC-MS检测条件及定性定量分析
(1) GC条件:进样口温度250 ℃;柱温箱升温程序为初始温度40 ℃,保持3 min,以5 ℃/min升温至100 ℃,平衡1 min,以15 ℃/min升温至260 ℃,保持5 min;载气为99.999%氦气;载气流速1 mL/min;分流比15∶1。
(2) MS条件:电子轰击(EI)离子源;电子能量70 eV;离子源温度230 ℃;接口温度270 ℃;电子倍增器电压350 V;全扫描方式;扫描范围(m/z)45~450。
(3) 采用GCMS-solution 2.7.1化学工作站对采集的数据进行处理,并使用NIST14版谱库对各组分峰进行图库检索;保留匹配度>85%的化合物。通过手动色谱分析确定化合物名称。采用面积归一化法进行定量分析,计算各组分相对含量。
1.2.4 单因素试验 以薰衣草花为试验对象,选取50/30 μm CAR/DVB/PDMS规格的萃取头,对平衡时间、萃取时间、解吸时间三因素进行试验,分析各因素对色谱图峰数目与总面积的影响。
1.2.5 正交试验 在单因素试验基础上,选择解吸时间、萃取时间和平衡时间为影响因素,采用L9(33)正交表进行三因素三水平正交试验,以总峰面积为萃取效果考察指标优化试验参数。
1.2.6 样品分析 根据正交试验分析得到的最佳萃取条件对薰衣草不同部位样品进行试验,并对结果进行分析。
2 结果与分析
2.1 单因素试验
2.1.1 萃取头的选择 根据萃取头的组成材料特性并结合文献[19],50/30 μm复合涂层CAR/DVB/PDMS萃取头更适合于进行大范围的挥发性成分分析,故采用CAR/DVB/PDMS复合涂层萃取头。
2.1.2 萃取温度的选择 根据文献[20],采用固相微萃取测定植物挥发性成分,随着萃取温度的升高,检测到的组分数呈先增加后减小的趋势,一般温度为60~70 ℃时得到的组分数与峰面积均达到最大值,可能是由于随着温度的升高,部分沸点相对较高的组分会从样本中释放,当温度过高时,低沸点组分在竞争吸附中处于劣势,导致部分流失[21]。虽然提高萃取温度会得到更多的挥发性组分与更大的响应峰面积,但试验是为了探究薰衣草不同部位在自然状态下的挥发性成分,故选择在室温下对薰衣草进行萃取。
2.1.3 萃取时间的选择 由图1可知,随着萃取时间的延长,挥发性成分的峰数和总峰面积先增加后趋于平衡,并在60 min时达到最大值。这可能是因为萃取时间较短时挥发性物质在萃取头上吸附不饱和,当萃取时间继续延长至超过60 min后,萃取头上吸附的物质与气体中游离的挥发性成分形成动态平衡[22-24]。综合来看,萃取时间设为60 min。
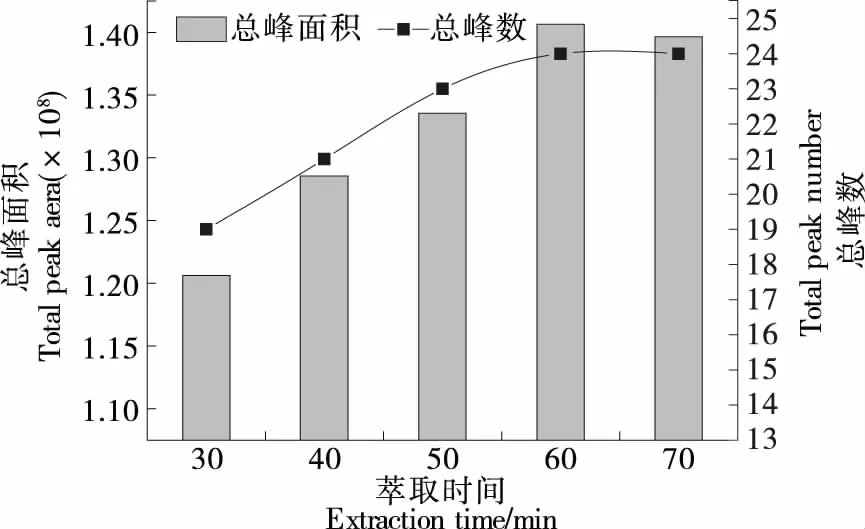
图1 不同萃取时间下薰衣草花挥发性成分的变化Figure 1 Changes of volatile components in lavender flowers under different extraction times
2.1.4 解吸时间的选择 由图2可知,当解吸时间为3~5 min时,挥发性成分的峰面积和数量均较少且呈递增趋势,当萃取时间>5 min时,挥发性成分的峰数目和峰面积均呈稳定趋势,说明萃取时间为5 min时萃取头上吸附的挥发性物质已解吸完全。解吸时间太长也会造成萃取头涂层受损进而影响其寿命[25-26],因此,选择5 min为最佳萃取时间。

图2 不同解吸时间下薰衣草花挥发性成分的变化Figure 2 Changes of volatile components in lavender flowers under different desorption times
2.1.5 平衡时间的选择 由图3可知,当平衡时间为10~30 min时,挥发性成分的总峰面积和峰数均随平衡时间的延长呈上升趋势,但是变化平缓,说明平衡时间对萃取效果影响不大,综合考虑,选择平衡时间为20 min。
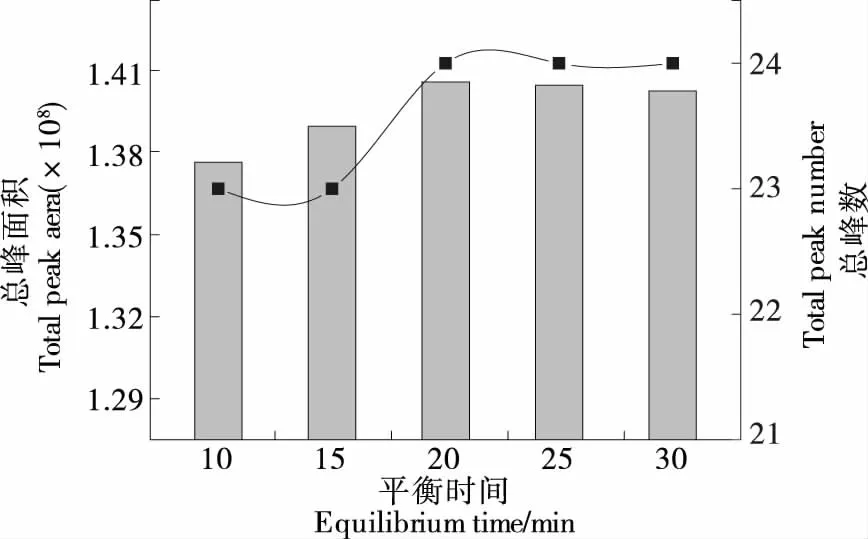
图3 不同平衡时间下薰衣草花挥发性成分的变化Figure 3 Changes of volatile components in lavender flowers under different equilibrium times
2.2 正交试验
综合单因素试验结果,以萃取时间、解吸时间和平衡时间为影响因素,采用L9(33)正交表进行三因素三水平正交试验,以总峰面积为响应值优化试验参数,因素水平见表1,试验设计及结果见表2。

表1 正交试验因素水平表Table 1 Orthogonal experiment factor level
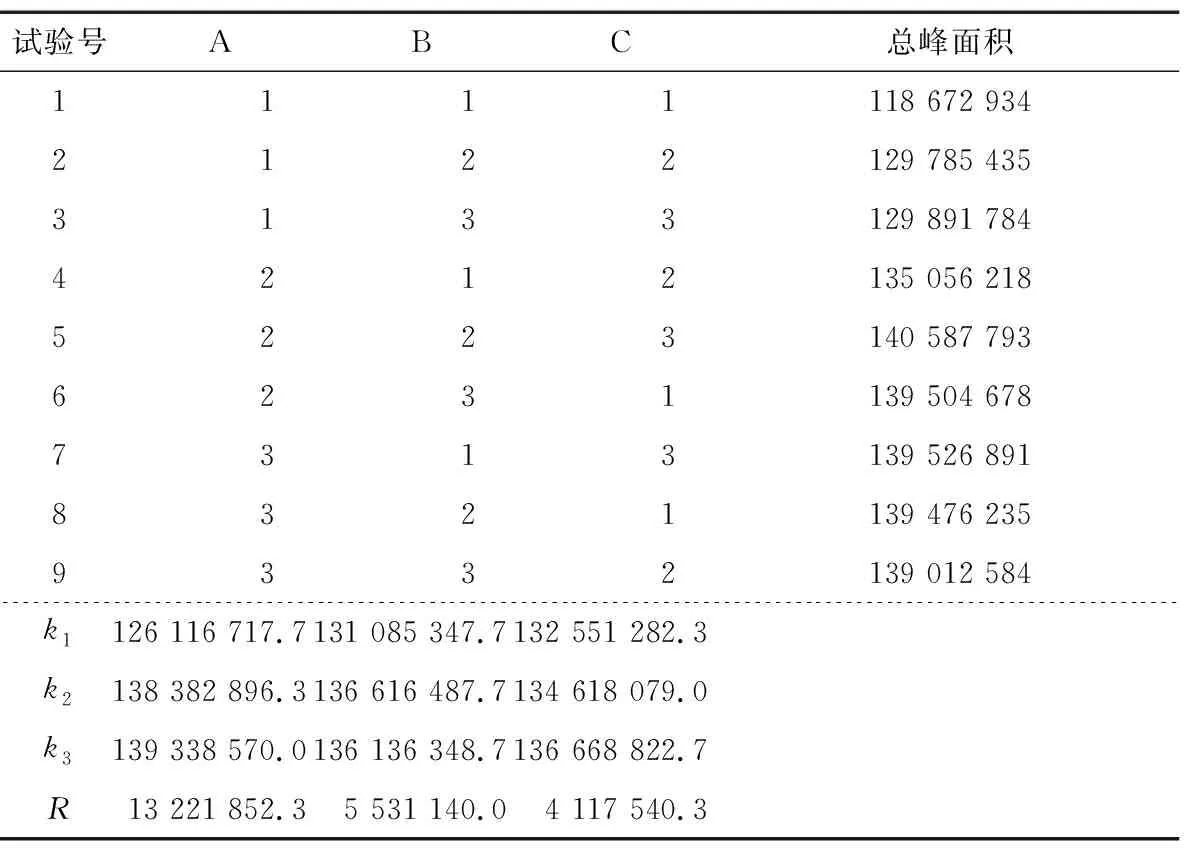
表2 正交试验设计及结果Table 2 Results and analysis of orthogonal array experiments
由表2可知,各因素对萃取效果影响程度为萃取时间>解吸时间>平衡时间,与文献[23]报道结果一致。根据极差结果并结合单因素试验和节能降耗等方面考虑,得出HS-SPME法提取薰衣草花挥发性成分的最佳工艺条件为A3B2C3,即萃取时间70 min,解吸时间5 min,平衡时间25 min。
为确证该工艺的优劣和稳定性,将所筛选的最佳工艺条件进行3次平行验证实验,测得挥发性成分的总峰面积分别为140 715 392,140 716 418,140 715 910,提取效果较好且方法稳定可行。
2.3 薰衣草不同部位挥发性成分含量
对薰衣草根、茎、叶、花4个部位的挥发性成分进行测定,总离子流图见图4。利用面积归一法计算挥发性成分相对含量,结果见表3。
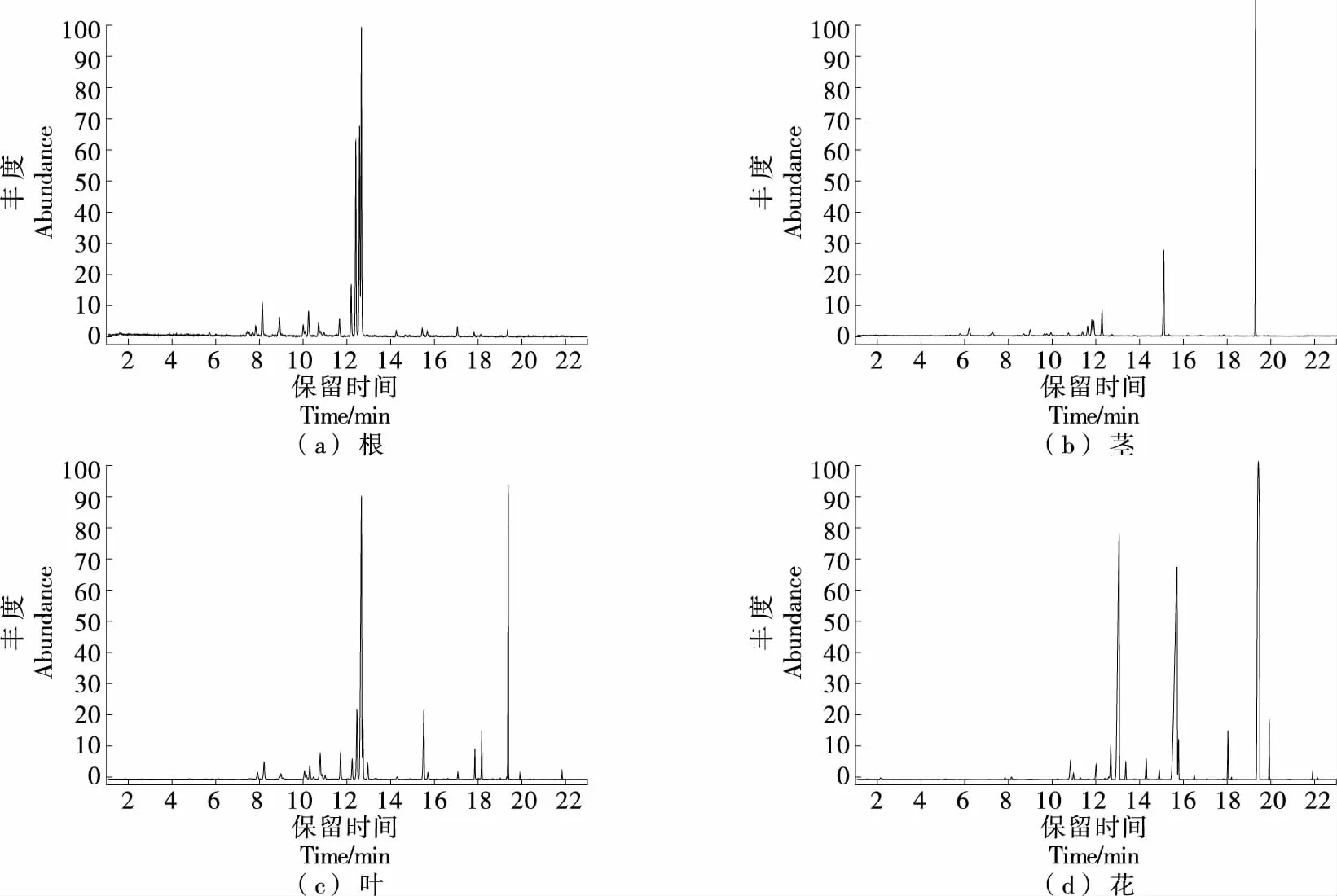
图4 薰衣草各部位挥发性成分总离子流图Figure 4 Total ion chromatogram in different parts of lavender
由表3可知,董衣草不同部位的挥发性成分差异较大。其中挥发性成分相对含量在花中较多,叶次之,茎与根中较少,与文献[12]报道一致。薰衣草各部位共鉴定出36种挥发性成分,其中烃类16种,醇类9种,酮类2种,酯类9种。根、茎、叶、花中共有化合物6种,分别占总挥发性成分相对含量的60.15%,38.52%,54.56%,32.77%。
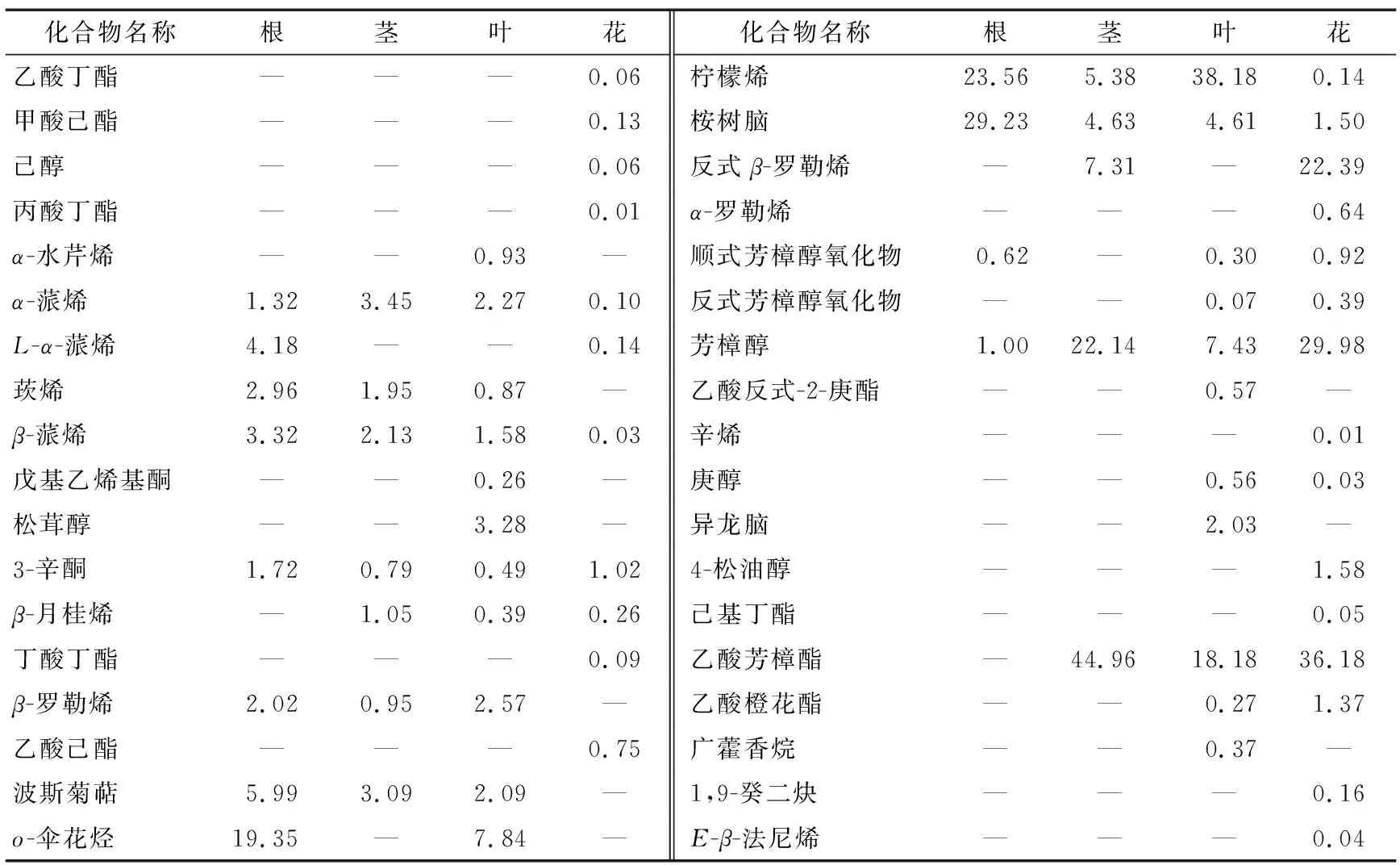
表3 薰衣草不同部位挥发性成分相对含量†Table 3 Analysis results of volatile components in different parts of lavender %
王强等[12]通过HS-SPME法研究了薰衣草茎、叶、花中的挥发性成分,在花和茎中检出含量较高的挥发性成分除芳樟醇和乙酸芳樟酯外还有柠檬烯二氧化物等,可能是该法采用的萃取温度为70 ℃,因此一些高沸点化合物含量会相对偏高。在自然状态下萃取,薰衣草根中也检出较多的挥发性成分,其中柠檬烯和桉树脑这两种成
分含量较多。薰衣草茎和花中含量较多的成分为芳樟醇和乙酸芳樟酯。薰衣草叶中除芳樟醇和乙酸芳樟酯外,含量最高的为柠檬烯。
由表4可知,薰衣草不同部位的挥发性成分在种类和数量上差异较大。其中,花和茎中酯类化合物含量突出,根和叶中烯烃类物质较突出。王新玲等[27]采用传统水蒸气蒸馏(SD)法对薰衣草不同部位中挥发油化学成分进行分析,与试验通过SPME法提取物的组分种类及含量差异较大,可能是因为HS-SPME法是在常温下进行提取,对一些分子质量低、较易挥发物质有较强的吸附作用。而SD法前处理温度较高,可能会造成强挥发性成分损失,一些不稳定化合物分解。因此,HS-SPME法前处理过程相对简单,在分析过程中不会造成强挥发性成分的损失,更能真实地反映样品挥发性成分的原始组成,而SD法更适合分析高沸点的酯类及大极性的醇类等化合物。
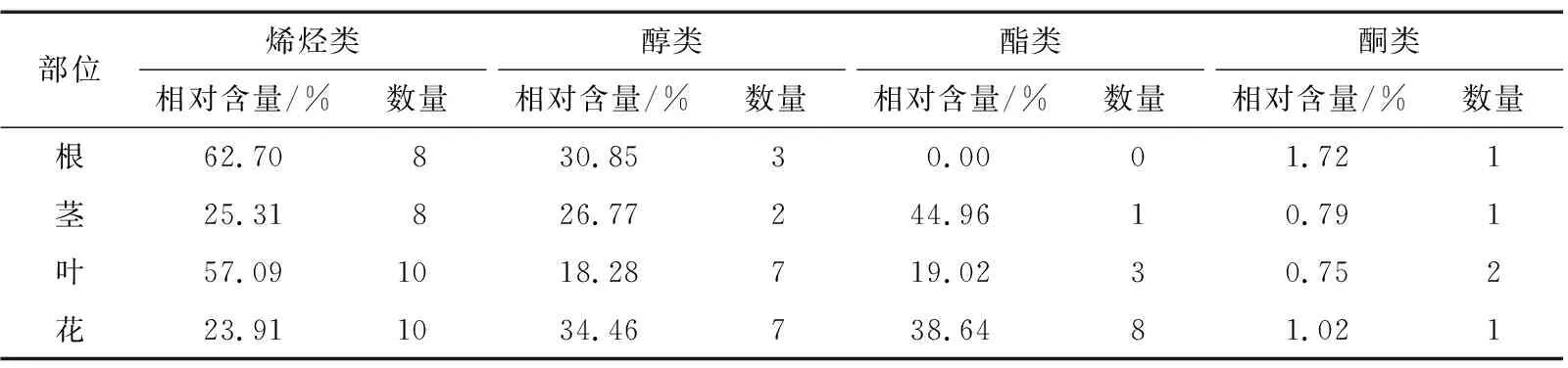
表4 薰衣草不同部位中各类挥发性成分相对含量及数量Table 4 Various volatile components and quantities in different parts of lavender
3 结论
优化了顶空固相微萃取—气相色谱法提取薰衣草挥发性成分的条件:50/30 μm CAR/DVB/PDMS萃取头、1.0 g样品、萃取时间70 min,解吸时间5 min,平衡时间25 min,在此优化条件下对薰衣草各部位自然状态下的挥发性成分进行分析。结果表明,薰衣草中各部位挥发性成分的种类和含量差异较大,各部位共鉴定出36种挥发性成分,其中共有化合物6种。花和茎中的酯类化合物含量突出,根和叶中的烯烃类物质较突出。各部位化合物共同影响,相互转换,其转化作用机制与规律还有待进一步研究。
