葫芦茶苷通过调控Nrf2/HO-1信号通路抑制肝星状细胞增殖活化的作用▲
2022-07-31韦璐莹卢清华甘昌鑫谢冬梅唐爱存
韦璐莹 卢清华 甘昌鑫 谢冬梅 唐爱存
(广西中医药大学第一附属医院宣传办公室,南宁市 530023,电子邮箱:wly24312@163.com)
肝星状细胞(hepatic stellate cell,HSC)增殖活化是肝纤维化进展的主要特征。HSC是细胞外基质(extracellular matrix,ECM)的主要合成细胞,正常情况下HSC处于静止状态,但在肝脏不断受到慢性损伤的刺激后HSC被激活,其表型由静止型转变为激活型[1-2]。HSC活化后转化为肌成纤维细胞,肌成纤维细胞通过旁分泌与自分泌作用使HSC增殖,并合成大量的ECM,同时ECM的降解减少,以致其在肝内大量沉积,肝纤维化逐渐形成。因此,HSC的活化是肝纤维化的细胞学基础,是肝纤维化发生、发展的中心环节[3-4]。目前,越来越多的学者选择HSC作为治疗的靶标研发抗肝纤维化药物。
葫芦茶苷是从壮药葫芦茶中提取分离得到的活性化合物。本课题组前期研究表明,葫芦茶苷具有显著的保肝和抗肝纤维化作用,其保肝作用机制可能与其抗氧自由基、抑制脂质过氧化作用和下调Caspase-3和Caspase-8的活性有关[5-6];其抗肝纤维化机制可能是通过清除自由基和抑制炎性反应,抑制胶原合成与沉积,减轻HSC的活化[7-8]。但葫芦茶苷抗肝纤维化的具体作用及对相关信号通路的调节机制尚未完全清楚。核因子E2相关因子2(nuclear factor erythroid 2-related factor 2, Nrf2)/血红素加氧酶1(heme oxygenase 1, HO-1)信号通路参与肝脏的氧化应激反应,可以抑制NLRP3炎性小体活性,减轻氧化应激与炎症反应,从而抑制肝星状细胞活化。本实验使用LX-2细胞建立体外HSC活化模型, 并基于Nrf2/HO-1信号通路进一步探讨葫芦茶苷抗肝纤维化的作用及其机制,以期为葫芦茶的临床应用提供理论基础和实验依据。
1 材料与方法
1.1 药品与试剂 葫芦茶苷样品(纯度>98.0%)由本课题组从葫芦茶中分离而得,先采用水提正丁醇萃取,再分别采用硅胶柱色谱法、凝胶柱色谱、反相高效液相半制备色谱法得到葫芦茶苷样品。采用无血清高糖杜氏改良伊戈尔培养基(Dulbecco′s modified Eagle medium,DMEM)配成浓度为500 μg/mL的母液,-4 ℃保存备用。高糖DMEM由美国Gibco公司生产(批号:8118290);胎牛血清由AusGeneX公司生产(批号:FBS00819-1);胰蛋白酶由美国Amresco公司生产(批号:0761);转化生长因子β1(transforming growth factor β1,TGF-β1)培养液、MTT由美国Sigma公司生产(批号分别为GF346、M2003);TRIzol试剂由美国Invitrogen公司生产(批号:15596026),反转录试剂由德国 Thermo公司生产(批号:K1622);琼脂糖由西班牙Biowest公司生产(批号:11860);PBS由福州迈新生物技术开发有限公司生产(批号:8120140);SYBR荧光定量PCR试剂盒由日本TaKaRa公司生产(批号:C-19864);RIPA裂解液(含1%蛋白酶抑制剂)、SDS-PAGE蛋白上样缓冲液、Western电泳液、Western 转膜液均由上海碧云天生物技术有限公司生产(批号分别为P0013B、P0015、P0015、P0021A);Ⅰ型胶原蛋白(collagen type Ⅰ,ColⅠ)、Ⅲ型胶原蛋白(collagen type Ⅲ,ColⅢ)和α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)ELISA检测试剂盒均购自南京建成生物工程研究所(批号分别为20201210、20201210、20200705),其他试剂均为分析纯;α-SMA、ColⅠ、Nrf2、HO-1多克隆抗体由武汉三鹰生物技术有限公司生产(批号分别为00075696、00066288、00032518、00075847);山羊抗兔IgG二抗由美国Abbkine公司生产(批号:ATSMR2201);ECL化学发光显影液由上海爱必信生物科技有限公司生产(批号:EL0419004)。
1.2 主要仪器 Model 311型CO2孵箱由美国Thermo Fisher Scientific生产;ACB-4A1细胞超净台由新加坡艺思高科技有限公司生产;CKX-41型荧光倒置显微镜由日本奥林巴斯株式会社生产;Model 450型自动酶标仪、ABI 9700型实时荧光定量PCR仪、HD-4N型核酸蛋白测定仪、Micro 17R低温高速离心机均由美国Bio-Rad公司生产;EM10-7-10型水平电泳仪由美国 Major Science公司生产;LI-COR Odyssey CLx型双色红外荧光扫描成像系统由美国 LI-COR公司生产;722型可见分光光度计由上海精密科学仪器有限公司生产。
1.3 细胞株来源和细胞培养 LX-2 细胞购自中国科学院细胞库,本实验室自行培养传代。采用高糖DMEM将冻存的LX-2细胞复苏,并采用含青霉素(10万单位)、链霉素(10万单位)及10 %胎牛血清的高糖DMEM作为培养液,将LX-2细胞置于37 ℃、5% CO2的恒温培养箱中培养,每天观察细胞生长情况,每两天更换一次细胞培养液,待细胞贴壁并长满后,采用0.25 %胰酶消化并传代,取对数生长期的细胞进行后续试验。
1.4 MTT法检测葫芦茶苷对LX-2细胞增殖的影响 将对数生长期的LX-2细胞调整为5×103个/mL的细胞悬液,并接种于96孔培养板中,每孔100 μL,分为空白对照组、模型组、不同浓度(10、20、40、80、160 μg/mL)葫芦茶苷组进行实验,每组6个复孔。将各组细胞置于37 ℃、5% CO2的恒温培养箱中培养,待细胞密度达至60%左右,弃去旧培养液,加入新培养液,除空白对照组外,其余各组加入终浓度为5 μg/L的TGF-β1刺激细胞增殖活化;刺激24 h后,葫芦茶苷各剂量组给予相应浓度的药物(给药体积为100 μL)干预,空白对照组和模型组加入等体积的含10 %胎牛血清的高糖DMEM培养。继续培养24 h后,弃去各孔中的培养基,加入20 μL终浓度为5 mg/mL的MTT溶液,置于37 ℃、5% CO2的恒温培养箱中孵育4 h,弃去上清液,每孔加入200 μL的二甲基亚砜溶液,振摇10 min,采用全自动酶标仪在波长为490 nm处检测各组光密度A490值。细胞抑制率(%) = (给药组A490值-空白组A490值)/(阴性对照组A490值-空白组A490值)×100%。实验重复6次。
1.5 ELISA检测细胞上清液ColⅠ、ColⅢ和α-SMA的表达水平 将对数生长期的LX-2细胞调整浓度为5×103个/mL的细胞悬液,并接种于96孔培养板中,每孔200 μL,分为空白对照组、模型组、葫芦茶苷低中高剂量组(20、40、80 μg/mL)进行实验,每组6个复孔。将各组细胞置于37 ℃、5% CO2的恒温培养箱中培养,待细胞密度达60%左右,除空白对照组外,其余各组加入终浓度为5 μg/L的TGF-β1刺激细胞增殖活化;刺激24 h后,葫芦茶苷各剂量组给予相应浓度的药物(给药体积为100 μL)干预,空白对照组和模型组加入等体积的含10 %胎牛血清的高糖DMEM培养。继续培养24 h后,收集各组细胞上清液,分别按照试剂盒说明书,采用ELISA测定细胞上清液中ColⅠ、ColⅢ和α-SMA的表达水平。实验重复6次。
1.6 定量PCR法检测细胞中α-SMA、ColⅠ、Nrf2、HO-1 mRNA的表达水平 按照1.5步骤中的方法进行细胞分组和给药干预,培养24 h后,弃去细胞上清液,收集各组细胞,严格按照TRIzol试剂盒说明书提取细胞总RNA,并采用微量核酸检测仪测定RNA纯度和浓度,再将RNA反转录成cDNA,然后进行定量PCR检测。PCR的反应体系:SYBR Green Master Mix 10 μL,上下游引物各1 μL,cDNA模板1 μL,ddH2O补足至20 μL。反应条件:95 ℃预变性10 min;95 ℃变性15 s,55 ℃退火60 s,72 ℃延伸30 s,共40个循环。以GAPDH为内参基因。本实验中α-SMA、ColⅠ、Nrf2、HO-1 GAPDH基因的引物设计、合成及验证均由大连TaKaRa宝生物工程有限公司完成。PCR扩增实验操作严格按照TaKaRa公司试剂盒说明书进行,采用2-△△Ct法分析各基因在细胞中的相对表达水平。各基因引物序列见表1。实验重复6次。

表1 基因引物序列表
1.7 Western blot检测细胞中α-SMA、ColⅠ、Nrf2、HO-1蛋白的表达水平 按照1.5步骤中的方法进行细胞分组与给药干预,连续培养24 h后,弃去细胞上清液,收集各组细胞,用RIPA裂解细胞获得总蛋白,使用微量核酸检测仪检测细胞总蛋白的浓度,以蛋白裂解液空白调零。采用10%SDS-PAGE进行蛋白质的电泳分离,再进行转膜将蛋白转移到聚偏氟乙烯膜上,然后用5%脱脂奶粉封闭液封闭膜1 h,以TBST缓冲液洗膜3次(5 min/次)后,再分别加入均为1 ∶1 000稀释的α-SMA、ColⅠ、Nrf2、HO-1、GAPDH多克隆抗体,4 ℃孵育过夜,TBST缓冲液洗膜3次,然后加入1 ∶1 000稀释的山羊抗兔IgG二抗室温孵育2 h后,再用TBST 缓冲液清洗,最后以ECL化学发光显影液显影,采用ImageJ 2×软件检测蛋白条带的灰度值,以目标蛋白与内参蛋白(GAPDH)灰度值的比值作为目的蛋白的相对表达水平。实验重复6次。
1.8 统计学分析 采用SPSS 22.0软件对数据进行统计处理。计量资料以(x±s)表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 葫芦茶苷对LX-2 细胞增殖的影响 与空白对照组比较,模型组细胞增殖明显(P<0.05);与模型组比较,葫芦茶苷各剂量组LX-2 细胞的增殖均受到抑制(均P<0.05),且随着葫芦茶苷药物剂量的增加,抑制效果越明显(均P<0.05),见表2。10 μg/mL葫芦茶苷抑制率偏低,而160 μg/mL葫芦茶苷抑制率过高,故选取抑制率适宜的剂量20、40、80 μg/mL进行后续实验。
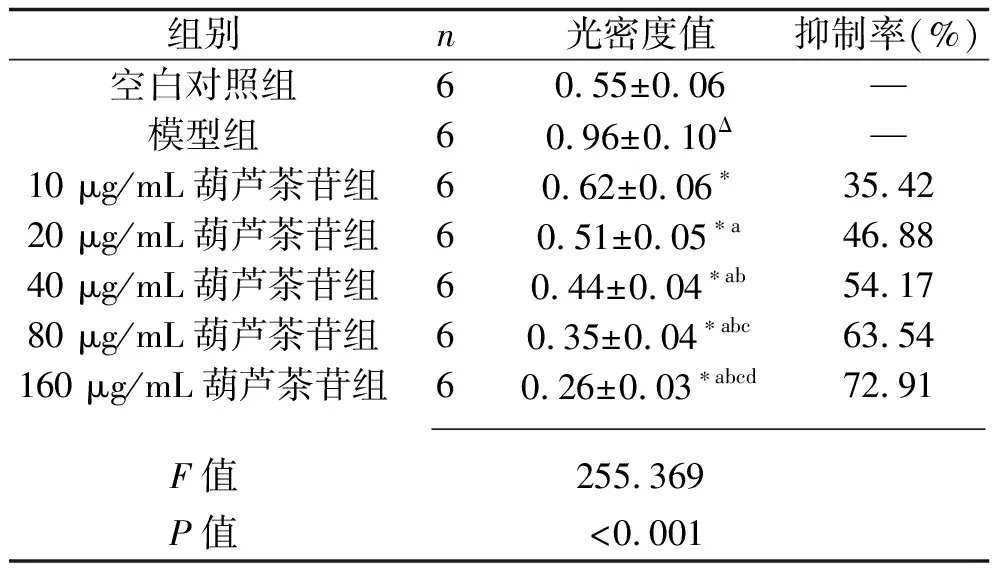
表2 7组LX-2细胞的增殖情况比较(x±s)
2.2 葫芦茶苷对LX-2细胞上清液ColⅠ、ColⅢ和α-SMA表达水平的影响 与空白对照组比较,模型组中ColⅠ、ColⅢ和α-SMA表达水平升高(均P<0.05);与模型组比较,葫芦茶苷各剂量组细胞上清液中ColⅠ、ColⅢ和α-SMA表达水平降低(均P<0.05)。葫芦茶苷低、中、高剂量组中的ColⅠ、α-SMA表达水平依次降低(均P<0.05);而葫芦茶苷中、高剂量组中ColⅢ表达水平均低于葫芦茶苷低剂量组(均P<0.05),但这两组比较差异无统计学意义(P>0.05)。见表3。
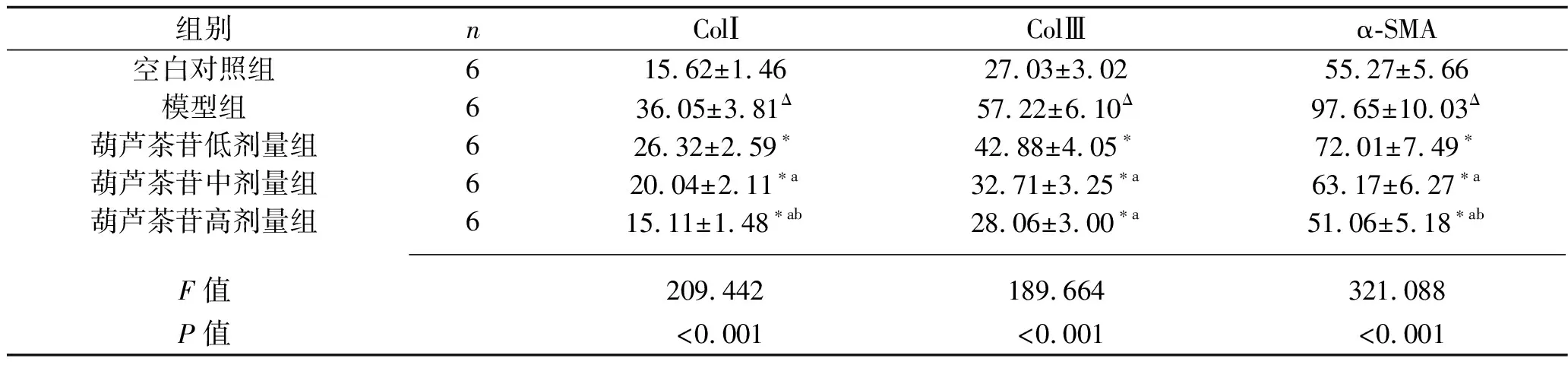
表3 5组LX-2细胞上清液ColⅠ、ColⅢ和α-SMA表达水平的比较(x±s,ng/mL)
2.3 葫芦茶苷对LX-2细胞α-SMA、ColⅠ、Nrf2、HO-1 mRNA表达水平的影响 与空白对照组比较,模型组中α-SMA和ColⅠ的mRNA表达水平升高(均P<0.05), 而Nrf2和HO-1的mRNA表达水平降低(均P<0.05);与模型组比较,各剂量葫芦茶苷组细胞中α-SMA、ColⅠ 的mRNA表达水平降低,同时Nrf2、HO-1 的mRNA表达水平上调(均P<0.05)。而葫芦茶苷中、高剂量组α-SMA mRNA表达水平均低于葫芦茶苷低剂量组(均P<0.05),但这两组比较差异无统计学意义(P>0.05);葫芦茶苷低、中、高剂量组ColⅠ的mRNA表达水平依次降低(均P<0.05);葫芦茶苷高剂量组Nrf2、HO-1 的mRNA表达水平均高于其他低剂量组(均P<0.05),而葫芦茶苷低、中剂量组之间差异无统计学意义(均P>0.05)。见表4。
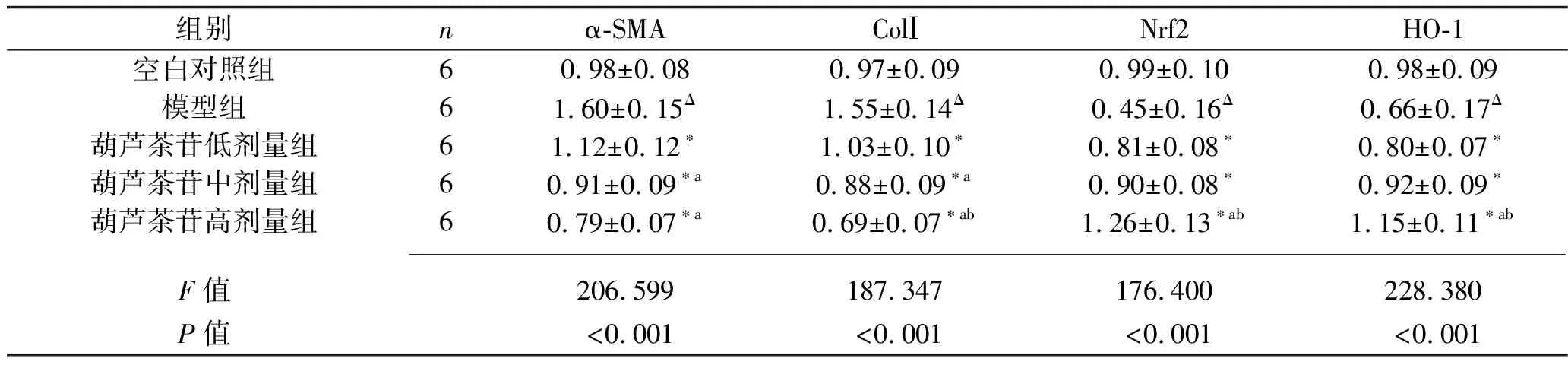
表4 5组细胞α-SMA、ColⅠ、Nrf2、HO-1 mRNA相对表达水平的比较(x±s)
2.4 葫芦茶苷对LX-2细胞α-SMA、ColⅠ、Nrf2、HO-1蛋白表达水平的影响 与空白对照组比较,模型组中α-SMA和ColⅠ蛋白表达水平升高,而Nrf2和HO-1 蛋白表达水平降低(均P<0.05);与模型组比较,葫芦茶苷各剂量组α-SMA、ColⅠ蛋白表达水平降低,Nrf2、HO-1 蛋白表达水平升高(均P<0.05)。葫芦茶苷中、高剂量组中α-SMA、ColⅠ的蛋白表达水平均低于葫芦茶苷低剂量组(均P<0.05),而中、高剂量组之间差异无统计学意义(均P>0.05);葫芦茶苷低、中、高剂量组中Nrf2、HO-1 的蛋白表达水平依次升高(均P<0.05)。见表5。

表5 5组细胞α-SMA、ColⅠ、Nrf2、HO-1 蛋白相对表达水平的比较(x±s)
3 讨 论
在肝脏受到病毒、炎症等致病因素刺激后,HSC被激活并转化为肌成纤维细胞,导致肝细胞内α-SMA表达增多,以及ColⅠ、ColⅢ等ECM成分过度沉积,从而引起肝细胞内胶原蛋白合成和降解失衡,肝内胶原纤维大量增加,肝脏纤维结缔组织结构发生异常改变,最终导致肝纤维化的发生[9]。而肝纤维化的持续存在,伴随着正常肝实质细胞的坏死和凋亡,以及ECM的不断合成与沉积,这导致肝组织结构的破坏与重建,肝实质逐渐被ECM形成的瘢痕组织所取代,最终引起肝硬化,甚至肝癌[10]。TGF-β1是介导肝损伤及纤维化的最关键细胞因子,在细胞外、胞质及胞核内均有表达,研究证实TGF-β1对HSC的激活、转化、分化及调节具有极其重要的作用,是最强的促HSC纤维化生成因子[11]。本研究结果显示,经TGF-β1刺激后模型组细胞增殖明显,且细胞上清液ColⅠ、ColⅢ和α-SMA表达水平升高,细胞中的α-SMA、ColⅠ mRNA和蛋白表达水平亦升高(P<0.05),提示成功建立体外HSC活化模型;在给予葫芦茶苷干预后,细胞增殖受到抑制,细胞上清液中ColⅠ、ColⅢ和α-SMA表达水平降低,同时细胞中的α-SMA、ColⅠ mRNA和蛋白表达水平亦下调,提示葫芦茶苷具有明显的抗肝纤维化作用。此外,随着葫芦茶苷干预剂量的增加,细胞增殖的抑制效果越明显,细胞上清液ColⅠ和α-SMA表达水平、细胞中ColⅠ蛋白表达水平呈下降趋势(P<0.05),提示该药物在抑制HSC增殖和抗纤维化作用方面具有一定的剂量依赖性。
Nrf2/HO-1氧化应激信号途径参与了肝脏的氧化应激损伤,在氧化损伤保护中发挥着重要作用[12]。Nrf2是调节抗氧化应激的重要转录因子,在调节肝脏炎症及纤维化过程中起着重要的作用,其作为HO-1激活的主要转录因子,静息状态下可在细胞质内与Kelch样环氧氯丙烷相关蛋白1结合,后者能够促使Nrf2发生泛素化且被蛋白酶体降解,使得Nrf2的活性受到抑制;但是当体内发生氧化应激时,Nrf2发生磷酸化并与Kelch样环氧氯丙烷相关蛋白1解离,进而转移到细胞核上并与抗氧化反应元件序列结合,启动靶基因转录,上调Ⅱ相解毒酶和抗氧化蛋白HO-1的表达,进而发挥抗肝纤维化作用[13]。本研究结果显示,给予TGF-β1诱导刺激后,模型组中Nrf2、HO-1 mRNA和蛋白的表达水平显著下降,提示Nrf2/HO-1信号通路与HSC活化存在关联;在给予一定的葫芦茶苷药物干预后,细胞中Nrf2、HO-1 mRNA和蛋白的表达水平上调(P<0.05),提示葫芦茶苷抑制HSC的增殖活化可能与调控Nrf2、HO-1表达有关。
综上所述,葫芦茶苷能抑制TGF-β1诱导的LX-2细胞活化与增殖,具有抗肝纤维化作用,且中/高剂量干预时效果更佳,其机制可能是通过调节Nrf2/HO-1信号途径而发挥作用。本研究结果或可为进一步深入研究葫芦茶苷抗肝纤维化作用机制及开发高效的抗肝纤维化新药奠定基础。
