乳腺癌细胞外泌体对肿瘤相关成纤维细胞激活的诱导作用及机制▲
2022-07-31仲守泰李自涛郭世春
仲守泰 李自涛 郭世春
(1 青海省肿瘤医院乳腺科,西宁市 810000,电子邮箱:z55021984@163.com;2 新疆医科大学基础医学院,乌鲁木齐市 830011)
乳腺癌是临床上常见的女性恶性肿瘤,严重危害女性的生命健康。研究表明,全球每年约有49万人死于乳腺癌[1]。随着肿瘤诊断和治疗技术的进步,乳腺癌患者的治疗效果和生存率也在不断提高,但是乳腺癌术后复发、肿瘤耐药等问题仍然一直威胁着患者的健康[2]。因此,探究乳腺癌生长和转移的机制,对于临床治疗至关重要。外泌体是一类由活细胞分泌的纳米级囊泡,粒径为50~100 nm,可携带母细胞的遗传信息作用于靶组织和靶器官[3]。研究表明,肿瘤细胞外泌体可携带肿瘤细胞的遗传信息,参与调控肿瘤的生长和转移、免疫逃逸、血管生成、肿瘤耐药等[4-6]。肿瘤相关成纤维细胞是肿瘤微环境的重要组成部分,可直接或间接地调控肿瘤的生长和转移、免疫逃逸等[7-8]。本研究主要分析乳腺癌细胞及外泌体干预对肿瘤相关成纤维细胞激活的诱导作用,从而为研究乳腺癌的发病机制提供参考。
1 材料与方法
1.1 材料 人乳腺上皮细胞MCF10A、人乳腺癌细胞MCF-7和MDA-MB-231由中国科学院上海生命科学研究所提供,成纤维细胞MRC-5由普诺赛生物技术有限公司提供。cDNA合成试剂盒(批号:Q410-03)、实时荧光定量PCR试剂盒(批号:Q411-02)购自南京诺唯赞生物科技有限公司,核因子κB(nuclear factor κB,NF-κB)抗体(批号:10745-1-AP)、磷酸化NK-κB(phosphorylated NF-κB, p-NF-κB)抗体(批号:23576-1-AP)、NF-κB抑制因子α(NF-κB inhibitor α,IκBα)抗体(批号66535-1-Ig)、GAPDH抗体(批号60004-1-Ig)、热休克蛋白(heat shock protein 70,HSP70)抗体(批号:25405-1-AP)、肿瘤易感基因101(tumor susceptible gene 101,TSG101)抗体(批号:28283-1-AP)、CD9抗体(批号:20597-1-AP)、CD81抗体(批号:66866-1-Ig)、山羊抗兔IgG抗体(批号:65210-1-Ig)均购自武汉三鹰生物技术有限公司,Transwell小室(批号:3422)购自福麦斯生物技术有限公司,外泌体抑制剂GW4869(批号:M4974)购自美国AbMole公司,无外泌体胎牛血清(批号:abs993)购自爱必信生物科技有限公司,杜氏改良伊格尔培养基(Dulbecco′s modified Eagle medium,DMEM;批号:11965)购自北京索莱宝科技有限公司,基本培养基(minimal medium,MM;批号:21090055)、TRIzol试剂(批号:15596026)购自赛默飞世尔科技(中国)有限公司,放射免疫沉淀(radioimmunoprecipitation assay,RIPA)蛋白裂解液(批号WLA016a)、苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF)蛋白酶抑制剂(批号:WLA138)、二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒(批号:WLA004)、ECL试剂盒(批号:WLA003)均购自沈阳万类生物技术有限公司,DAPI染料(批号:ab285390)购自英国Abcam公司。35 mm激光共聚焦培养皿(批号:J40204)购自上海百千生物科技有限公司,超速离心机(型号L-80XP)购自美国贝克曼库尔特有限公司,高分辨透射电镜(型号JEM-2100F)购自日本 JEOL公司,核酸定量仪(型号NanoDrop One)购自赛默飞世尔科技(中国)有限公司。
1.2 细胞培养 将MCF10A、MDA-MB-231、MCF-7细胞培养于含10%胎牛血清的DMEM中,将MRC-5细胞培养于含10%胎牛血清和1%非必需氨基酸的MEM中,所有细胞均在37 ℃、5% CO2、饱和湿度培养箱中培养至融合率达70%~80%,然后使用胰蛋白酶溶液消化并传代,取对数生长期的细胞进行后续研究。
1.3 外泌体的提取与鉴定 将上述MCF10A、MDA-MB-231、MCF-7细胞的培养基更换为含10%无外泌体胎牛血清的DMEM,培养48 h后收集细胞培养上清液。使用差速离心法提取细胞培养上清中外泌体,具体步骤为:将上清液在4 ℃下3 000 g离心15 min去除死细胞,再将上清液在4 ℃下6 000 g离心40 min,去除细胞碎片;然后在4 ℃下10 000 g离心1 h,取上清;之后在4 ℃下100 000 g离心1 h,收集沉淀即为外泌体,用400 μL PBS重悬外泌体,并置于-80 ℃环境中保存。将上述细胞所分泌的外泌体记为MCF10A exo、MDA-MB-231 exo、MCF-7 exo。使用透射电镜拍照并观察外泌体的形态结构:将透射电镜所用的铜网平放到称量纸上,滴加20 μL上述外泌体溶液,于红外灯下烘烤10 min;烘干后再滴加2滴磷钨酸,继续烘烤10 min,用滤纸吸走多余液体,于透射电镜下观察外泌体结构并拍照。
1.4 细胞分组与共培养 将MRC-5细胞分别与MCF10A、MDA-MB-231、MCF-7、PBS共培养,记为MRC-5+MCF10A组、MRC-5+MDA-MB-231组、MRC-5+MCF-7组、MRC-5+PBS组。具体过程为:将MCF10A、MDA-MB-231、MCF-7重悬于含10%无外泌体胎牛血清的DMEM中,将MRC-5重悬于含10%无外泌体胎牛血清及1%非必需氨基酸的MM中;将0.4 μmol/L的Transwell小室放置于24孔板中,使小室刚好浸入24孔板的细胞培养基中,其中24孔板每孔接种MRC-5细胞1×105个(每孔600 μL),Transwell小室孔内接种3×104个MCF10A、MDA-MB-231、MCF-7细胞及等体积的PBS(每孔200 μL),每组设3个复孔,然后将24孔板置于37 ℃、5% CO2饱和湿度培养箱中培养48 h。
按照上述方法,将MRC-5细胞与MCF10A、MDA-MB-231、MCF-7、PBS共培养,于开始共培养时在Transwell小室内加入10 mmol/L的GW4869 5 μL,然后将24孔板置于37 ℃、5% CO2、饱和湿度培养箱中培养48 h,分别记为MRC-5+MCF10A+GW4869组、MRC-5+MDA-MB-231+GW4869组、MRC-5+MCF-7+GW4869组、MRC-5+PBS+GW4869组。同样按照上述方法,将MRC-5细胞分别与10 μg/mL的MCF10A exo、MDA-MB-231 exo、MCF-7 exo、等体积PBS共培养24 h,记为MCF10A exo组、MDA-MB-231 exo组、MCF-7 exo组、PBS组。
1.5 细胞迁移实验 收集1.4中MRC-5+MCF10A组、MRC-5+MDA-MB-231组、MRC-5+MCF-7组、MRC-5+PBS组、MRC-5+MCF10A+GW4869组、MRC-5+MDA-MB-231+GW4869组、MRC-5+MCF-7+GW4869组、MRC-5+PBS+GW4869组、MCF10A exo组、MDA-MB-231 exo组、MCF-7 exo组、PBS组的MRC-5细胞,用不含血清的MEM重悬,并取200 μL细胞接种于Transwell小室中,每孔5×103个MRC-5细胞,每组3个复孔。将小室放置于24孔板中,24孔板每孔加入600 μL含10%胎牛血清及1%非必需氨基酸的MM,并将上述24孔板转移至37 ℃、5% CO2、饱和湿度培养箱中培养24 h,小室底部用PBS清洗后用无水乙醇固定30 min,然后将小室倒扣,于底部滴加2%结晶紫染色10 min,清洗后晾干,于显微镜下观察拍照并计数,比较各组的细胞迁移数。
1.6 实时荧光定量PCR检测 按照TRIzol试剂说明书,提取MRC-5+MCF10A组、MRC-5+MDA-MB-231组、MRC-5+MCF-7组、MRC-5+PBS组、MRC-5+MCF10A+GW4869组、MRC-5+MDA-MB-231+GW4869组、MRC-5+MCF-7+GW4869组、MRC-5+PBS+GW4869组、MCF10A exo组、MDA-MB-231 exo组、MCF-7 exo组、PBS组的MRC-5细胞的RNA。主要步骤为:消化并计数取各组1×104个MRC-5细胞置于离心管中,每管加1 mL TRIzol试剂后室温裂解5 min,4 ℃下离心12 000 g 15 min,取上层溶液,加入500 μL异丙醇,4 ℃下12 000 g离心10 min,弃上清,用1 mL 75%乙醇清洗RNA沉淀后,用20 μL RNase-free水重悬RNA沉淀,55 ℃水浴10 min,即为总RNA,使用核酸定量仪检测总RNA含量。根据cDNA合成试剂盒进行反转录后,使用实时荧光定量PCR试剂盒进行反应,以GAPDH为内参。反应体系:2×AceQ qPCR SYBR Green Master Mix 10.0 μL,Primer1 0.4 μL,Primer2 0.4 μL,Template cDNA 2 μL,ddH2O 7.6 μL;反应条件为95 ℃ 5 min、95 ℃ 30 s、55 ℃ 30 s、72 ℃ 40 s,共30个循环,然后72 ℃ 8 min。使用2-ΔΔCt法计算基因相对表达水平,每组实验重复3次。白细胞介素(interleukin,IL)-1β、IL-6、 IL-8、 α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、转化生长因子β(transforming growth factor β,TGF-β)、CXC基序趋化因子配体12(CXC-motif chemokine ligand 12,CXCL12)、Ⅰ 型胶原蛋白α1链(collagen type Ⅰ alpha 1 chain,COL1A1)、Ⅲ型胶原蛋白α1链(collagen type Ⅲ alpha 1 chain,COL3A1)、Ⅳ型胶原蛋白α1链(collagen type Ⅳ alpha 1 chain, COL4A1)、GAPDH基因引物序列见表1。

表1 引物序列
1.7 Western blot检测 取MCF10A exo组、MDA-MB-231 exo组、MCF-7 exo组、PBS组的MRC-5细胞(1×107个),置于离心管中,每管加入200 μL RIPA蛋白裂解液和2 μL PMSF蛋白酶抑制剂,冰上裂解30 min后,4 ℃下12 000 r/min离心10 min,取上清,即为细胞总蛋白。根据BCA蛋白定量试剂盒进行定量,定量后将各组蛋白加入上样缓冲液煮沸30 min,使蛋白样品充分变性,然后进行SDS-PAGE电泳及转膜,用5%的脱脂牛奶对聚偏二氟乙烯膜封闭2 h,然后以1 ∶1 000比例稀释后的HSP70、TSG101、CD9、CD81、p-NF-κB、NF-κB、IκB-α、GAPDH一抗4 ℃孵育过夜,TBST洗膜3次,每次15 min,使用山羊抗兔IgG(1 ∶1 000稀释)室温孵育1.5 h,再用TBST洗膜3次,15 min/次,按照ECL试剂盒说明书配置发光液,并将聚偏二氟乙烯膜浸入发光液中反应30 s,曝光并拍照。用Image J软件对条带灰度值进行半定量分析,每组实验重复3次。
1.8 统计学分析 采用SPSS 22.0软件进行统计分析。计量资料以(x±s)表示,多组间比较使用单因素方差分析,两组间比较采用LSD-t法。以P<0.05为差异具有统计学意义。
2 结 果
2.1 乳腺癌细胞干预后各组成纤维细胞的迁移能力 MRC-5+MCF-7组与MRC-5+MDA-MB-231组MRC-5细胞的迁移能力均高于MRC-5+PBS组与MRC-5+MCF10A组(均P<0.05);而MRC-5+PBS组与MRC-5+MCF10A组、MRC-5+MCF-7组与MRC-5+MDA-MB-231组的MRC-5细胞迁移能力比较,差异均无统计学意义(均P>0.05)。见表2和图1。

表2 乳腺癌细胞干预后4组迁移细胞数量的比较(x±s,个)

图1 乳腺癌细胞干预后各组MRC-5细胞的迁移能力 (结晶紫染色,×10)
2.2 乳腺癌细胞干预后各组炎症因子及肿瘤相关成纤维细胞标志物的表达情况 与MRC-5+PBS组相比,MRC-5+MCF10A组MRC-5细胞中IL-1β、IL-6、IL-8、α-SMA、TGF-β、CXCL12、COL1A1、COL3A1、COL4A1的mRNA表达水平差异均无统计学意义(均P>0.05);MRC-5+MCF-7组和MRC-5+MDA-MB-231组MRC-5细胞中IL-1β、IL-6、IL-8、α-SMA、TGF-β、CXCL12、COL1A1、COL3A1、COL4A1的mRNA表达水平均较其他两组增加(均P<0.05),而MRC-5+MCF-7组和MRC-5+MDA-MB-231组的MRC-5细胞的上述指标的mRNA表达水平差异均无统计学意义(均P>0.05)。表3和表4。
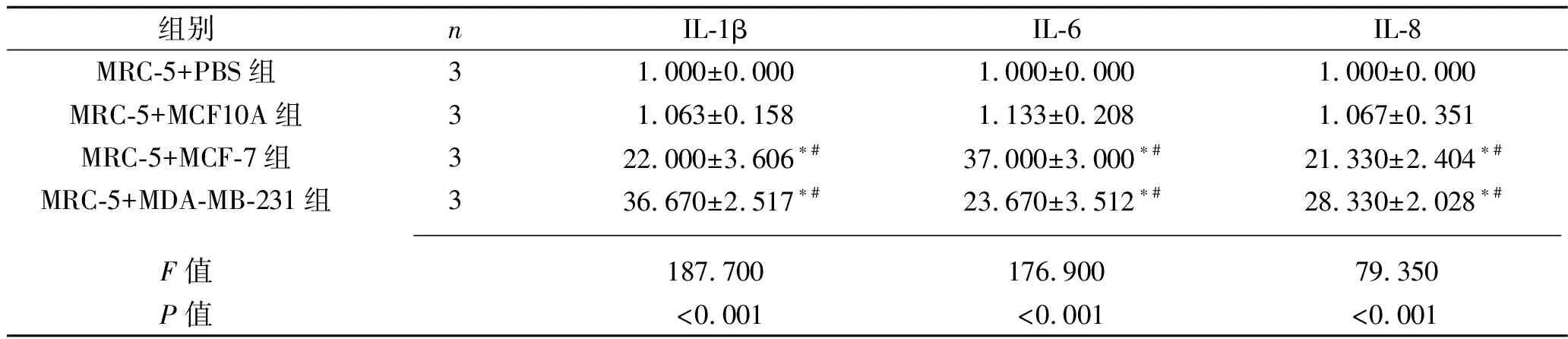
表3 乳腺癌细胞干预后4组炎症因子mRNA相对表达水平的比较(x±s)

表4 乳腺癌细胞干预后4组肿瘤相关成纤维细胞相关标志物mRNA相对表达水平的比较(x±s)
2.3 乳腺癌细胞和GW4869共同干预后各组成纤维细胞的迁移能力、炎症因子和肿瘤相关成纤维细胞标志物的表达情况 加入GW4869抑制乳腺癌外泌体的释放后,与MRC-5+PBS+GW4869组相比,其他3组MRC-5细胞的迁移能力变化差异无统计学意义(P>0.05),MRC-5细胞中IL-1β、IL-6、IL-8的mRNA表达水平差异无统计学意义(P>0.05),α-SMA、TGF-β、CXCL12、COL1A1、COL3A1、COL4A1 mRNA相对表达水平差异无统计学意义(P>0.05)。见表5、图2、表6、表7。

表5 乳腺癌细胞和GW4869干预后4组迁移细胞数量的比较(x±s,个)

图2 乳腺癌细胞+GW4869干预后各组MRC-5细胞的迁移能力(结晶紫染色,×10)

表6 乳腺癌细胞和GW4869干预后4组炎症因子mRNA相对表达水平的比较(x±s)
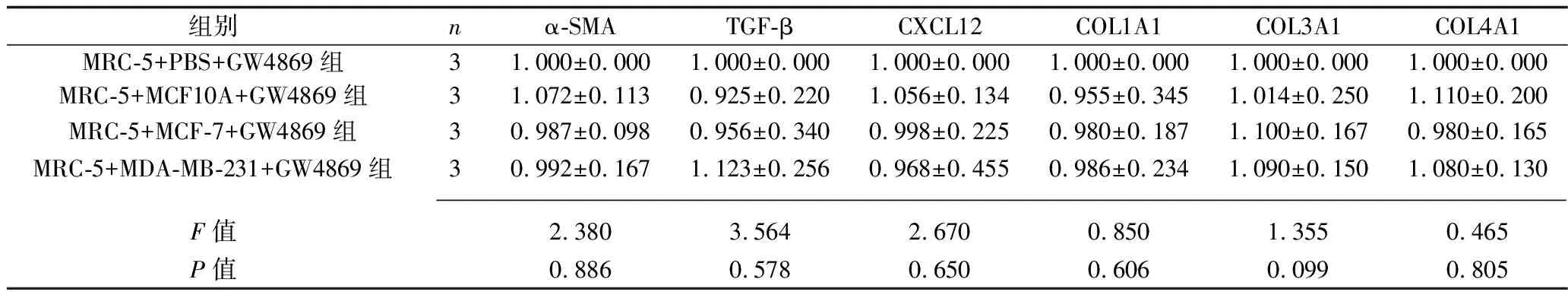
表7 乳腺癌细胞+GW4869干预后4组α-SMA、TGF-β、CXCL12、COL1A1、COL3A1、COL4A1 mRNA相对表达水平的比较(x±s)
2.4 外泌体鉴定结果 透射电镜观察外泌体形态结果,提取的外泌体粒径为50~100 nm,具有双层膜结果,形状呈“杯托样”,符合外泌体形态特征,见图3。使用Western blot检测外泌体标志蛋白的表达,结果显示,所提取的MCF10A、MCF-7、MDA-MB-231细胞所分泌的外泌体均表达HSP70、TSG101、CD9、CD81(见图4),可进行后续研究。

图3 透射电镜观察外泌体的形态特征
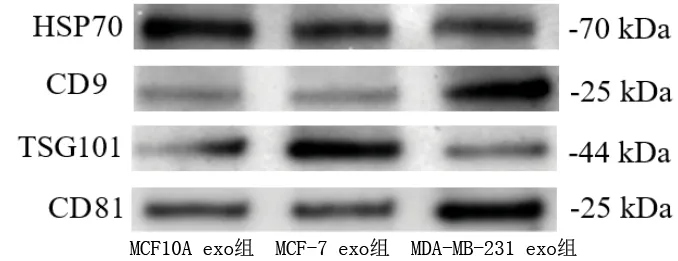
图4 各组外泌体标志蛋白的表达情况
2.5 乳腺癌细胞外泌体干预后各组成纤维细胞的迁移能力 与PBS组相比,MCF10A exo组细胞迁移能力变化差异无统计学意义(P>0.05);MCF-7 exo组和MDA-MB-231 exo组细胞迁移能力较其他两组提高(均P<0.05),而MCF-7 exo组和MDA-MB-231 exo组细胞迁移能力比较差异无统计学意义(P>0.05)。见表8和图5。

表8 乳腺癌细胞外泌体干预后4组迁移细胞数量的比较(x±s,个)

图5 乳腺癌细胞外泌体干预后MRC-5细胞的迁移能力(结晶紫染色,×10)
2.6 乳腺癌细胞外泌体干预后各组炎症因子和肿瘤相关成纤维细胞标志物的表达情况 与PBS组相比,MCF10A exo组的MRC-5细胞中IL-1β、IL-6、IL-8、α-SMA、TGF-β、CXCL12、COL1A1、COL3A1、COL4A1 mRNA表达水平均无统计学意义(均P>0.05);MCF-7 exo组和MDA-MB-231 exo组MRC-5细胞中IL-1β、IL-6、IL-8、α-SMA、TGF-β、CXCL12、COL1A1、COL3A1、COL4A1 mRNA表达水平均较其他两组增高(均P<0.05),但MCF-7 exo组和MDA-MB-231 exo组的MRC-5细胞上述指标的mRNA表达水平差异均无统计学意义(P>0.05)。见表9和表10。

表9 乳腺癌细胞外泌体干预后4组炎症因子mRNA相对表达水平的比较(x±s)

表10 乳腺癌细胞外泌体干预后4组肿瘤相关成纤维细胞标志物mRNA相对表达水平的比较(x±s)
2.7 乳腺癌细胞外泌体干预后各组成纤维细胞中NF-κB信号通路相关蛋白的表达 与PBS组相比,MCF10A exo组MRC-5细胞内p-NF-κB/NF-κB比值、IκB-α蛋白表达水平差异无统计学意义(均P>0.05);MCF-7 exo组和MDA-MB-231 exo组MRC-5细胞内p-NF-κB/NF-κB比值和IκB-α蛋白表达水平均较其他两组增加(均P<0.05),但MCF-7 exo组和MDA-MB-231 exo组的MRC-5细胞内p-NF-κB/NF-κB值、IκB-α蛋白表达水平差异无统计学意义(均P>0.05)。见表11和图6。

表11 各组细胞中NF-κB信号通路相关蛋白相对表达水平的比较(x±s)

图6 各组成纤维细胞NF-κB信号通路相关蛋白的表达情况
3 讨 论
肿瘤微环境是指肿瘤细胞存在的周围微环境,可在肿瘤的发生和发展过程中发挥重要的调控作用,参与肿瘤的生长、转移、免疫逃逸等病理过程[9]。肿瘤微环境组成复杂,主要包括内皮细胞、免疫细胞、成纤维细胞等,其中肿瘤相关成纤维细胞是肿瘤微环境中最主要的基质细胞,占到肿瘤组织细胞总数的50%左右,能够与肿瘤细胞通过直接接触或通过旁分泌的方式分泌多种细胞因子和代谢产物,促进肿瘤的发生和发展[10-11]。研究表明,肿瘤相关成纤维细胞主要是由肿瘤组织中的成纤维细胞转化而来[8,12],并且具有遗传稳定性,针对肿瘤相关成纤维细胞的靶向治疗具有更低的肿瘤复发和耐药风险[13-14]。因此,同时靶向肿瘤细胞和肿瘤相关成纤维细胞的组合疗法有望成为提高肿瘤治疗效果并克服治疗抗性的新策略。
本研究中,我们先将乳腺上皮细胞和乳腺癌细胞分别与成纤维细胞MRC-5共孵育,结果显示,与乳腺癌细胞共孵育后,MRC-5细胞的迁移能力增加,炎症因子IL-1β、IL-6、IL-8和肿瘤相关成纤维细胞的标志物α-SMA、TGF-β、CXCL12、COL1A1、COL3A1、COL4A1的mRNA表达均上调,说明乳腺癌细胞可诱导成纤维细胞向肿瘤相关成纤维细胞转化,而上述标志物的高表达又可促进肿瘤的生长和转移[15]。
肿瘤外泌体可通过多种途径调控肿瘤的发生与发展,已有多项研究报告其可通过诱导肿瘤相关成纤维细胞的形成而促进肿瘤的生长和转移。例如,肺癌细胞外泌体能够通过诱导肿瘤相关成纤维细胞的形成而促进肺癌的肝转移[15];黑色素瘤细胞外泌体能够激活SOCS1/JAK2/STAT3信号通路而诱导肿瘤相关成纤维细胞的形成[16];乳腺癌细胞外泌体能够通过转移miR-146a而诱导肿瘤相关成纤维细胞的激活进,从而促进肿瘤的侵袭和转移[17]。为了探究乳腺癌细胞对肿瘤相关成纤维细胞的作用是否由外泌体所引起的,本研究在肿瘤细胞和MRC-5共孵育的同时加入外泌体摄取抑制剂GW4869,结果显示,加入外泌体抑制剂GW4869后,相较于与PBS、正常乳腺上皮细胞共孵育的MRC-5细胞,与肿瘤细胞共孵育的MRC-5细胞的迁移能力并无差异,炎症因子和肿瘤相关成纤维细胞标志物的表达亦无差异,因此我们推测乳腺癌细胞通过外泌体诱导成纤维细胞向肿瘤相关成纤维细胞转化。本研究提取了乳腺上皮细胞和肿瘤细胞所分泌的外泌体,通过透射电镜观察发现所提取的外泌体外泌体粒径为50~100 nm,具有双层膜结果,形状呈“杯托样”,并且表达外泌体标志蛋白HSP70、TSG101、CD9、CD81,符合外泌体形态特征。将上述外泌体与MRC-5细胞共孵育,发现乳腺癌细胞外泌体可提高MRC-5细胞的迁移能力,且可上调IL-1β、IL-6、IL-8、α-SMA、TGF-β、CXCL12、COL1A1、COL3A1、COL4A1的mRNA表达,这进一步表明乳腺癌细胞外泌体具有促进成纤维细胞向肿瘤相关成纤维细胞转化的作用。
NF-κB是一种异二聚体蛋白,作为普遍存在的核转录因子介导细胞质/核信号通路,可调节各种细胞因子的基因表达,参与炎症和免疫反应[18]。NF-κB信号通路的激活可促进癌症、糖尿病、心血管疾病的发展[19]。研究表明,NF-κB信号通路的激活可促进肿瘤相关成纤维细胞的形成[20]。例如,在卵巢癌中,NF-κB信号通路的激活可促进肿瘤相关成纤维细胞的形成[21]。已有多项研究表明,肿瘤外泌体可激活NF-κB信号通路,例如乳腺癌细胞外泌体可激活NF-κB信号通路[22],食管癌外泌体可激活TLR7/NF-κB/c-Myc信号通路[23]。因此,本研究探究了乳腺癌细胞分泌的外泌体是否亦可激活NF-κB信号通路。结果显示,MCF-7 exo组和MDA-MB-231 exo组MRC-5细胞内NF-κB磷酸化水平和IκBα蛋白表达水平均高于其他两组,说明乳腺癌细胞MCF-7和MDA-MB-231所分泌的外泌体能够显著激活NF-κB信号通路。
综上所述,乳腺癌细胞外泌体可能通过激活NF-κB信号通路而促进成纤维细胞向肿瘤相关成纤维细胞的转化,但外泌体中何种物质发挥调控作用,还需深入探究。
