宁夏地区犊牛腹泻型产ESBLs大肠埃希氏菌的筛选及相关基因型分析
2022-07-31高海慧扈宁霞王培柱吴学青康晓冬
高海慧,汪 洁,扈宁霞,王培柱,吴学青,康晓冬*
(1.宁夏农林科学院动物科学研究所,宁夏银川 750002;2.陕西榆林市绥德县名州区农牧业综合服务站,陕西绥德 718000;3.宁夏吴忠市利通区扁担沟镇畜牧兽医工作站,宁夏吴忠 751100)
犊牛大肠埃希氏菌性腹泻是危害犊牛生长的重要疾病,严重者可导致死亡。在规模化奶牛场和肉牛场,抗菌药物是治疗该病的首选药物,宁夏地区牛只对阿米卡星敏感性最高[1]。由于长期用各种抗菌药物治疗,加之滥用严重,形成了大肠埃希氏菌耐药性日趋严重的状况。β-内酰胺酶是一种细菌产生的能水解β-内酰胺类抗菌药物的灭活酶,是细菌对β-内酰胺类抗菌药物耐药性的主要机制。超广谱β-内酰胺酶(ESBLs)主要存在于临床分离的革兰氏阴性杆菌,大肠埃希氏菌是产β-内酰胺的代表菌株,耐药基因可以通过转化、转导和接合等形式在细菌中传播扩散[2]。β-内酰胺类抗生素是使用广泛的治疗药物,导致大量β-内酰胺失活和β-内酰胺酶出现[3]。国际上研究认为,ESBLs和头孢菌素酶(Amp C)是较为活跃的2类β-内酰胺酶,尤其是在肠杆菌科细菌中起到较为重要的作用[4]。不同国家或地区兽医用药习惯、剂量不同,使得不同地区菌株的基因型和基因亚型存在差异,其所携带的某些耐药基因可能会通过水平转移的方式转移到人类,给临床治疗带来压力。ESBLs相关基因中主要流行的是TEM型,CTX-M型[3,5]。奶牛和肉牛是我区畜牧业重要的支柱产业,肉牛又是南部山区脱贫攻坚的主力军,本研究开展宁夏地区犊牛腹泻型产ESBLs大肠埃希氏菌筛选、耐药性调查与优势基因型分析,为犊牛腹泻型产ESBLs大肠埃希氏菌在宁夏地区的感染和流行情况提供资料,为明确大肠埃希氏菌ESBLs耐药基因的传播趋势,有效监控细菌耐药性,指导犊牛大肠杆菌病用药提供参考。
1 材料与方法
1.1 材料
1.1.1 样本 宁夏农林科学院动物科学研究所动物疫病防治实验室于2019年10月-2021年9月采集宁夏地区规模化牛场犊牛腹泻型肛门拭子180份,离心管收集,冰袋运输。
1.1.2 试剂与材料 伊红美蓝培养基EMB(批号:161119)、麦康凯培养基MAC(批号:161119)、MH 琼脂(批号:161021),青岛海博生物技术有限公司产品;4.5 mg/mL NaCl溶液,法国梅里埃公司产品;细菌基因组DNA提取试剂盒、DNA标准DL 2 000、DNA标准DL 1 200、2×TaqPCR MasterMix,天根生化科技(北京)有限公司产品;blaTEM、blaCTX-M-1、blaCTX-M-9、blaCTX-M、blaOXA、blaSHV基因扩增引物,生工生物工程(上海)技术服务有限公司合成;ESBLs测定盒(头孢他定(CAZ)、头孢噻肟(CTX)、头孢他定/克拉维酸(CAZ/clav))、头孢噻肟/克拉维酸(CTX/clav),杭州天和微生物试剂有限公司产品。

1.2 方法
1.2.1 大肠埃希氏菌的分离 将肛拭子于营养肉汤中37 ℃培养16 h~24 h,培养物接种于EMB、MAC,培养16 h~24 h,疑似菌镜检纯化,用于菌株的鉴定。
1.2.2 疑似菌的16S rRNA鉴定 将纯培养的大肠埃希氏菌,用灭菌生理盐水洗脱,吸取1.5 mL,用细菌基因组DNA提取试剂盒提取DNA,分装后,置-20 ℃保存备用。参考16S rRNA通用引物序列[7],PCR扩增反应体系为2×TaqPCR Master Mix 25 μL,DNA模板2.0 μL,上、下游引物各1 μL(10 μmol/L),ddH2O补足至50 μL。扩增条件为:95 ℃ 3 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 10 min,共循环30次;72 ℃ 10 min。阳性样品送公司测序,测得序列进行Blast比对。
1.2.3 大肠埃希氏菌ESBLs筛选 复壮保存的大肠埃希氏菌后,用麦氏比浊仪调整为0.5麦氏单位,接种于MH平板上,均匀涂布,采用双纸片协同法,将ESBLs测定盒中的CTX(30 μg)、CTX/CLA(30 μg/10 μg),CAZ(30 μg)、CAZ/CAL(30 μg/10 μg)两组,37 ℃过夜培养,比较加入克拉维酸与不加克拉维酸的抑菌直径≥5 mm者判定为产ESBLs菌株。
1.2.4 ESBLs引物的合成 参考文献[6-9]设计基因的特异性引物,由生工生物工程(上海)技术服务有限公司合成,序列见表1。
1.2.5 PCR检测blaCTX、blaCTX-M-9基因的PCR条件为:40 μL体系:2×TaqPCR Master Mix 10 μL,上、下游引物(10 μmol/L)各1 μL,DNA模板1 μL,ddH2O 17 μL;blaCTX-M-1、blaTEM、blaOXA、blaSHV基因的PCR条件为40 μL体系:2×TaqPCR Master Mix 10 μL,上、下游引物(10 μmol/L)各1 μL,DNA模板0.5 μL,ddH2O 17.5 μL。PCR条件为95 ℃ 5 min,95 ℃ 30 s,72 ℃ 30 s,共29个循环;72℃ 10min,退火温度见表1。

表1 基因检测引物序列及大小
2 结果
2.1 大肠埃希氏菌的16S rRNA鉴定
分离株在MAC上呈圆形、突起光滑、边缘整齐的粉色菌落,在EMB上呈具有金属光泽菌落,革兰氏染色可见红色、两端钝圆的杆菌。以疑似为E.coli的纯培养物DNA为模板,扩增分离株16 S rRNA基因,目的条带为370 bp,与预期条带一致(图1)。产物送测序,经Blast比对确定为大肠埃希氏菌。
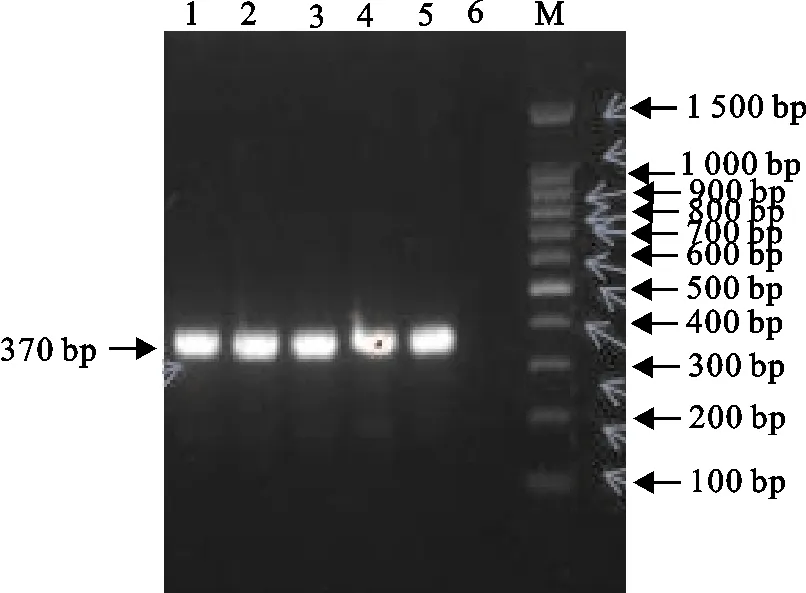
M.DNA 标准DL 1 500;1~5.分离菌株;6.阴性对照
2.2 ESBLs检测结果
测量抑菌圈直径分析显示,腹泻源性74株E.coli有51株为产ESBLs菌株,阳性率为68.92%。
2.3 相关基因检测结果
结果见表2和图2~图7。51株产ESBLs大肠埃希氏菌中,bla-TEM基因阳性率为100%(51/51),bla-CTX基因阳性率为100%(51/51),其中bla-CTX-M-1基因亚型株62.75%(32/51)、bla-CTX-M-9基因亚型株100%(51/51),bla-OXA基因阳性率为50.98%(26/51),bla-SHV基因阳性率为23.53%(12/51)。携带CTX+CTX-M-1+CTX-M-9+TEM基因的菌株占比最高,为21.57%。

表2 腹泻源产ESBLs大肠埃希氏菌β-内酰胺酶耐药基因型分布
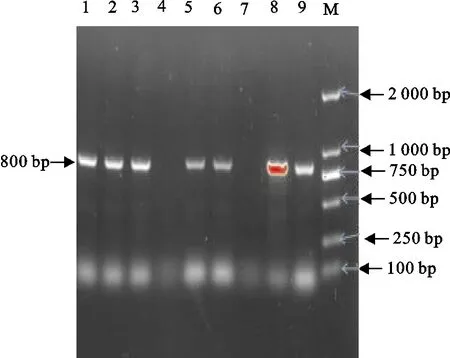
M.DNA 标准DL 2 000;1~9.分离菌株
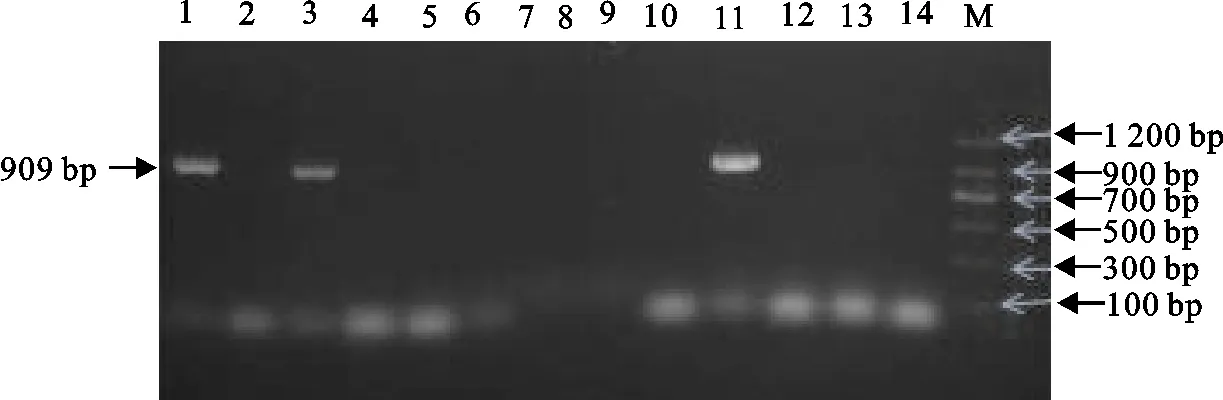
M.DNA 标准DL 1 200;1~14.分离菌株

M.DNA 标准DL 1 200;1~10.分离菌株
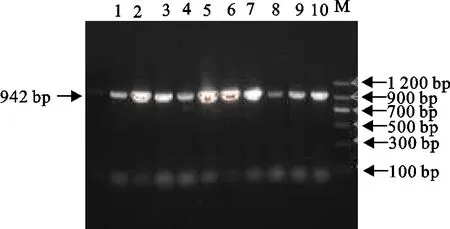
M.DNA 标准DL 1 200;1~10.分离菌株

M.DNA 标准DL 1 200;1~11.分离菌株

M.DNA 标准DL 600;1~13.分离菌株
3 讨论
大肠埃希氏菌肠道正常菌群,数量大,是维护肠道健康的重要菌群,这无疑加速了细菌耐药基因的产生、累积和转移[10],随着人医和兽医在治疗临床疾病中广泛使用第三代头孢菌素、单环β-内酰胺类抗菌药物,使得ESBLs菌株出现耐药及传播,通过环境污染,食用畜产品等途径威胁着人类健康。ESBLs主要由肠杆菌科产生,ESBLs使大肠埃希氏菌对新型广谱β-内酰胺类抗生素耐药性增加,ESBLs阳性株的出现会导致临床的高病死率及高比率持续性定殖,给临床治疗相关疾病带来挑战。
ESBLs基因型主要有blaTEM、blaSHV、blaCTX和blaOXA[11],本研究中51株产ESBLs大肠埃希氏菌中,优势基因型为bla-TEM、bla-CTX、bla-CTX-M-1、bla-CTX-M-9。bla-CTX型酶是近年来研究较多且流行较广泛的,分为CTX-M-1、CTX-M-9和KLUC等6组,每组又存在亚型,总数有150多种[11]。本研究中发现blaCTX-M-1基因亚型阳性率为62.75%,blaCTX-M-9基因亚型阳性率为100%。blaTEM来源于TEM-1和TEM-2基因序列发生突变造成1个~5个氨基酸改变而形成的一系列酶,本研究中bla-TEM基因阳性率为100%,TEM-1基因是目前革兰氏阴性菌中流行范围最广、检出率最高的TEM基因亚型。OXA型ESBLs国内外文献报道主要存在于铜绿假单胞菌和鲍曼不动杆菌中[12],而在肠杆菌科细菌中所占比例较少,本研究中blaOXA基因检出率为50.98%,与报道有一定差异。SHV型是较早发现的酶型之一,且产SHV型ESBLs的菌株日益增多,对第三代头孢菌素等呈现多重耐药现象,给临床抗感染治疗带来很大的困难,已引起世界各地高度重视[13],本研究中bla-SHV基因阳性率为23.53%,相对其他基因型检出率最低。据有关报道,blaCTX型和TEM型或SHV型的同源性较低,仅为40%[14-15]。本研究中腹泻源产ESBLs大肠埃希氏菌携带CTX+CTX-M-1+CTX-M-9+TEM基因型的菌株占比最高(21.57%)。
宁夏地区犊牛腹泻型产ESBLs菌株检出率高,提示我区牛场中产ESBLs菌株流行普遍。牛源ESBLs大肠埃希氏菌携带的某些耐药基因,可能会通过复制、变异、水平转移等方式传递到人类的致病菌中,有重要公共卫生意义,应定期开展ESBLs监测,平时生产实践中减少抗菌药物的使用。
