Kaiser评分与表观扩散系数评价乳腺病灶的对比研究
2022-07-30潘佳玲李晓虹陈新杰邓凌达杜勇兴陈海雄杨少民胡秋根郭保亮
潘佳玲,李晓虹,陈新杰,邓凌达,杜勇兴,陈海雄,杨少民,2,胡秋根,郭保亮*
乳腺癌发病率居女性恶性肿瘤之首,是女性癌症死亡的主要原因之一[1-2]。MRI是乳腺癌的重要诊断工具[3-5],随着MRI的广泛应用,MRI乳腺影像报告与数据分析系统(Breast Imaging Reporting and Data System,BI-RADS)在临床中得到了普遍认可[6]。但是,BI-RADS 没有提供利用乳腺病灶的影像特征进行临床决策的具体方法[7-8]。Kaiser 评分是基于机器学习算法而提出的决策树结构的评分方法[9-10],可为临床医生判断患者是否需要活检提供客观参考指标。表观扩散系数(apparent diffusion coefficient,ADC)是水分子扩散运动的量化指标[11],乳腺恶性病灶的ADC低于良性病灶及正常乳腺组织[12-13],目前ADC已广泛用于评估乳腺病灶。Kaiser评分和ADC[12-13]均可用于鉴别乳腺良恶性病灶、指导临床决策。但是,目前国内外关于联合应用两者能否提高诊断价值的文献报道少见,Meng 等[14]探讨了此类问题,但是其研究主要应用于BI-RADS 4 类病灶,也未探讨Kaiser 评分在肿块及非肿块强化病灶中的差异。故本项研究分析了Kaiser 评分、ADC 及两者联合应用在肿块及非肿块强化病灶中价值,旨在比较Kaiser 评分和ADC在对乳腺病灶的诊断效能及其降低非必要活检的能力,为患者个性化治疗方案的制订提供客观参考指标。
1 材料与方法
1.1 研究对象
本研究为回顾性研究,经南方医科大学顺德医院医学伦理委员会批准,免除受试者知情同意,批准文号:20200910。回顾性分析2019年1月至2021年9月在南方医科大学顺德医院行乳腺MRI检查的患者资料,纳入标准:(1) MRI检查前未行乳腺手术及放化疗;(2)病灶经穿刺或手术活检,病理结果完整。排除标准:(1)图像质量欠佳,如运动伪影过重图片不能用于诊断分析或无法测量ADC 值者;(2)临床、MRI 影像资料不完整者。
1.2 设备及参数
采用Siemens Magnetom skyra 3.0 T 超导MR 扫描仪及4 通道相控阵乳腺线圈,患者取仰卧位,双侧乳房自然下垂。扫描序列包括:T1WI序列:TR 5.4 ms,TE 2.5 ms,层厚4 mm,视野(FOV) 330 mm×330 mm;T2WI 及T2WI 压脂序列:TR 5630 ms,TE 81 ms,层厚4 mm,FOV 210 mm×470 mm;DWI序列:TR 6370 ms,TE 62 ms,层厚5 mm,FOV 190 mm×340 mm,b 值取0、800 s/mm2。常规扫描后行动态增强扫描,静脉注射钆喷酸葡胺(马根维显,德国Bayer 公司),剂量为0.2 mL/kg,注射速度约2 mL/s,扫描参数:TR 5.6 ms,TE 2.1 ms,FOV 200 mm×530 mm,连续扫描6期。
1.3 图像分析
采用SYNGO Via 软件对图像进行后处理。影像分析采用双盲法由2 名有5 年以上乳腺MRI 诊断经验的放射科医师进行阅片,评估内容包括病灶类型、大小、边缘、内部强化特征、周围水肿情况、时间信号强度曲线(time intensity curve,TIC)的类型,意见不一致时协商解决。ADC 值的测量:结合增强及DWI图像,在ADC图上选取病变的最大层面同时避开坏死、囊变、出血区勾画ROI (平均大小为5~10 mm2),测量三次,最终结果取平均值。按照Kaiser 评分、KS+评分规则分别计算每个病灶的分值,范围为1~11,评分规则见图1、2,病例图像见图3、图4。据以往的研究发现,Kaiser 评分[9-10]最佳阈值为4,Kaiser 评分大于4 时,病灶存在恶性可能,建议病理活检;ADC 最佳阈值[15]为1.26×10-3mm2/s,ADC小于等于1.26×10-3mm2/s 时,病灶存在恶性可能,建议病理明确。

图1 Kaiser评分流程图。
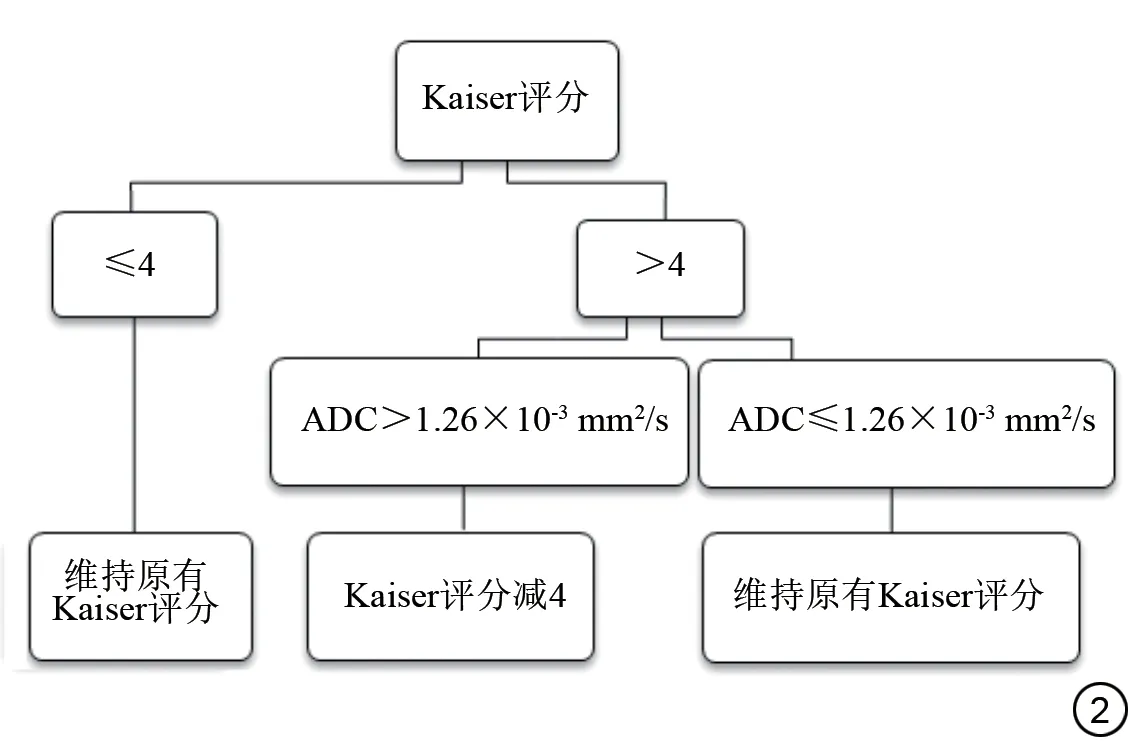
图2 KS+评分流程图。
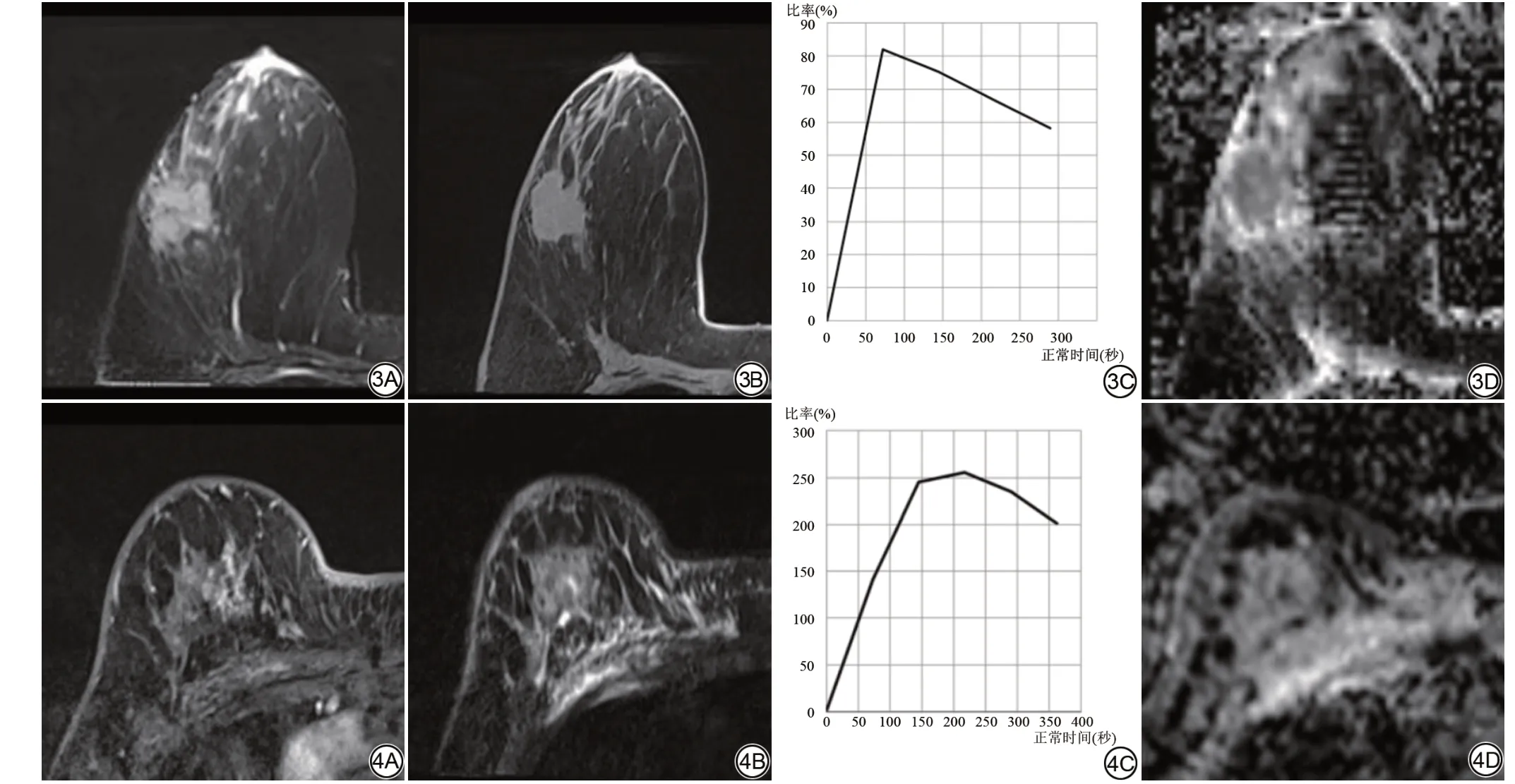
图3 女,24 岁,右乳肿块,T2WI-FS (3A)、T1WI 图像(3B)、TIC 图(3C)、ADC 图(3D)示病灶边缘多发毛刺,周围见水肿,TIC 呈流出型,Kaiser 评分为11 分,ADC 为0.97×10-3 s/mm2,KS+评分11 分,均提示恶性病灶,最终病理为浸润性导管癌。 图4 女,62 岁,右乳异常强化灶,动态增强早期图像(4A)、T2WI-FS(4B)、TIC 图(4C)、ADC 图(4D)示病灶边缘多发毛刺,右乳弥漫性水肿,TIC 呈流出型,Kaiser 评分为11 分,ADC 为1.29×10-3 s/mm2,KS+评分7 分,Kaiser评分及KS+评分提示恶性病灶,ADC 考虑良性病灶,最终病理为浸润性导管癌。注:T2WI-FS:T2 增强抑脂序列;TIC:时间信号强度曲线;ADC:表观扩散系数;KS+评分:Kaiser评分联合ADC。
1.4 统计学方法
采用Medcalc 20和SPSS 26.0进行数据分析。Kolmogorov-Smirnov检验对计量资料进行正态性检验,正态分布资料用±s 表示,不符合正态分布的资料用M (P25,P75)表示。采用Mann-WhitneyU检验比较乳腺良恶性病灶的Kaiser 评分、ADC值。计算Kaiser 评分、ADC、KS+评分的AUC、准确度、敏感度、特异度,AUC 通过Delong 检验进行比较,敏感度、特异度通过McNemar 检验进行比较。P<0.05 时差异有统计学意义。
2 结果
2.1 患者一般资料
2019 年1 月至2021 年9 月间行乳腺MRI 检查的患者257 例,有手术及放化疗史者41 例,缺乏病理资料者68 例,影像资料不完整者21 例,本研究最终纳入患者127 例,均为女性,年龄18~82 (47.3±12.9)岁,共134 个病灶(其中7 例患者有2 个病灶),大小5~146 (31.0±26.1) mm,其中肿块强化病灶88 个,非肿块强化病灶46 个。恶性病变87 个,其中63 个病变为浸润性导管癌(63/87,72.4%),其中1 个病变为浸润性乳腺癌伴黏液癌、1 个病变为浸润性导管癌合并小叶癌,13 个病变为导管原位癌伴或不伴微浸润(13/87,14.9%);良性病变47 个,25 个为纤维囊性乳腺病(25/47,53.2%),其中1 个病变为纤维囊性乳腺病伴纤维腺瘤、2个病变为纤维囊性乳腺病伴导管内乳头状瘤,13个病变为例纤维腺瘤(13/47,27.7%)。
2.2 乳腺良、恶性病变Kasier评分分值、ADC值的差异
恶性病灶Kaiser 评分[6 (5,8)]高于良性病灶Kaiser 评分[3 (2,4)],差异有统计学意义(P<0.001)。恶性病灶ADC[0.80×10-3s/mm2(0.67×10-3s/mm2,0.90×10-3s/mm2)]低于良性病灶ADC [1.14×10-3s/mm2(0.92×10-3s/mm2,1.34×10-3s/mm2)],差异有统计学意义(P<0.001),见图5A、5B。

图5 乳腺良、恶性病变Kasier评分(5A)、ADC值(5B)差异分析箱体图。
2.3 Kaiser评分、ADC、KS+评分对乳腺病灶的诊断效能
Kaiser评分AUC优于ADC,差异有统计学意义(P=0.0404),两者AUC最大差异在于非肿块病变。KS+的AUC优于ADC,差异有统计学意义(P=0.0400)。Kaiser 评分与KS+的AUC 差异无统计学意义(P=0.7604),见图6、表1。

表1 Kaiser评分、ADC、KS+评分诊断效能比较

图6 Kasier评分、ADC值、Kasier评分联合ADC(KS+评分)对乳腺病灶的ROC分析。6A:Kaiser评分、ADC、KS+评分对所有乳腺病灶的ROC图;6B~6D:分别为Kaiser评分、ADC、KS+评分对乳腺肿块及非肿块强化病灶的ROC图。注:ADC:表观扩散系数;KS+评分:Kaiser评分联合ADC。
2.4 Kaiser评分、ADC、KS+评分降低非必要活检的能力
Kaiser 评分、ADC、KS+评分结果与病理结果对比见表2。Kaiser评分的特异度优于ADC,差异有统计学意义(P=0.0215)。Kaiser 评分与ADC 的敏感度差异无统计学意义(P=0.6875)。KS+评分的特异度优于ADC,差异有统计学意义(P<0.001)。KS+评分与ADC 的敏感度差异无统计学意义(P=0.375)。Kasier 评分与KS+评分的敏感度差异无统计学意义(P>0.500),Kasier 评分与KS+评分的特异度差异无统计学意义(P>0.999),见表3。
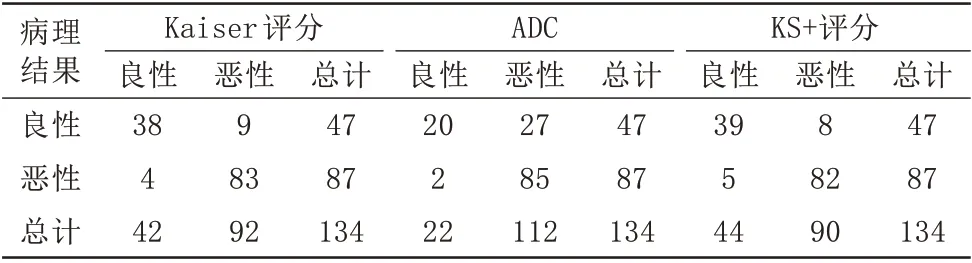
表2 Kaiser评分、ADC、KS+评分结果与病理结果对比
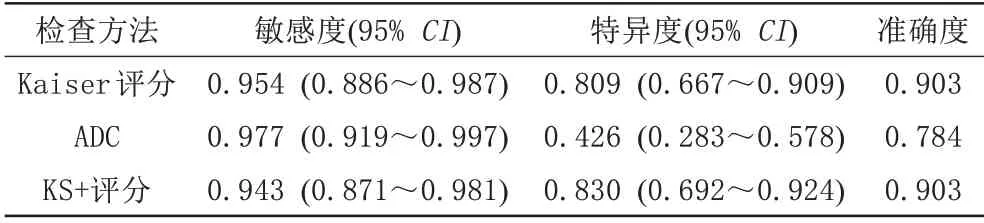
表3 Kaiser评分、ADC、KS+评分降低非必要活检的能力
3 讨论
Kaiser 评分[9-10]通过机器学习算法从17 个影像特征中筛选了5 个影像特征评估乳腺病灶的恶性可能,病灶分值越高,恶性可能性越大。本研究比较了Kaiser 评分、ADC 及两者联合应用的诊断价值,发现Kaiser 评分的诊断价值优于ADC,联合应用Kaiser评分及ADC不能提高诊断效能。通过分组分析发现在非肿块强化病灶中Kaiser 评分的AUC 最佳,Kaiser 评分在非肿块强化病灶的诊断中具有优势。本研究通过计算Kaiser评分、ADC、两者联合应用的敏感度、特异度比较了其降低非必要活检能力,发现Kaiser 评分同时具有高敏感度、高特异度,更适用于临床,可为临床医生判断患者是否需要活检提供客观参考指标。
3.1 Kaiser评分与ADC的诊断效能分析
本研究结果显示,良恶性病灶的Kaiser 评分值、ADC 值差异有统计学意义,两者均可用于良恶性病灶的鉴别,Kaiser评分对乳腺病灶的诊断效能优于ADC。这可能是因为Kaiser 评分[9-10]包含的五个影像特征均侧面反映了乳腺病灶的异质性。其中根征及边缘情况反映了病灶的形态学特点,TIC类型及内部强化特征反映了病灶的血流动力学特征。灶周水肿与乳腺癌的肿瘤微环境密切相关,提示淋巴转移的风险增加[16]。Kaiser评分综合分析乳腺病变,ADC仅通过水分子扩散受限情况评估乳腺病灶,存在一定的局限性。通过分组分析,发现两者AUC 在非肿块病变中差异最大,这与Jajodia 等[17]研究中Kaiser评分在乳腺非肿块病灶中有较高的诊断效能相一致,但是本研究中Kaiser 评分在非肿块病灶中的AUC 为0.900,而Jajodia的研究中其AUC仅为0.715,原因可能是其研究纳入对象为钼靶或者乳腺MRI诊断不明确的病例,诊断的难度更大。
3.2 联合应用Kaiser和ADC的诊断效能分析
联合应用Kaiser评分和ADC无法提高诊断效能,与Meng等[14]研究一致,但是本研究进一步发现Kaiser评分与KS+评分在肿块强化病灶中AUC一致,在非肿块病灶中Kaiser评分的AUC稍高于KS+评分。分析其原因可能如下:第一,ADC受较多因素的干扰,一方面患者的脉搏、呼吸、乳腺病灶中细胞间质成分、内部结构等均可影响ADC值的大小,另一方面MRI扫描仪及DWI的采集参数的不同亦可影响ADC值[18];第二,由于ADC的图像分辨率低且存在几何失真,ADC在乳腺亚厘米级非肿块病灶中的诊断效能欠佳[11];第三,Kaiser评分的五个影像特征除边缘均与乳腺癌的诊断显著且独立相关,而ADC值在乳腺良恶性病灶中存在一定的重叠,特异性不高[19]。
3.3 Kaiser评分、ADC、KS+评分降低非必要活检能力的分析
本研究中,ADC、Kaiaer 评分及KS+评分的敏感度相仿,但是ADC 的特异度仅为42.6%,明显低于Kaiser 评分及KS+评分。与Kaiser 评分相比,KS+评分可以多减少一例非必要活检,但同时也会产生一例假阴性结果。回顾性分析此假阴性病灶表现为非肿块样强化病灶,Kaiser 评分为5,建议病理活检;ADC 为1.8×10-3mm2/s,KS+评分为1,不建议进一步检查,最终病理结果为导管内原位癌。这可能与导管内原位癌的病理特征有关,导管内原位癌肿瘤血管密度低且血管化程度不一[20],而TIC 类型与肿瘤血管化程度密切相关[21],故导管内原位癌TIC 曲线表现多样;导管内原位癌细胞密度低,纤维间质多,水分子扩散受限不明显,ADC 值减少有限[22-23]。此外,此病灶表现为非肿块强化病灶,无明确边界,其内夹杂脂肪和腺体组织,ADC值的测量可能存在误差。
3.4 本研究的局限性
本研究存在一定的局限性。第一,本研究为回顾性分析,可能会导致病例选择和统计学偏倚;第二,本研究中部分病例的病理结果为穿刺活检结果,穿刺位置与ADC的ROI位置不能完全匹配,ADC可能存在一定的误差;第三,本研究的样本数量有限,且良性病变数较少,有待进一步扩大样本量。
综上所述,Kaiser 评分和ADC 均用于鉴别乳腺良恶性病灶,但Kaiser 评分的诊断效能明显优于ADC,其在诊断非肿块强化病变时具有显著性。Kaiser评分能减少非必要的活检的能力亦优于ADC,联合应用Kaiser评分和ADC无法提高诊断效能及降低非必要活检能力,Kaiser评分更适用于临床实践。
作者利益冲突声明:全体作者均声明无利益冲突。