固相萃取-离子色谱法测定人尿液中钙、镁、氟、磷酸根离子
2022-07-29韩晓鸥余波刘顺鑫曹忠波
韩晓鸥,余波,刘顺鑫,曹忠波
(辽宁省疾病预防控制中心,辽宁省环境与人群健康监测重点实验室,沈阳 110005)
尿液是人体日常生成且排泄量最大的代谢液体,包含大量人体代谢和疾病相关信息。尿液分析检测是对多种疾病诊断和职业中毒与职业病防护临床基础检验的重要内容。
钙、镁、磷是人体内重要的矿物元素。钙参与人体骨骼构成、血液凝固、肌肉收缩、神经信号传导等生理功能[1]。镁是钙拮抗剂。磷及其化合物进入人体后,在体内被分解为无机磷,主要通过肾脏随尿液排出体外。检测人体内钙、镁、磷代谢情况对多种疾病诊断治疗、职业危害及防护具有重要意义[2]。钙、镁、磷测定方法主要有络合滴定法[3]、电极法[4-6]和原子吸收光谱法[7-11]等,上述方法操作复杂,受干扰因素较多,容易导致测定结果失准[12]。氟是人体所必需的微量元素之一,人体中氟的含量偏低或偏高均有一定危害,正常成年人每日需摄入1~2 mg 的氟,当氟的摄入量超过4~5 mg 时,会导致氟在体内蓄积。生产环境中氟及氟化物主要经呼吸道和皮肤进入体内,贮存在骨、软骨和牙齿中,少部分贮存在肾及脾内,体内过量的氟化物有85%左右通过尿液排出,故尿液中氟化物含量的高低是诊断氟化物中毒的重要参考指标之一[13]。目前尿液中氟的检测方法主要有离子选择电极法[14]和离子色谱法[15-16]。
笔者建立了固相萃取-离子色谱法测定尿液中的钙、镁、氟、磷(以磷酸根计)离子,该方法操作简单,测定结果准确、可靠,可用于人尿液中钙、镁、氟、磷离子浓度的检测,对于了解人体代谢规律具有重要意义。
1 实验部分
1.1 主要仪器与试剂
离子色谱仪:ICS5000+型,美国热电公司。
台式冷冻离心机:Sorvall ST 16R 型,美国热电公司。
超纯水机:MILLI-Q Gradient 型,美国密理博公司。
低温冰箱:BCD-256WDGK 型,控温范围为-25~10 ℃,控温精度为1 ℃,中国海尔集团。
固相萃取小柱:(1) C18柱(500 mg/3 mL);(2) C18柱(500 mg/6 mL),美国热电公司。
甲醇:色谱纯,美国费希尔公司。
钙离子、镁离子、氟离子标准溶液:质量浓度均为1 000 mg/L,编号分别为GBW(E) 080118、GBW(E) 080126、GBW(E) 080549,中国计量科学研究院。
磷酸根离子标准溶液:500 mg/L,编号为BW2015-1000-20,坛墨质检-标准物质中心。
实验用水为超纯水,由MILLI-Q Gradient 型超纯水机制备。
1.2 仪器工作条件
1.2.1 氟、磷酸根离子检测
保护柱:AG15 柱(50 mm×4 mm,美国热电公司);分析色谱柱:AS15 柱(250 mm×4 mm,美国热电公司);抑制器:AERS500 型阴离子抑制器4 mm;检测器:电导检测器;进样体积:100 μL;淋洗液:KOH 溶液,流量为1.0 mL/min;洗脱方式:梯度洗脱,洗脱程序见表1。
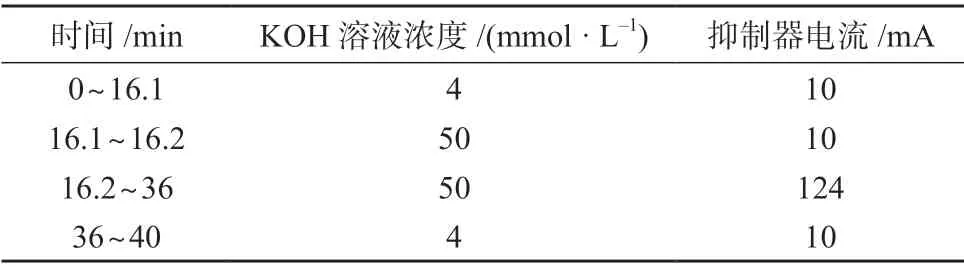
表1 梯度淋洗程序
1.2.2 钙、镁离子检测
保护柱:CG12 柱(50 mm×4 mm,美国热电公司);分析色谱柱:CS12A 柱(250 mm×4 mm,美国热电公司);检测器:电导检测器;抑制器:CERS500型阳离子抑制器4 mm;淋洗液:20 mmol/L 甲基磺酸溶液,流量为1.0 mL/min;抑制电流:59 mA;进样体积:25 μL;淋洗方式:等度淋洗。
1.3 溶液配制
钙、镁离子标准使用液:100.0 mg/L,准确吸取钙、镁离子标准溶液各1 mL,分别置于10 mL 容量瓶中,用超纯水定容至标线,混匀。
氟离子标准使用液:1.0 mg/L,准确吸取氟离子标准溶液0.1 mL,置于100 mL 容量瓶中,用超纯水定容至标线,混匀。
磷酸根离子标准使用液:100.0 mg/L,准确吸取磷酸根离子标准溶液20 mL 于100 mL 容量瓶中,用超纯水定容至标线,混匀。
氟、磷酸根离子系列混合标准工作溶液:分别吸取氟离子标准使用液0.25、0.50、1.00、2.00、3.00、4.00、5.00 mL,磷酸根离子标准使用液1.25、2.5、5.0、10.0、20.0、40.0、50.0 mL,置于7 只100 mL 容量瓶中,用超纯水定容至标线,混匀,配制成氟离子的质量浓度分别为0.002 5、0.005、0.01、0.02、0.03、0.04、0.05 mg/L,磷酸根离子的质量浓度分别为1.25、2.5、5.0、10.0、20.0、40.0、50.0 mg/L 的系列混合标准工作溶液。
钙、镁离子系列混合标准工作溶液:分别吸取0.25、0.5、1.0、2.0、4.0、8.0、10.0 mL 钙、镁离子标准使用液,置于7 只100 mL 容量瓶中,用超纯水定容至标线,混匀,配制成钙、镁离子的质量浓度均分别为0.25、0.5、1.0、2.0、4.0、8.0、10.0 mg/L 的系列混合标准工作溶液。
加标样品溶液:吸取一定量的尿液样品,置于100 mL 容量瓶中,分别加入100 μL 钙、镁离子标准溶液,5 μL 氟离子标准使用液,500 μL 磷酸根离子标准溶液,用超纯水定容至标线,混匀,配制成低质量浓度加标样品溶液;吸取一定量的尿液样品,置于100 mL 容量瓶中,分别加入400 μL 钙、镁离子标准溶液,20 μL 氟离子标准使用液,2 000 μL磷酸根离子标准溶液,用超纯水定容至标线,混匀,配制成中质量浓度加标样品溶液;吸取一定量的尿液样品,置于100 mL 容量瓶中,分别加入800 μL钙、镁离子标准溶液,40 μL 氟离子标准溶液,8 000 μL 磷酸根离子标准溶液,用超纯水定容至标线,混匀,配制成高质量浓度加标样品溶液。高、中、低3种质量浓度的加标样品溶液中钙、镁、氟、磷酸根离子的质量浓度见表2。
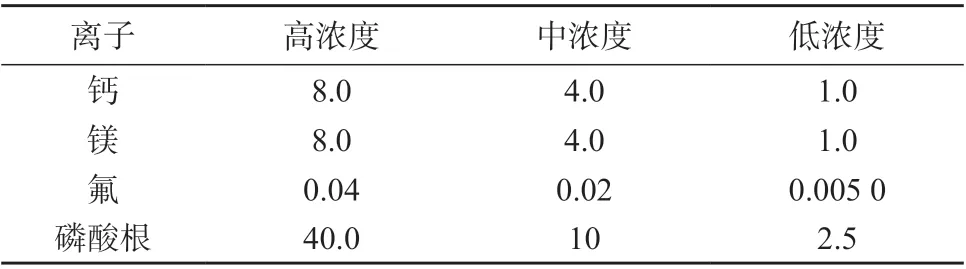
表2 加标样品溶液中钙、镁、氟、磷酸根离子的质量浓度 mg/L
1.4 实验方法
1.4.1 样品采集和保存
用聚丙烯材质采样瓶分别采集女性尿液和男性尿液各30 份,于-20 ℃冰箱中存放,48 h 内测定,若于-70 ℃冷冻保存,可保存一个月。
1.4.2 样品处理
从冰箱中取出尿液样品,常温下使其充分解冻,混匀。准确吸取2 mL 尿液样品于15 mL 离心管中,以5 000 r/min 转速于-4 ℃下离心10 min,取1 mL 上清液,用超纯水稀释至30 倍,备用。在固相萃取小柱中加入2 mL 甲醇和2 mL 超纯水进行活化。准确吸取6 mL 稀释后的尿液样品,加入活化处理后的固相萃取小柱中,弃去滤液。再吸取3.0 mL 稀释后的尿液样品加入上述固相萃取小柱中,使样品在重力作用下自然通过小柱,收集滤液,经0.22 μm 滤膜过滤后测定。
2 结果与讨论
2.1 色谱条件优化
2.1.1 色谱柱选择
色谱柱类型、淋洗液浓度和淋洗液流量对4 种待测离子的分离效果具有重要影响。在测定氟、磷酸根离子时,根据现有阴离子柱的工作原理和适用范围,分别考察AS19 和AS15 两种型号色谱柱的分离效果。结果表明,AS19 柱不能实现氟离子、磷酸根离子与尿液样品中其它杂质的完全分离;而AS15 色谱柱能够实现氟离子、磷酸根离子与尿液样品中其它杂质的完全分离,因此选择AS15 色谱柱为分离柱、AG15 色谱柱为保护柱测定氟、磷酸根两种阴离子。在测定钙、镁离子时,选择CS12A 色谱柱为分离柱、CG12 色谱柱为保护柱,可以实现基线分离,可用于测定钙、镁离子。
2.1.2 淋洗方式选择
在测定氟、磷酸根离子时,以KOH 溶液为淋洗液,分别考察等度洗脱和梯度淋洗时氟、磷酸根离子的分离效果。结果表明,采用等度洗脱时,氟离子与样品中其它杂质色谱峰的分离度均小于1,磷酸根与样品中其它杂质色谱峰的分离度均小于1.5,因此使用等度洗脱时,氟、磷酸根与样品中其它杂质不能有效分离;采用梯度洗脱时,调节KOH 溶液浓度,采用如下淋洗程序:0~10.1 min 时KOH 溶液浓度为4 mmol/L,10.1~13.2 min 时KOH 溶液浓度为50 mmol/L,13.2~30 min 时KOH 溶液浓度为50 mmol/L,30~40 min 时KOH 溶液浓度为4 mmol/L,流量为1.0 mL/min,氟离子与其它杂质的分离度为1.2,磷酸根与其它杂质的分离度为1.3,均小于1.5;改变KOH 溶液浓度,经优化,采用表1 淋洗程序,氟离子与其它杂质的分离度为6.2,磷酸根与其它杂质的分离度为2.0,均大于1.5,分离效果良好。
在测定钙、镁离子时,以20 mmol/L 甲基磺酸溶液为淋洗液,选择CS12A 色谱柱,采用等度淋洗模式即可使钙、镁离子与尿液中其它杂质的分离度达到3.07,实现完全分离。
2.2 样品处理方法
尿液成分复杂,其中含有蛋白质等有机物,以及阴、阳离子等人体代谢物质,是基质复杂的生物样品。测定尿液中离子含量的样品处理方法有直接稀释法和固相萃取法。直接稀释法样品中的有机代谢物质成分会滞留在离子色谱柱上,导致柱效降低或者直接损坏分离柱,从而影响色谱柱的使用寿命,因此选择固相萃取柱对样品进行预处理。
由于分离柱为离子色谱柱,淋洗液为水溶液,选择C18非极性色谱柱进行萃取,可有效去除杂质。按照1.4.2 方法,分别选择6 mL、3 mL 两种规格的C18固相小柱对高、中、低3 种质量浓度的加标样品溶液进行萃取,在1.2 仪器工作条件下分别平行测定6 次,计算测定结果的相对标准偏差,结果见表3。由表3 可知,采用两种规格的C18固相萃取小柱萃取时,4 种离子测定结果相对标准偏差均小于6%,但6 mL 小柱萃取时间短,为节约实验时间,选择6 mL C18固相小柱为样品处理萃取柱。
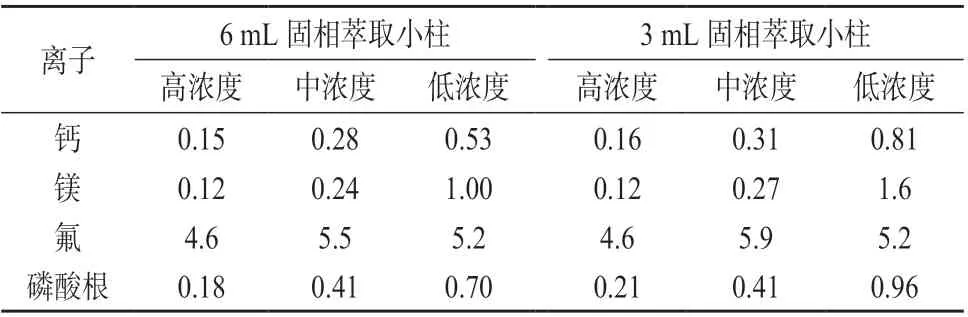
表3 不同固相萃取小柱萃取加标样品溶液时测定结果的相对标准偏差(n=6) %
2.3 色谱图
在优化的色谱条件下,氟、磷酸根离子混合标准溶液和钙、镁离子混合标准溶液以及加标样品溶液色谱图如图1~4 所示。由图1~4 可以看出,各组分之间分离效果良好,均达到基线分离,氟、磷酸根、钙、镁离子的分离度均大于1.5,可以用于定量测定。
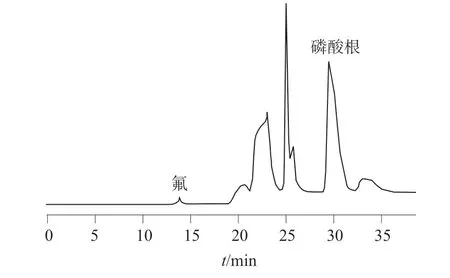
图1 氟、磷酸根离子混合标准溶液色谱图
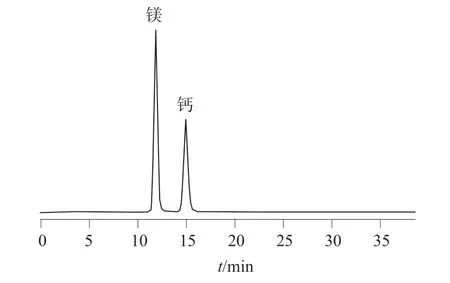
图2 钙、镁离子混合标准溶液色谱图
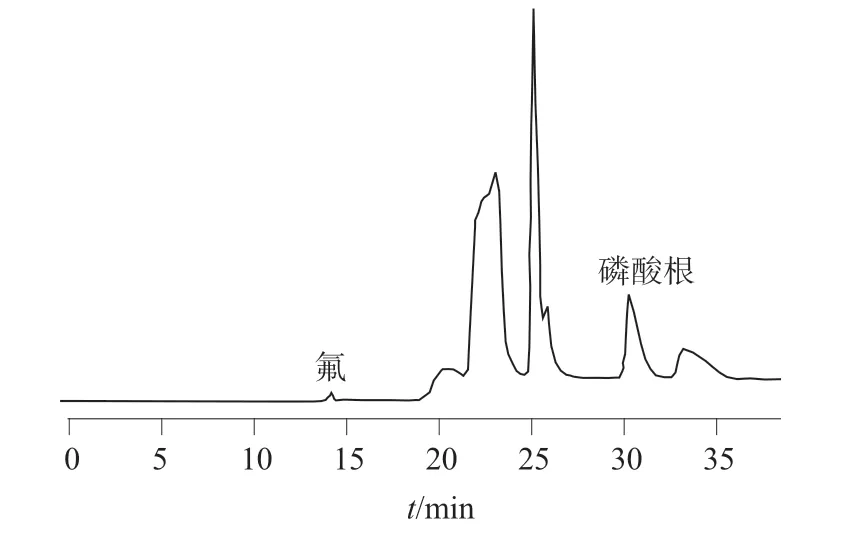
图3 加标样品溶液色谱图(氟、磷酸根离子)
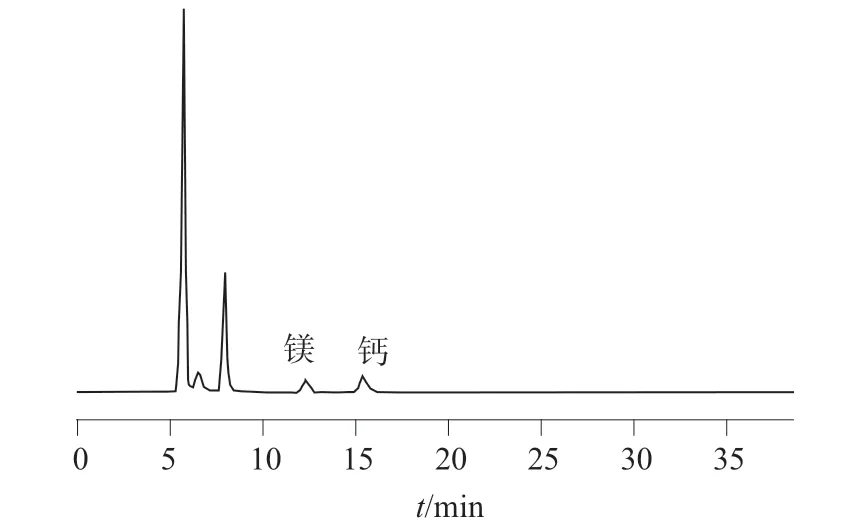
图4 加标样品溶液色谱图(钙、镁离子)
2.4 线性方程与检出限
在1.2 仪器工作条件下,分别对1.3 中的钙、镁离子系列混合标准工作溶液和氟、磷酸根离子系列混合标准工作溶液进行测定,以目标物质的质量浓度(X)为横坐标,以色谱峰面积(Y)为纵坐标,进行线性回归,计算线性方程和相关系数。在1.2 仪器工作条件下,对试剂空白进行11 次连续测定,以3倍标准偏差作为方法检出限。4 种离子的质量浓度线性范围、线性方程、相关系数及检出限见表4。由表4 可知,4 种离子的质量浓度与色谱峰面积线性关系良好,相关系数为0.999 2~0.999 9,可以通过外标法定量。

表4 质量浓度线性范围、线性方程、相关系数及检出限
2.5 加标回收与精密度试验
取高、中、低3 种质量浓度的加标样品溶液,按1.4.2 样品处理方法分别平行处理6 份,在1.2 仪器工作条件下进行测定,结果见表5。由表5 可知,3 种质量浓度水平加标样品的回收率为86.0%~99.5%,测定结果相对标准偏差为0.12%~5.50%,表明该方法测量准确度、精密度均较高,满足分析要求。
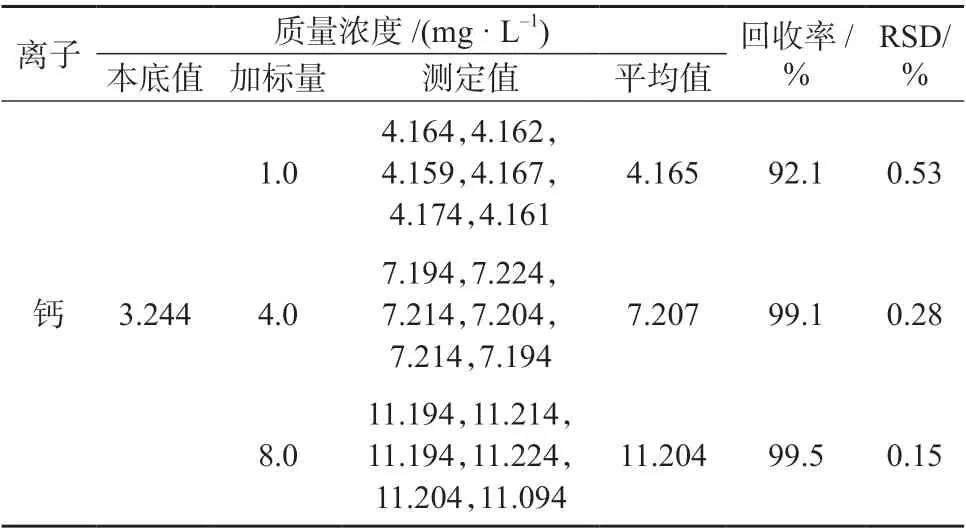
表5 加标回收与精密度试验结果
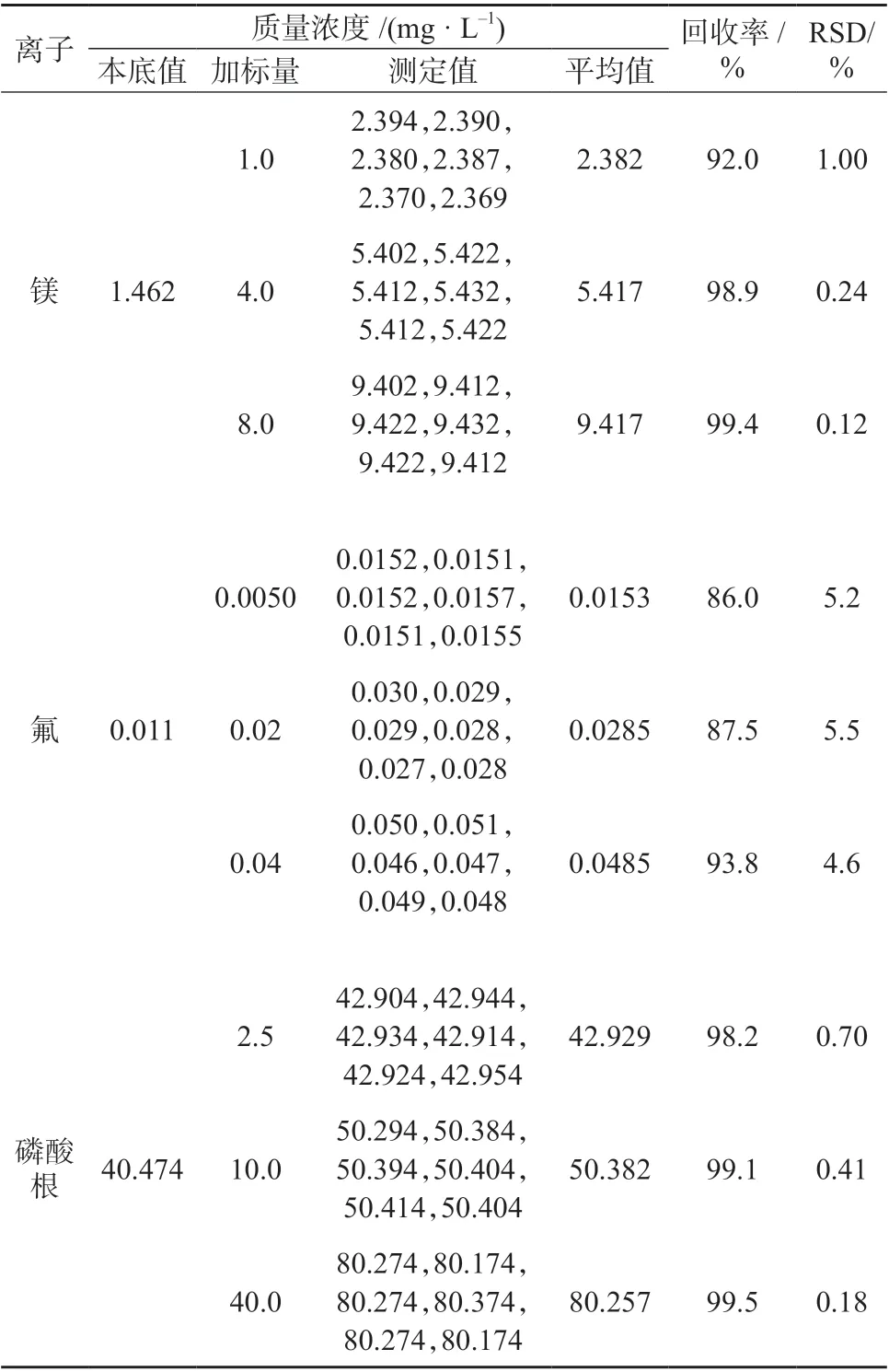
续表5
2.6 样品的稳定性
选择高质量浓度水平的加标样品,分别置于4、-20、-70 ℃冰箱中放置24 h,在1.2 仪器工作条件下进行测定,结果见表6。由表6 可知,不同保存温度对尿液样品中钙、镁、氟、磷(以磷酸根计) 4 种离子测定结果均有影响,随保存温度的降低,其影响变小。
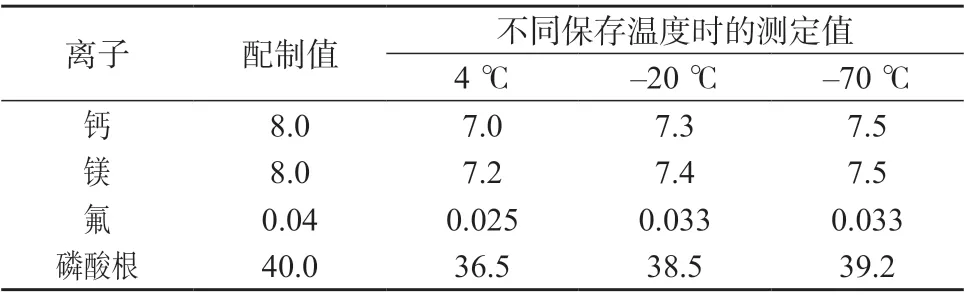
表6 不同保存温度时4 种离子质量浓度测定结果 mg/L
选择高质量浓度水平的加标样品,置于-70 ℃冰箱中,分别放置1、14、30、35 d,在1.2 仪器工作条件下进行测定,结果见表7。由表7 可知,在-70 ℃温度下,不同保存时间对尿样中钙、镁、氟、磷(以磷酸根计) 4 种离子测定结果均有影响,当保存时间超过30 d 时,测定结果明显偏小,因此尿液样品采集后应尽快检测或在-70℃下冷冻保存1 个月内测定。
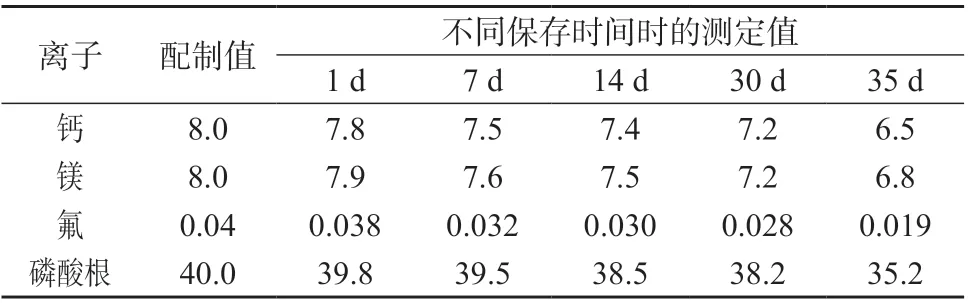
表7 70 ℃下不同保存时间时4 种离子质量浓度测定结果 mg/L
3 结语
建立了固相萃取-离子色谱法测定人尿液中钙、镁两种阳离子和氟、磷酸根两种阴离子。尿液样品经固相萃取小柱C18去除杂质,经离子柱分离,采用标准曲线定量。该方法操作简便、灵敏度高、选择性好、结果准确,满足测定要求,可用于人尿液中钙、镁、氟、磷离子的检测。
