泊沙康唑预防血液系统恶性肿瘤患者侵袭性真菌病的疗效和安全性分析
2022-07-29李文星王蓓蓓许霞青谭然张月丽
李文星,王蓓蓓,许霞青,谭然,张月丽
郑州大学附属郑州中心医院,郑州 450007
侵袭性真菌病(invasive fungal disease,IFD)是一种由真菌侵入人体并在组织、器官或血液中生长、繁殖,导致炎症反应及组织损伤的感染性疾病[1]。近年来,随着化疗方案和移植技术的应用,恶性血液病患者的IFD 发病率逐步上升。IFD 是血液系统恶性肿瘤患者的重要死亡原因之一,国内多中心研究数据显示确诊IFD 的血液系统恶性肿瘤患者的病死率为11.7%[2]。IFD 患者早期临床特征缺乏特异性,诊断较为困难[3],且抗真菌药物存在疗效有限、药物相互作用多或不良反应明显等诸多不足,因此IFD 的预防尤为重要。
泊沙康唑是一种口服广谱三唑类抗真菌药物,对曲霉菌属、念珠菌属、毛霉属等均具有抗菌活性,适用于预防重度免疫功能受损患者的侵袭性曲霉菌和念珠菌感染。伏立康唑也是一种三唑类抗真菌药物,对曲霉菌、氟康唑耐药的念珠菌以及镰刀菌等具有很强的抗菌活性[4],被推荐为治疗侵袭性曲霉病的首选药物[5]和治疗念珠菌病的替代药物[6]。在《血液病/恶性肿瘤患者侵袭性真菌病的诊断标准与治疗原则》(第六次修订版)中,泊沙康唑和伏立康唑均被推荐作为预防性抗真菌药物,但目前二者在血液系统恶性肿瘤患者中预防IFD 的效果和不良反应的比较研究较少。本研究回顾性分析了本院血液系统恶性肿瘤患者预防性使用泊沙康唑口服混悬液和伏立康唑片的情况,比较二者的有效性和安全性,以期为血液系统恶性肿瘤患者的安全合理用药提供依据。
1 资料与方法
1.1 一般资料
回顾性选取2019 年1 月~2020 年12 月期间本院收治的73 例血液系统恶性肿瘤患者,依据用药情况分为泊沙康唑组(n=44)与伏立康唑组(n=29)。其中,泊沙康唑组:男性15 例,女性29 例;年龄19~88 岁,中位年龄55 岁。伏立康唑组:男性11 例,女性18 例;年龄29~88 岁,中位年龄64 岁。两组性别、年龄比较无统计学差异(P>0.05),具有可比性。
纳入标准:①年龄≥18 岁者。②接受标准化疗、强化化疗或造血干细胞移植者。③持续中性粒细胞减少(绝对中性粒细胞计数<0.5×109/L)者。④使用泊沙康唑口服混悬液或伏立康唑片者。排除标准:①使用泊沙康唑口服混悬液或伏立康唑片前即存在IFD 者。②使用泊沙康唑口服混悬液或伏立康唑片前出现严重肝肾功能不全、中枢神经系统异常者。③同时使用其他抗真菌药物者。
1.2 治疗方案
泊沙康唑组给予泊沙康唑口服混悬液(Patheon Inc.,Whitby Operations,注册证号H20181110,规格40mg/ml),外周血绝对中性粒细胞计数<0.5×109/L 者第1 天开始口服,200mg/次,bid,连续治疗至中性粒细胞恢复正常或发生IFD 或发生无法耐受的不良反应。
伏立康唑组给予伏立康唑片(Pfizer Italia S.r.l.,注册证号H20150052,规格200mg),外周血绝对中性粒细胞计数<0.5×109/L 者第1 天开始口服,首日负荷剂量400mg,q12h,之后维持剂量为 200mg,q12h,连续治疗至中性粒细胞恢复正常或发生IFD 或发生无法耐受的不良反应。
1.3 观察指标
①通过医院信息系统收集患者的基本资料、生化指标和用药情况。具体包括患者性别、年龄、血液系统恶性肿瘤类型、中性粒细胞缺乏持续时间、肝肾功能、不良反应发生情况、预防用药效果等,其中肝肾功能指标包括谷草转氨酶(aspartate aminotransferase,AST)、谷丙转氨酶(alanine aminotransferase,ALT)、总胆红素(total bilirubin,TBIL)、直 接 胆 红 素(direct bilirubin,DBIL)、肌酐(serum creatinine,Scr)。②预防效果及不良反应评价。IFD 诊断根据《血液病/恶性肿瘤患者侵袭性真菌病的诊断标准与治疗原则》(第六次修订版),可分为确诊(符合确诊IFD 微生物学标准)、临床诊断(具有至少1 项宿主因素、1项临床标准及1 项微生物学标准)、拟诊(具有至少1 项宿主因素、1 项临床标准,而缺乏微生物学标准)和未确定(具有至少1 项宿主因素,但临床证据及微生物结果不符合确诊、临床诊断及拟诊IFD 标准)。依据美国国家癌症研究所制定的常见不良事件评分系统(CTCAE 5.0)记录不良事件。
1.4 统计学方法
利用Excel 2003 软件建立数据库进行数据汇总,通过SPSS 20 软件进行统计分析。统计分析中计量资料不符合正态分布,以M(P25,P75)表示,组间比较行非参数秩和检验;计数资料以n(%)表示,组间比较行χ2检验或Fisher 确切概率法。P<0.05为有统计学差异。
2 结果
2.1 基线资料
两组中性粒细胞缺乏持续时间、疾病分类等基线资料比较无统计学差异(P>0.05),具有可比性。见表1。

表1 两组基线资料比较 n(%)
2.2 两组真菌感染预防效果比较
泊沙康唑组IFD 发生率(4 例,9.09%)与伏立康唑组(0 例,0.00%)比较无统计学差异(P=0.097)。
2.3 两组不良反应发生情况比较
73 例患者中,3 例出现症状性不良反应,未见严重不良反应。伏立康唑组症状性不良反应发生率(10.34%)高于泊沙康唑组(0.00%,P=0.030),见表2。

表2 两组不良反应发生率比较 n(%)
2.4 两组肝肾功能指标水平比较
用药前,两组AST、ALT、TBIL、DBIL 和Scr 水平比较无统计学差异(P>0.05);用药后,两组AST、ALT、TBIL 和Scr 水平比较仍无统计学差异(P>0.05),但伏立康唑组DBIL 峰值高于泊沙康唑组(P=0.048)。见表3。
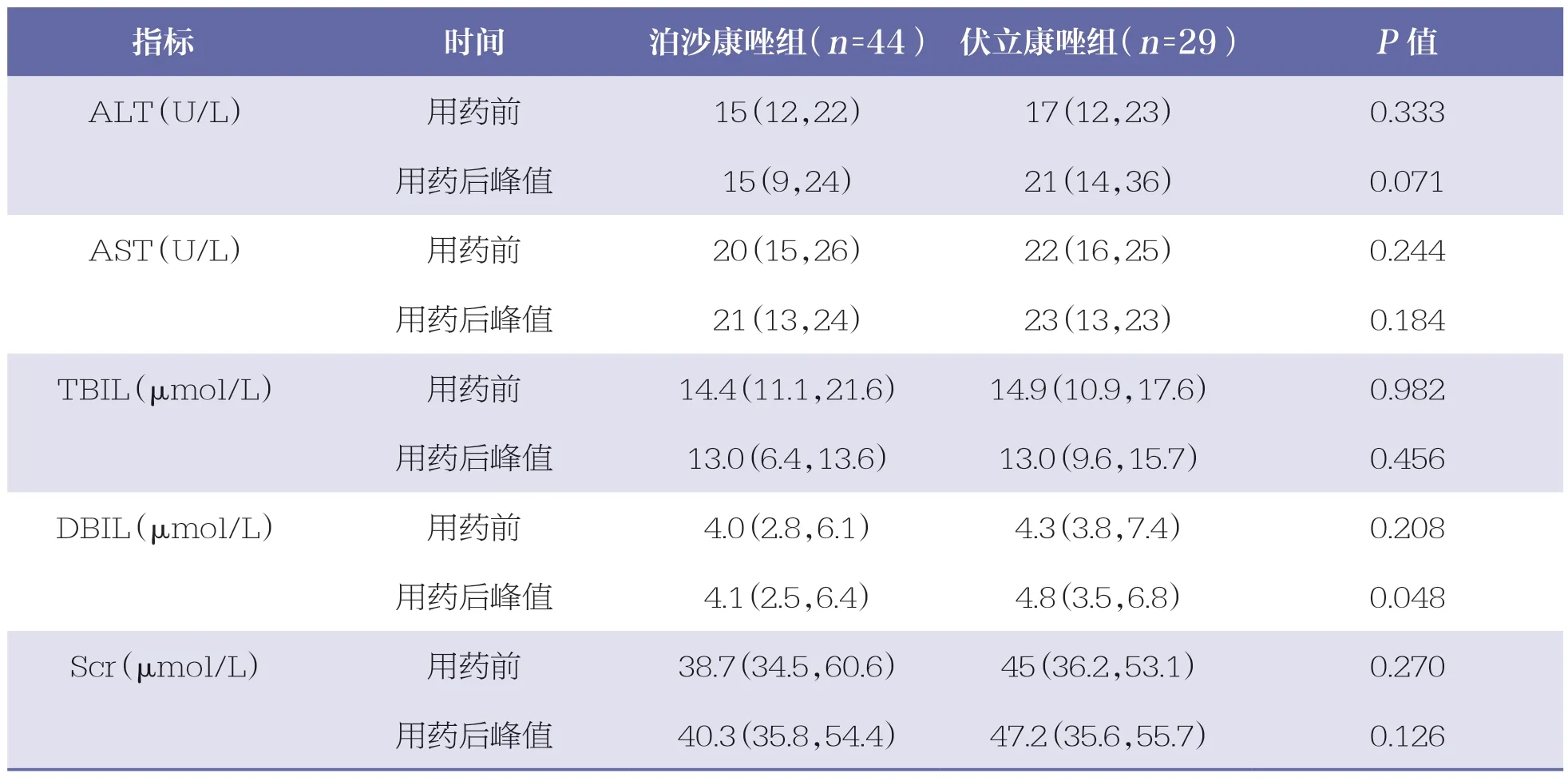
表3 两组肝肾功能指标水平比较 M(P25,P75)
3 讨论
随着大剂量放疗和化疗、广谱抗菌药物及免疫抑制剂等的使用,IFD 成为血液系统恶性肿瘤治疗中常见的严重并发症。泊沙康唑为新一代三唑类抗真菌药物,可通过抑制麦角甾醇的生物合成而发挥作用,对念珠菌、曲霉菌、隐球菌及接合菌(如毛霉、根霉等)均具有较强的抗菌活性[7]。泊沙康唑经葡萄糖醛酸化代谢,仅抑制CYP3A3、CYP3A4酶,对CYP2C19、CYP3C9 无抑制作用,因此药物相互作用较少[8]。美国感染病协会(Infectious Diseases Society of America,IDSA)建议,在血液系统恶性肿瘤患者的化疗和移植过程中,泊沙康唑应作为预防IFD 的一线药物,伏立康唑可作为二线治疗药物[9]。近年来,念珠菌感染发病率下降,而曲霉菌和其他真菌感染发病率上升[10]。因伏立康唑对曲霉菌具有较强抑制活性,其在血液系统恶性肿瘤患者预防IFD 中的使用率逐年增加。《血液病/恶性肿瘤患者侵袭性真菌病的诊断标准与治疗原则》(第六次修订版)推荐泊沙康唑、伏立康唑、伊曲康唑、氟康唑等作为预防性抗真菌药物。有研究表明[11-15],血液系统恶性肿瘤患者使用泊沙康唑或伏立康唑预防IFD 的疗效优于氟康唑、伊曲康唑和米卡芬净,但泊沙康唑和伏立康唑的比较研究较少。
本研究分析了73 例血液系统恶性肿瘤患者预防IFD 的用药情况,探讨了泊沙康唑和伏立康唑在预防IFD 有效性、不良反应发生率、对患者肝肾功能影响的差异。结果表明,泊沙康唑组IFD 发生率为9.09%,与Sung 等[16]的报道一致;两组IFD 发生率无统计学差异(P=0.097),与Yang 等[17]的研究结果相符。泊沙康唑组发生IFD 的患者中,3例为拟诊、1 例为确诊,均接受注射用两性霉素B脂质体或注射用醋酸卡泊芬净进行全身抗真菌治疗。分析泊沙康唑组发生IFD 的原因可能为:①患者化疗后恶心呕吐影响泊沙康唑吸收;②患者饮食结构及消化道pH 影响泊沙康唑的生物利用度。伏立康唑组未发生IFD,可能与病例较少有关,相关结论还有待进一步扩大样本量予以证实。
本研究中,两组不良反应发生率都较低,这与既往文献报道[18-19]结果相符。伏立康唑组不良反应发生率高于泊沙康唑组(P=0.030),与文献报道[20]一致。泊沙康唑组未发生胃肠道不适、神经系统毒性等不良反应;伏立康唑组中2 例出现幻视、1 例同时出现幻视和幻听。其中,2 例患者调整伏立康唑给药剂量后不良反应消失,并继续使用伏立康唑治疗;1 例患者因不能耐受调整为注射用米卡芬净钠治疗。
本研究中,用药前两组AST、ALT、TBIL、DBIL、Scr 水平比较均无统计学差异(P>0.05),但用药后伏立康唑组DBIL 峰值高于泊沙康唑组,这与Hachem 等[20]的研究结果相符。
综上所述,泊沙康唑和伏立康唑均能有效预防血液系统恶性肿瘤患者发生IFD,且泊沙康唑组不良反应发生率更低,对患者肝功能指标影响更小。本研究为回顾性研究,且病例数较少,可能造成结果偏倚,下一步将扩大样本量,并对使用泊沙康唑和伏立康唑的恶性血液系统肿瘤患者的全因死亡率及成本-效果进行分析比较,以期为血液系统恶性肿瘤患者IFD 提供安全、有效、经济的药物治疗方案。
