FBW7基因敲除的放射诱导性胃肠综合征小鼠肠道损伤变化及其机制
2022-07-28章屹然王兆熹彭涵朱军张健李惠晨
章屹然,王兆熹,彭涵,朱军,张健,李惠晨
1空军军医大学基础医学院,西安 710032;2空军军医大学西京医院整形外科;3空军军医大学西京医院消化外科
当肠道绒毛上皮细胞和隐窝干细胞受到一定剂量的电离辐射(如γ、β射线),其生长、增殖受到抑制甚至死亡,造成肠道屏障功能丧失、上皮缺损和炎症损伤,从而导致胃肠综合征(GIS)的发生,严重影响患者生活质量,甚至威胁患者生命[1-2]。目前尚无有效医学手段用于GIS的治疗,这也成为腹部肿瘤放射治疗的主要限制因素[3]。因此,探索GIS的损伤机制,找到潜在的干预靶点,对开发有效的干预措施至关重要。泛素—蛋白酶体系统是真核细胞中蛋白质降解的主要调控途径[4],其功能缺陷可能导致多种疾病[5]。FBW7属于泛素连接酶E3复合体,其在肿瘤中的作用得到广泛研究[6-7]。本课题组前期研究发现,FBW7通过调控NF-κB信号通路,在硫酸葡聚糖钠盐诱导的小鼠结肠炎中发挥重要作用,FBW7表达缺失能够加重实验性小鼠结肠炎[8]。然而,FBW7在放射诱导的GIS中的作用还不得而知。2018年3月—2021年6月,本研究观察了FBW7基因敲除的放射诱导性GIS小鼠肠道损伤变化,并探讨其相关机制。现报告如下。
1 材料与方法
1.1 实验动物与主要材料 6~8周龄、体质量18.5~21.5 g的野生型雄性C57/BL小鼠60只,购于空军军医大学动物实验中心。小鼠在SPF条件下饲养,所有动物实验操作严格按照空军军医大学动物实验管理委员会的标准执行。胰酶、EDTA均购自Gibco公司;TUNEL免疫荧光检测试剂盒、髓过氧化物酶(MPO)检测试剂盒购自碧云天公司;ELISA试剂盒购自eBioscience公司;Caspase-3、Bax、Ki-67、PCNA等相关抗体购自Abcam公司。
1.2 动物分组及GIS模型制作 将FBW7基因两端具有flox序列的C57/BL小鼠(FBW7fl/fl)与携带Cre重组酶、villin启动子(Vil/Cre)的C57/BL小鼠杂交,经过多次杂交产生Vil/Cre-FBW7fl/fl纯合小鼠记为FBW7△G小鼠,实现肠道组织特异性FBW7敲除,取15只作为实验组。野生型C57/BL小鼠15只纳入对照组。使用60Go放射源,以8 Gy(剂量率0.7 Gy/min)的剂量对两组小鼠进行一次性全腹部照射。将照射后小鼠放回单独的笼子里,观察并记录小鼠体质量变化、腹泻情况和存活情况。分别于照射后7、14 d以脱颈法处死小鼠并取肠道组织做病理切片。HE染色显示照射后小肠绒毛高度降低,肠道隐窝深度变浅,绒毛数目减少,窝腔变大,出现放射性肠炎改变,表明GIS造模成功。
1.3 小肠放射损伤评估 分别于每日早上8:00记录每只小鼠的存活情况和体质量变化,观察腹泻情况。腹泻评分标准:无腹泻计0分,大便松软计1分,稀便、腹泻计2分。照射后8 d,以脱颈法处死小鼠,打开腹腔,用剪刀小心切取小鼠小肠组织,生理盐水冲洗,多聚甲醛固定、包埋后制成5µm厚的石蜡切片,进行HE染色。通过Image J软件测量小肠绒毛平均长度和隐窝平均深度,以评价损伤程度。光学显微镜下观察并进行小肠组织病理学评分,评分主要指标包括上皮缺失百分数(无缺失计0分,缺失<5%计1分,缺失5%~10%计2分,缺失>10%计3分)、隐窝损伤百分数(无损伤计0分,损伤<10%计1分,10%~20%计2分,>20%计3分)、杯状细胞损伤(无损伤计0分,轻微损伤计1分,中度损伤计2分,重度损伤计3分)、炎症细胞浸润(无浸润计0分,轻微浸润计1分,中度浸润计2分,重度浸润计3分)。
1.4 小肠上皮细胞MPO活性及IL-1β、IL-6、TNF-α检测 采用MPO生化试剂盒检测小肠上皮MPO活性,反映损伤黏膜嗜中性粒细胞浸润程度。采用ELISA法检测小肠上皮细胞中的IL-1β、IL-6、TNF-α。
1.5 肠道隐窝干细胞增殖检测 取出肠道组织清洗干净,甲醛固定,石蜡包埋,切片。将组织切片在二甲苯、无水乙醇和95%乙醇溶液中浸泡后,用去离子水洗涤进行脱蜡。将切片在柠檬酸缓冲液中封闭,并用去离子水清洗封闭液。将切片在含5%山羊血清的TBST中室温下封闭。用稀释好的Ki-67(1∶200)、PCNA(1∶400)一抗在4 ℃下进行封闭过夜,并用TBST溶液洗涤。加入1∶1 000稀释的相应二抗,室温孵育1 h后,用TBST溶液洗涤,滴加检测试剂,室温下于湿盒中放置30 min。显微镜下观察并计数Ki-67、PCNA阳性细胞。
1.6 小肠上皮细胞凋亡检测 取肠道组织进行TUNEL染色,甲醛固定、切片、脱蜡,滴加蛋白酶K工作液覆盖组织,37℃温箱孵育30 min进行修复。将玻片置于PBS中,在脱色摇床上洗涤。切片稍甩干后滴加破膜工作液覆盖组织,常温下孵育20 min,将玻片置于PBS中,在脱色摇床上洗涤。按切片数量和组织大小取TUNEL试剂盒内适量试剂1(TdT)和试剂2(dUTP)按2∶29混合,覆盖组织,切片平放于湿盒内,37℃恒温箱孵育2 h,湿盒内加少量水保持湿度。切片用PBS洗涤。去除PBS后滴加DAPI染液,避光室温孵育10 min。玻片置于PBS中,在脱色摇床上洗涤。切片稍甩干后用抗荧光淬灭封片剂封片。计数TUNEL阳性细胞,反映肠道上皮细胞凋亡情况。采用免疫组化法检测Caspase-3、Bax蛋白,Image J软件分析Caspase-3、Bax蛋白平均光密度值。
1.7 统计学方法 采用SPSS20.0统计软件。采用Shapro-Wilk法对样本数据进行正态性检验,符合正态分布的计量资料以±s表示,组间比较采用t检验。采用Kaplan-Meier曲线进行生存分析,采用对数秩检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组小肠放射损伤程度比较 实验组、对照组存活时间分别为(13.50±1.80)、(9.56±1.66)d,实验组存活时间较对照组更长(P<0.05)。照射第10天后,实验组体质量下降较对照组更快(P均<0.05),见表1。与对照组相比,实验组腹泻明显减轻,见表2。实验组肠道(特别是小肠部)充血及水肿情况较对照组更轻,实验组、对照组小肠组织病理学评分分别为(6.33±1.38)、(8.77±1.31)分,实验组低于对照组(P<0.05)。实验组和对照组照射后肠道绒毛长度及小肠隐窝深度都有减少,照射8 d后,实验组肠道绒毛长度及小肠隐窝深度均高于对照组(P均<0.05),见表3。
表1 照射不同时间两组小鼠体质量变化程度比较(%,±s)

表1 照射不同时间两组小鼠体质量变化程度比较(%,±s)
注:与对照组相比,*P<0.05。
组别实验组对照组第1天92.45±1.40 92.18±1.85 n 15 15第0天100.00±0.00 100.00±0.00第4天85.06±4.01 85.58±4.18第8天79.32±6.22 82.63±5.19第12天66.42±4.45*78.39±3.16第10天75.20±6.21*79.05±9.11
表2 照射不同时间两组小鼠腹泻评分比较(分,±s)

表2 照射不同时间两组小鼠腹泻评分比较(分,±s)
注:与对照组相比,*P<0.05。
组别实验组对照组n 15 15第0天0.00±0.00 0.00±0.00第1天0.07±0.03 0.25±0.12第2天0.57±0.11 0.81±0.23第3天0.79±0.16*1.06±0.21第4天1.00±0.23*1.25±0.19
表3 照射前后两组小肠绒毛高度和隐窝深度比较(µm,±s)

表3 照射前后两组小肠绒毛高度和隐窝深度比较(µm,±s)
注:与同组照射第0天相比,*P<0.05;与对照组照射第8天相比,#P<0.05。
小肠绒毛高度n 小肠隐窝深度15 476.6±1.9 404.4±7.8*#组别实验组照射第0天照射第8天对照组照射第0天照射第8天100.3±3.5 76.1±1.9*#15 106.5±3.2 69.4±2.4*486.5±2.4 311.8±13.4*
2.2 两组小肠上皮细胞MPO活性及IL-1β、IL-6、TNF-α表达比较 实验组小肠上皮细胞MPO活性及IL-1β、IL-6、TNF-α表达均低于对照组(P均<0.05)。见表4。
表4 两组小肠上皮细胞MPO活性及IL-1β、IL-6、TNF-α表达比较(±s)

表4 两组小肠上皮细胞MPO活性及IL-1β、IL-6、TNF-α表达比较(±s)
注:与对照组相比,*P<0.05。
组别实验组对照组TNF-α(pg/mg)184.9±20.6*439.9±88.2 n 15 15 MPO(U/g)0.041 33±0.004 82*0.067 67±0.006 64 IL-1β(pg/mg)772.1±28.1*982.1±22.4 IL-6(pg/mg)146.5±30.7*373.0±52.2
2.3 两组肠道隐窝干细胞增殖情况比较 实验组Ki-67、PCNA阳性细胞分别为(474.6±15.7)、(423.5±14.5)个,对照组分别为(408.6±14.8)、(388.7±13.8)个,实验组Ki-67、PCNA阳性细胞数量均多于对照组(P均<0.05)。
2.4 两组小肠上皮细胞凋亡情况比较 实验组小肠上皮细胞凋亡细胞数及Caspase-3、Bax蛋白相对表达量均低于对照组(P均<0.05)。见表5。
表5 两组小肠上皮细胞凋亡细胞数及Caspase-3、Bax相对表达量比较(±s)
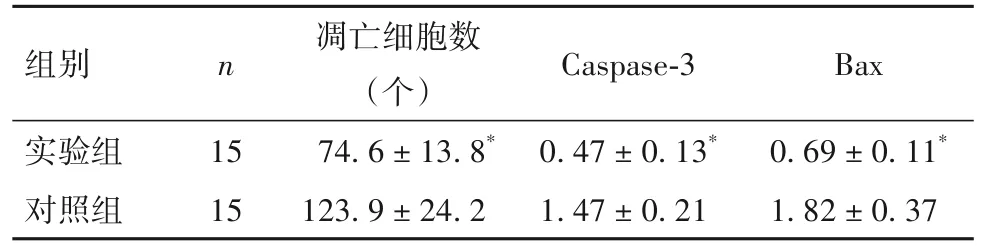
表5 两组小肠上皮细胞凋亡细胞数及Caspase-3、Bax相对表达量比较(±s)
注:与对照组相比,*P<0.05。
组别实验组对照组Bax 0.69±0.11*1.82±0.37 n 15 15凋亡细胞数(个)74.6±13.8*123.9±24.2 Caspase-3 0.47±0.13*1.47±0.21
3 讨论
当意外暴露或接受高剂量放射治疗时会导致急性放射综合征的发生。小肠绒毛上皮细胞和隐窝干细胞对急性放射性损伤较为敏感,容易受到辐射损伤进而造成GIS。GIS的主要表现包括胃肠道损伤引起的细菌性肠炎、吸收不良、腹泻和体液丢失等,严重影响患者的生活质量和生命安全。由于目前缺乏有效的医学手段,寻找潜在的干预靶点是研究的重点和难点。
FBW7是具有7个串联WD40重复序列的F-box蛋白。FBW7属于E3复合体,其包含四个亚基,即Skp1、cullin1、Rbx1和F-box。FBW7是Skp1-Cul1-F-box-E3的关键底物识别亚基[9]。FBW7基因位于4q31.3并编码三个亚型,分别为FBW7α、FBW7β和FBW7γ[10]。这三种蛋白具有相同的催化功能,但有不同的亚细胞定位。FBW7α主要位于细胞核,FBW7β 主要位于细胞质,FBW7γ 则位于核仁[11]。这三个亚型在N端区域具有不同的氨基酸序列,但在C端均包含保守的相互作用区域,即F-box和WD40重复序列[12-13]。能够被FBW7降解的靶蛋白均含有一个名为CDP的磷酸化氨基酸保守序列,CDP结合到WD40重复序列上,使泛素识别底物连接酶,从而使目的蛋白发生降解[13]。此外,在FBW7对底物发挥降解作用的过程中,糖原合酶3β(GSK3β)也起着至关重要的作用。GSK3β催化底物CDP中苏氨酸磷酸化,促进其与FBW7的结合并加速FBW7的降解[14]。
FBW7在肿瘤中的作用得到广泛研究[6-7],许多在肿瘤发生发展中起重要作用的分子均是其作用底物,如 c-Myc、Notch1、c-Jun[6]和 NF-κB[15-16]等。我们前期研究发现,FBW7在炎症性肠道疾病中发挥重要作用,因此推测FBW7可能也参与了放射诱导的GIS。为了明确FBW7在放射诱导GIS中的作用,我们课题组以肠上皮特异性敲除FBW7的小鼠作为实验组,以野生型小鼠作为对照。放射性肠损伤严重程度的重要判断标准之一是生存期,我们发现,FBW7肠道缺失可以提高放射后小鼠的生存时间。腹泻情况和体质量减轻也是放射性损伤的重要评价指标,本研究中,实验组小鼠腹泻程度较对照组减轻。值得注意的是,实验组小鼠体质量下降更为明显,分析认为是由于对照组从第8天开始就出现动物死亡,而实验组体质量下降但并无死亡发生。我们还发现,实验组肠道充血及水肿情况较对照组更轻,组织病理学评分更低,肠道绒毛长度及小肠隐窝深度减少程度也更小,以上结果提示,FBW7缺失能够减轻放射引起的GIS。
炎症反应与放射性肠道损伤的严重程度和预后均有密切联系。MPO富含于中性粒细胞中,其活性可反映炎症严重程度。IL-1β、IL-6、TNF-α等促炎细胞因子也是炎症反应的重要指标。本研究结果显示,与对照组相比,实验组MPO活性及IL-1β、IL-6、TNF-α表达降低,提示FBW7缺失有助于减轻GIS的肠道炎症反应,减轻相应症状。
小鼠肠道细胞的增殖能力对于小鼠肠道损伤修复非常重要。当小鼠肠道受到放射性损伤时,小鼠肠道细胞增殖能力越强,则修复能力越强。而肠道细胞凋亡在GIS中有着非常重要的作用,是评估肠道损伤严重程度的重要指标。为探索FBW7发挥作用的机制,本课题组检测了FBW7敲除后小肠上皮细胞的增殖和凋亡情况,结果显示,实验组肠道Ki-67、PCNA阳性细胞数多于对照组,说明实验组肠道细胞增殖能力较强,对放射性损伤的修复能力更强,而对照组肠道细胞凋亡情况更为严重,也是肠道损伤加重的关键因素。值得注意的是,我们观察到的TUNEL阳性细胞大多数位于肠绒毛处,而肠道隐窝处较少,分析是由于TUNEL阳性细胞可能部分来自于肠道隐窝,当肠道受到损伤时,肠道隐窝细胞发生增殖分化,然后转移至肠道绒毛进行修复,所以肠道绒毛细胞呈现TUNEL阳性。上述结果提示,FBW7缺失有可能通过抑制肠道细胞凋亡和促进肠道细胞增殖来减轻GIS。
然而,在放射损伤情况下,FBW7调控肠道细胞增殖和凋亡的具体机制并不十分明确。之前研究表明,p53在肠道细胞凋亡中起重要作用,能够保护内皮细胞免于放射损伤[17],而p53突变可能会降低FBW7表达[18],这提示FBW7表达缺失可能通过调控p53信号通路来保护肠道,减轻放射损伤。此外,辐射可通过PI3K/Akt信号通路,调节mTOR表达,调控肠道细胞的自噬功能,从而调节放射损伤[19]。我们前期研究发现,FBW7的重要底物Notch1对PI3KAkt-mTOR信号通路有重要的调控作用[20],推测这也可能是FBW7的作用机制。上述结果为FBW7具体调控机制相关研究提供了参考,有待进一步深入探索。
