感觉门控电位P50对早期阿尔茨海默病的诊断价值
2022-07-28邢译尹张海平林钟华向铭静
邢译尹,付 婧,张海平,林钟华,向铭静,肖 军,
(1.西南医科大学临床医学院,四川 泸州 646000;2.四川省医学科学院·四川省人民医院 a.康复科,b.四川省精神医学中心,四川 成都 611100)
轻度认知功能障碍(mild cognitive impairment,MCI)被认为是阿尔茨海默病(alzheimer’s disease,AD)的前驱阶段[1],研究发现其亚型之一的遗忘型轻度认知功能障碍(amnestic mild cognitive impairment,aMCI)转化为AD的风险更高[2],并与AD有相似的神经病理改变[3]。尽早发现并及时干预这一人群,对AD的病程改善具有重要意义。感觉门控(sensory gating,SG)是一种大脑对重复刺激进行抑制调节的功能[4],可防止大脑皮层高级区域接收过多重复无效的刺激而能力超载[5],在早期皮层抑制多余的感觉输入与后期认知过程存在联系[6]。事件相关电位P50常用于评估SG功能[7],故其也称感觉门控电位P50。既往研究比较了MCI和AD的P50变化,但早期轻度AD的P50研究少见,本研究通过分析aMCI、轻度AD的P50特征,探究其对AD早期的临床诊断价值。
1 资料与方法
1.1 一般资料选择2020年1月至2022年1月四川省人民医院门诊或住院的27例aMCI患者及27例轻度AD患者。aMCI组男15例,女12例,年龄48~82岁[(62.7±10.33)岁],受教育时间6~15年,平均9年。纳入标准:①符合2011年美国国家衰老研究所-阿尔茨海默病协会(NIA-AA)的“AD源性MCI”标准[1]。②根据文化教育程度不同,简易精神状态检查量表(MMSE)评分需满足:17分以上(文盲)、20分以上(小学)、24分以上(中学);蒙特利尔认知评估量表(MoCA)评分需小于26分;临床痴呆评定量表(CDR)评分为0.5。轻度AD组男10例,女17例,年龄51~82岁[(67.48±8.74)岁],受教育时间6~9年,平均9年。纳入标准:①符合NIA-AA的“很可能AD”标准[8]。②MMSE评分根据不同文化教育水平[9]:21~26分(初中及以上)或21~22分(小学);CDR评分为1~2分。③能配合完成神经心理学量表测试、事件相关电位检测。正常对照组(NC组)为同时期就诊于我院的26例健康体检者,男12例,女14例,年龄48~80岁[(61.65±13.10)岁],受教育时间6~12年,平均10年,主诉无记忆力减退,认知正常,CDR、ADL得分正常。排除标准:①不能提供相对可靠病史者;②合并中重度言语障碍、听力或视力下降不能完成量表或执行操作者;③可继发的认知下降的其它中枢神经变性疾病如帕金森病、多系统萎缩等及肿瘤、脑炎、内分泌疾病等;④多发性脑梗死或海马、丘脑、颞叶等部位梗死者;Hachinski缺血指数量表(HIS) >4分;⑤合并严重器质性疾病如心功能衰竭、肝肾功能衰竭者;⑥合并重度抑郁、焦虑等精神障碍者,汉密尔顿焦虑量表(HAMA)得分14分及以上,汉密尔顿抑郁量表(HAMD)得分17分及以上。三组间一般临床资料比较,差异无统计学意义(P>0.05)
1.2 方法
1.2.1神经心理学量表测试 对入组者进行MMSE、MoCA量表评估总体认知情况,ADL、CDR、HIS、HAMA、HAMD量表以鉴别或排除诊断。评分标准参照相应手册。
1.2.2电生理采集 采用日本光电诱发电位仪对入组者进行听觉事件相关电位P50检测,通过E-Prime软件采集数据。在安静隔音的电生理室,受试者取舒适平卧位,嘱受试者安静闭目、放松,检查过程中尽量保持清醒、集中注意;在测试前向受试者说明检查内容、操作方式,争取受试者全程配合。电极放置参照脑电图国际10-20系统电极安放法,Cz处电极记录P50,双耳后乳突作为参考电极,前额中心接地线,测试前使用导电膏及磨砂膏降低皮肤表面电阻,测试中保持电极与皮肤间阻抗<5 kΩ。P50检测方法:采用“Oddball”听觉序列,选择条件刺激(S1)-测试刺激(S2)模式。被测试者将从耳机中接收16组强度80分贝的成对短纯音作为听觉刺激(刺激时间2 ms,刺激间隔0.5 s),每组成对刺激将间隔10 s。采集指标包括S1、S2引出的潜伏期、波幅及P50抑制(S2/S1波幅比值)。采集内容应用放大、滤波、数字化等电脑自动化处理从而可获得无运动干扰的数据,最终通过叠加和平均处理分析出结果。
1.3 统计学方法采用SPSS 24.0软件分析数据。计量资料以均数±标准差或中位数(四分位数)描述,多组间比较采用单因素方差分析或Kruskal-Wallis非参数检验;计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 三组神经心理学量表评分比较与对照组比较,轻度AD组MMSE、MOCA评分下降(P<0.05),aMCI组MOCA评分下降(P<0.05),但MMSE评分差异无统计学意义(P>0.05);与aMCI组比较,轻度AD组MMSE、MOCA评分下降(P<0.05)。见表1。
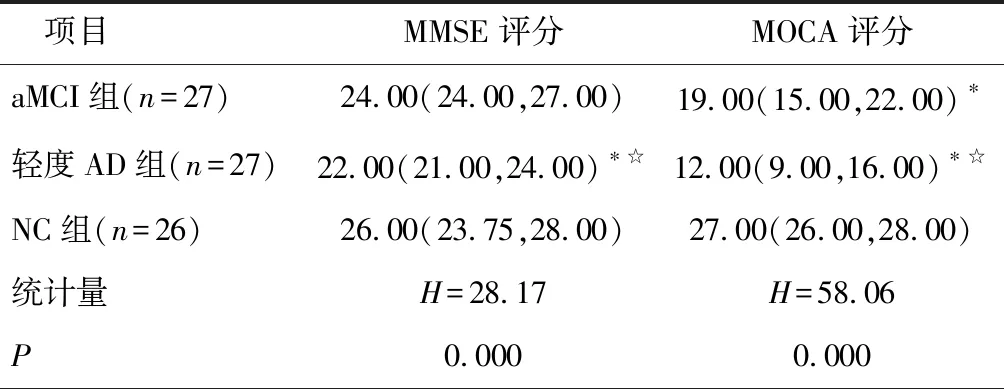
表1 三组神经心理学量表评分比较 (分)
2.2 三组P50潜伏期、波幅及比值比较三组间S1、S2潜伏期比较差异无统计学意义(P>0.05);与对照组比较,aMCI组、轻度AD组的S1及S2波幅、S2/S1均升高(P<0.05);与aMCI组比较,轻度AD组S1及S2波幅、S2/S1差异无统计学意义(P>0.05)。见表2。
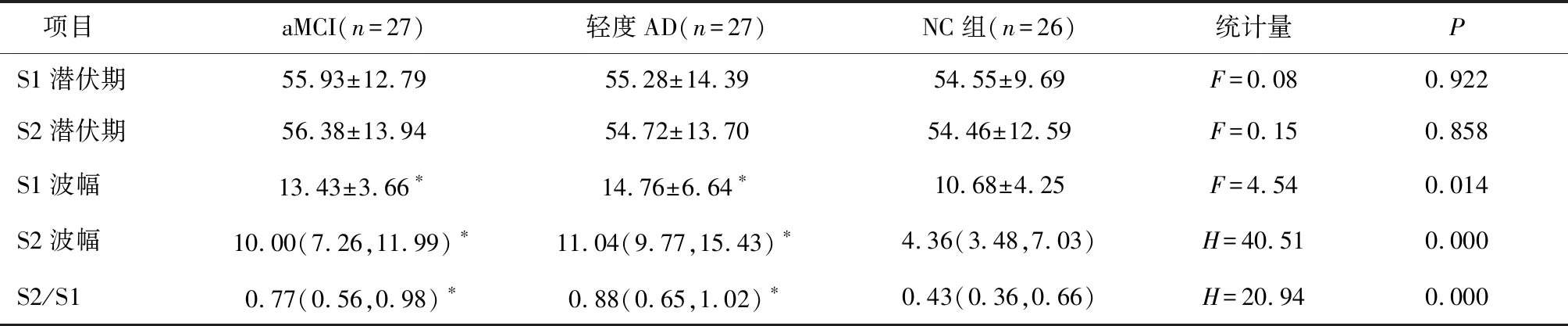
表2 三组P50波幅、潜伏期及比值比较
3 讨论
感觉门控电位P50是在听觉刺激发生后50 ms左右出现的事件相关电位成分,主要参与听觉皮层的早期听觉加工、运动反应速度、抑制控制和学习等认知功能[10,11];此外通过S1~S2范式评估感觉门控功能,在这个过程中,有研究推测P50感觉门控机制是一种主动性的抑制反应[12]:条件刺激诱发出一个能对后面重复或相同刺激有特殊抑制(门控)功能的神经元活动,与条件刺激相同的第二个刺激因为未携带新信息输入而被过滤,使其无法传入更高级的皮层中枢。在Freedman等的研究中[13],这些抑制性输入被认为起源于海马区,海马中间神经元在这一抑制的过程中发挥重要作用,S1刺激传入激活了海马中间神经元诱发出S1波,但同时也激活该部位的抑制神经元,随后同种刺激S2出现,但抑制性海马神经元仍在活动,抑制作用使神经元产生较小的反应,即出现正常的感觉门控;而通常认为S2/S1低于50%时具有正常P50门控[14]。本研究结果显示,在对照组中,S2-P50波幅基本都低于S1-P50波幅,提示对照组产生了正常的听感觉门控功能。
有研究发现在aMCI、AD早期的患者中因听觉中枢相关脑区受损,听觉信息加工处理的高阶功能下降,出现言语或非言语性的听理解障碍[15,16]。当接收听觉信息后,因患者存在听信息的理解障碍,可能出现听觉信息传递及处理延时,电位表现为潜伏期延长,不过该推测需扩大样本量等进一步验证。
本研究发现,与对照组相比,aMCI、轻度AD组的S1-P50波幅增加,这与国外研究结果一致,P50在MCI和AD患者中都显示出波幅的增加[14]。国内也有研究表明,MCI患者P50波幅表现为增加[17]。但不同的是在该研究中,AD组P50波幅与对照组无差异,这种结果的差异性可能与患者入组标准的不同有关,在这些研究中未描述AD患者的疾病严重程度,而在本研究中,选择的AD患者处于疾病早期。在本研究中,与对照组相比,aMCI组、AD组S2/S1升高,具有显著差异,说明患者组存在明显门控功能障碍,这与Green等的研究结果一致[18]。aMCI、AD患者中表现出的感觉门控障碍推测与AD的神经病理机制相关。AD早期海马、海马旁回受损,其神经病理机制为淀粉样蛋白(Aβ)细胞外沉积、tau蛋白高度磷酸化的细胞内神经纤维缠结形成以及大脑皮层和海马的神经元和突触缺失,有研究提到,早期突触损伤伴轴突变性以及随后的树突和核周体萎缩可导致AD患者边缘系统、新皮层区域和基底节的进行性变性[19],而P50的产生与听觉皮层、颞叶皮层、海马和新皮层区等部位有关[20]。AD存在感觉门控受损的病理基础;并且调节信息相关性的感觉门控功能主要受胆碱能调节[10],当这一系统的胆碱能功能出现缺陷时,即表现为受损的感觉门控,而AD的病理特征之一也正是皮质、海马等区域的乙酰胆碱大量减少[21]。因此,本研究提示感觉门控P50的变化与AD或aMCI 的病理过程相关,可作为aMCI、AD早期病理变化的参考指标。
综上,感觉门控电位P50有望作为诊断早期AD甚至aMCI的一项有价值的新方法,其具有无创伤性、低成本等优点,可成为一种实用的筛查或诊断工具在临床中广泛应用,为临床医生在早期制定治疗干预措施有一定的指向性。但本研究样本量有待进一步扩大以验证结果的准确性,未来需要更多维度地探讨aMCI、AD中的感觉门控电位P50变化,如随访aMCI患者转化为AD过程中的P50波形特征,以及结合功能磁共振成像、脑脊液生物标志物等检测方法为P50在阿尔茨海默病早期诊断中的应用提供更多的依据。而对AD的治疗来讲,在未来可随访复查患者进行药物治疗前后的P50变化进一步探索分析其是否能作为评价药物疗效的可靠指标,为临床上对阿尔茨海默病早期诊断、药物治疗调整提供更优化方法。
