转铁蛋白受体靶向分子探针99Tcm-T7 的放射性标记及肿瘤显像研究
2022-07-28肖晴潘芯李崇佼亚群王怡春文兵何勇
肖晴 潘芯 李崇佼 蒋 亚群 王怡春 文兵 雷 萍 何勇
1 武汉大学中南医院核医学科,武汉 430071;2 华中科技大学同济医学院基础医学院免疫学系,武汉 430030
转铁蛋白受体(transferrin receptor,TfR)是一类Ⅱ型跨膜糖蛋白,主要参与调控细胞的铁代谢及生长、增殖进程[1]。相关研究结果证实,在癌前病变及侵袭性肿瘤组织中,TfR 的表达显著升高,且其表达水平同肿瘤的分级密切相关,如在胰腺癌、结肠癌、肺癌等肿瘤及多种耐药性肿瘤中,TfR 的表达明显上调[2-5]。TfR 高表达的肿瘤具有恶性程度高、易产生耐药和预后不良等风险。因此,对肿瘤TfR 表达水平的在体监测将有助于指导肿瘤患者的临床管理及预后评估。
目前,靶向TfR 的分子探针主要包括转铁蛋白及单克隆抗体,其相对分子质量较大,体内循环时间长,易受内源性转铁蛋白竞争的影响,在应用中存在一定的局限性[6]。而小分子多肽因具有相对分子质量小、易于穿透肿瘤组织、稳定性好、血液清除速率快、易于合成及加工修饰、免疫原性低等优势,近年来在肿瘤分子影像学领域表现出良好的应用前景[7]。组氨酸-精氨酸-脯氨酸-酪氨酸-异亮氨酸-丙氨酸-组氨酸(His-Arg-Pro-Tyr-Ile-Ala-His,HRPYIAH,简称T7)是由噬菌体展示技术筛选获得的小分子多肽,能特异性靶向TfR[8-9]。本研究构建了新型靶向TfR 的分子探针99Tcm-HRPYIAH(简称99Tcm-T7),并对其理化性质、靶向特性及显像效能进行了初步研究。
1 材料与方法
1.1 主要试剂及仪器
小分子多肽T7(相对分子质量为1 156,化学纯度>95%)由上海吉尔生化公司合成制备;DMEM高糖完全培养基、胎牛血清、PBS 均购自美国Gibco 公司;青霉素及链霉素购自上海碧云天生物技术有限公司;Alexa-Fluor 647 标记的TfR 单克隆抗体(ab187777)购自英国Abcam 公司;高锝酸钠(Na99TcmO4)由99Mo-99Tcm发生器制备,购自中国原子高科有限公司;N-三(羟甲基)甲基甘氨酸(Tricine)、乙二胺二乙酸(EDDA)及二水氯化亚锡(SnCl2·2H2O)均购自美国Sigma-Aldrich 公司;Sep-park C18 SPE 柱购自美国Waters 公司。流式细胞仪(型号:FACSCalibur)购自美国BD 公司;自动γ 计数仪(型号:2470 WIZARD)购自美国PerkinElmer 公司;小动物micro SPECT/CT 一体机购自北京永新医疗设备有限公司;磷屏扫描仪购自合肥众成机电技术开发有限公司。
1.2 实验细胞及实验动物
人胰腺癌PANC-1 细胞及人乳腺癌MX-1 细胞由华中科技大学同济医学院附属协和医院兰晓莉教授课题组惠赠。无特定病原体级正常健康雌性Balb/c-nu 裸鼠30 只,体重(18±2)g,4~6 周龄,购自北京维通利华实验动物技术有限公司[许可证号:SCXK(京)2016-0006],实验动物在12 h/12 h昼夜循环的无特定病原体级环境中饲养(温度:20~26℃;湿度:40%~70%),食物(全价营养颗粒饲料)和水(超纯净化水)可以随时获得。所有动物实验均在武汉大学实验动物使用和管理委员会指南的指导下进行。本研究经武汉大学医学研究院动物伦理委员会批准(批准文号:IACUC-2534)。
1.3 细胞培养
将PANC-1 细胞及MX-1 细胞置于DMEM 高糖完全培养基(含10%胎牛血清、100 μg/ml 青霉素、100 μg/ml 链霉素),在37℃、含5%CO2的饱和湿度培养箱中培养。每日观察肿瘤细胞的生长情况,取处于对数生长期的细胞用于后续实验。
1.4 流式细胞术
单克隆抗体组:将PANC-1 细胞及MX-1 细胞消化离心后(1000 转/min,离心半径10 cm)用结合缓冲液(含0.1%胎牛血清白蛋白的PBS)重悬,每管加入100 μl 1∶400 TfR 单克隆抗体。空白对照组:每管加入等体积的结合缓冲液。4℃避光孵育30 min 后 加 入800 μl 结 合 缓 冲 液,1000 转/min离心5 min(离心半径10 cm),重复上述步骤充分去除未结合的荧光抗体,加入结合缓冲液重悬细胞,采用流式细胞术检测肿瘤细胞表面TfR 的表达情况。
1.5 99Tcm -T7 的制备、质量控制及体外稳定性鉴定
99Tcm-T7 的制备采用间接标记法,向含有10 μl T7 溶液(1 mg/ml)的离心管内依次加入500 μl 乙二胺二乙酸(20 mg/ml,溶于0.1 mol/L NaOH 溶液)、500 μl N-三(羟甲基)甲基甘氨酸(40 mg/ml,溶于PBS)、25 μl 二水氯化亚锡(1 mg/ml,溶于0.01 mol/L稀盐酸中)及500 μl 新鲜淋洗的Na99TcmO4(370 MBq),95℃反应15 min。采用Sep-park C18 SPE 柱分离纯化标记物,采用快速薄层纸层析法中2 种展开体系各组分的占比计算99Tcm-T7 的标记率。取100 μl标记物分别与等体积的生理盐水和新鲜胎牛血清混匀,2 组混合液均置于37℃恒温箱中孵育,于4 h时取样,采用高效液相色谱法测定样品的放射化学纯度(流动相:5%~90%乙腈水溶液、1%三氟乙酸,流速为1 ml/min)。
1.6 体外细胞结合实验及细胞竞争抑制实验
体外细胞结合实验:将PANC-1、MX-1 细胞提前24 h 铺于24 孔板中培养(2×105个/孔),待细胞贴壁后弃去旧培养基,每孔加入74 kBq 标记探针99Tcm-T7,于37℃恒温箱中孵育,设置15、30、60、120、240 min 时间点,分别于上述时间点收集上清及PBS,随后每孔加入800 μl NaOH(0.1 mol/L)溶液,待贴壁细胞完全裂解后,收集细胞裂解液。
细胞竞争抑制实验:本实验中的孵育时间根据体外细胞结合实验结果确定,使用PANC-1 细胞作为实验组进行后续实验。将PANC-1 细胞提前24 h铺于24 孔板中培养(2×105个/孔)。PANC-1 实验组每孔加入74 kBq 标记探针99Tcm-T7;PANC-1 阻断组需提前60 min 加入未标记多肽T7 封闭,随后每孔加入74 kBq 标记探针99Tcm-T7。置于37℃恒温箱中孵育1 h。收集上清、PBS 及800 μl NaOH溶液裂解所得的细胞液。使用自动γ 计数仪测定每组细胞液的放射性计数,计算细胞在每个时间点的总结合率。
1.7 裸鼠皮下移植瘤模型的建立
分别将处于对数生长期的PANC-1 细胞及MX-1 细胞接种于Balb/c-nu 裸鼠上肢皮下[5×106个/(100 μl·只),12 只/组],常规饲养并隔日观察裸鼠状态及移植瘤生长情况,待皮下肿瘤体积达到100~300 mm3时用于后续实验。
1.8 荷瘤裸鼠micro SPECT/CT 显像
PANC-1 细胞、MX-1 细胞荷瘤裸鼠模型(4 只/组)分别经尾静脉注射99Tcm-T7 37 MBq(约150 μl),并分别于注射后30、60 min 时行小动物micro SPECT/CT 显像。
1.9 荷瘤裸鼠的生物学分布实验
PANC-1 细胞、MX-1 细胞荷瘤裸鼠模型(5 只/组)经尾静脉注射99Tcm-T7 3.7 MBq(约100 μl),于注射后30 min 经颈椎脱臼法处死,解剖取得重要器官及肿瘤组织并称重,用自动γ 计数仪测量其放射性计数,衰减校正后计算各脏器及肿瘤的每克组织百分注射剂量率(percentage activity of injection dose per gram of tissue, %ID/g)。
1.10 放射性磷屏自显影及组织病理学检查
将荷瘤裸鼠的肿瘤组织及重要脏器的快速冰冻切片样品贴于磷屏上,置于暗室内曝光15~20 min,随后固定于磷屏扫描仪滚筒进行扫描,使用磷屏扫描仪配套软件OptiOuant 分析扫描结果。小动物micro SPECT/CT 显像实验结束后,即刻用10%多聚甲醛将肿瘤组织固定,随后经组织脱水、石蜡包埋后切片。取肿瘤组织切片,经常规苏木精-伊红染色后封片;封闭固定后,用TfR 单克隆抗体进行免疫组织化学染色并封片,于显微镜下观察肿瘤组织切片并记录。
1.11 统计学分析
应用GraphPad Prism 6.0 软件对数据进行统计学分析。符合正态分布的计量资料以±s表示,2 组间数据的比较采用独立样本t检验(方差齐)。P<0.05 为差异有统计学意义。
2 结果
2.1 肿瘤细胞表面TfR 的表达水平
流式细胞术实验结果显示,PANC-1 细胞可与TfR 单克隆抗体特异性结合,结合率为(98.9±0.1)%,这说明PANC-1 细胞表面高表达TfR;而MX-1 细胞与TfR 单克隆抗体未见明显结合,结合率为(0.2±0.1)%,这表明MX-1 细胞表面的TfR 呈相对低表达(图1)。

图1 流式细胞术测定人胰腺癌 PANC-1 细胞(A)和人乳腺癌MX-1 细胞(B)表面转铁蛋白受体的表达水平 APC-A 为藻蓝蛋白;FSC-A 为前向角散射Figure 1 Expression levels of transferrin receptor in human pancreatic cancer PANC-1 cells (A) and human breast cancer MX-1 cells (B) by flow cytometry
2.2 99Tcm-T7 的标记率及体外稳定性
99Tcm-T7 的标记率>95%。在室温下,99Tcm-T7分别在与生理盐水、胎牛血清的混合液中孵育4 h后的放射化学纯度为(95.3±0.3)%和(90.6±0.4)%。
2.3 体外细胞结合实验及细胞竞争抑制实验结果
PANC-1 细胞与分子探针99Tcm-T7 的结合率在孵育后60 min 时达到峰值[(16.12±0.01)%],显著高于MX-1 细胞[(1.20±0.01)%],且二者间的差异有统计学意义(P<0.001,图2),同流式细胞术测定的TfR 表达水平一致。同时,PANC-1 阻断组对99Tcm-T7 的 结 合 率 降 低 至(2.40±0.01)%,低 于PANC-1 实验组,且二者间的差异有统计学意义(t=26.91,P<0.001)。

图2 人胰腺癌PANC-1 细胞和人乳腺癌MX-1 细胞与分子探针99Tcm-T7 的结合率 a 表示在60 min 时,与MX-1 细胞相比,差异有统计学意义(t=28.67,P<0.001)。T7 为组氨酸-精氨酸-脯氨酸-酪氨酸-异亮氨酸-丙氨酸-组氨酸Figure 2 Binding rate of human pancreatic cancer PANC-1 cells and human breast cancer MX-1 cells to molecular probe 99Tcm-T7
2.4 荷瘤裸鼠的micro SPECT/CT 显像
在PANC-1 荷瘤裸鼠模型中,99Tcm-T7 可迅速靶向肿瘤部位,注射后30 min 肿瘤轮廓显影清晰,较短时间即可获得较高的肿瘤/肌肉比值(2.80±0.22),而MX-1 细胞对99Tcm-T7 的摄取程度较低,未见明显显影。99Tcm-T7 从血液中的清除速率快,主要经肾脏排泄,注射后60 min 时除肾脏及膀胱见显像剂分布外,其余组织较少见显像剂滞留(图3)。

图3 荷人胰腺癌、人乳腺癌裸鼠注射分子探针99Tcm-T7 后不同时间点的micro SPECT/CT 显像图 白色虚线内为肿瘤组织;右侧彩色条带中,红色代表摄取最高值,黑色代表摄取最低值。T7 为组氨酸-精氨酸-脯氨酸-酪氨酸-异亮氨酸-丙氨酸-组氨酸;SPECT 为单光子发射计算机体层摄影术;CT 为计算机体层摄影术Figure 3 Micro SPECT/CT images of nude mice bearing human pancreatic cancer and human breast cancer after injection of molecular probe 99Tcm-T7
2.5 99Tcm-T7 在荷瘤裸鼠体内的生物学分布
由表1 可知,99Tcm-T7 经尾静脉注射进入荷瘤裸鼠体内后,除肾脏及肿瘤组织外,其余器官及组织本底均较低,PANC-1 细胞对99Tcm-T7 的摄取在注 射后30 min 即 达 到(0.55±0.18)%ID/g,高 于MX-1 细胞 [(0.16±0.11)%ID/g],且二者差异有统计学意义(P<0.001)。
表1 荷人胰腺癌、人乳腺癌裸鼠注射分子探针99Tcm-T7 后30 min 的体内生物学分布(%ID/g,n=5, ±s)Table 1 Biodistribution of molecular probe 99Tcm-T7 in nude mice bearing human pancreatic cancer and human breast cancer at 30 min post injection (%ID/g, n=5, ±s)

表1 荷人胰腺癌、人乳腺癌裸鼠注射分子探针99Tcm-T7 后30 min 的体内生物学分布(%ID/g,n=5, ±s)Table 1 Biodistribution of molecular probe 99Tcm-T7 in nude mice bearing human pancreatic cancer and human breast cancer at 30 min post injection (%ID/g, n=5, ±s)
注:a 表示与人乳腺癌PANC-1 细胞比较,差异有统计学意义(t=6.42,P=0.003)。T7 为组氨酸-精氨酸-脯氨酸-酪氨酸-异亮氨酸-丙氨酸-组氨酸;%ID/g 为每克组织百分注射剂量率
器官或组织 人胰腺癌PANC-1细胞 人乳腺癌MX-1细胞血液 0.34±0.06 0.46±0.16脑0.04±0.01 0.04±0.02心0.21±0.01 0.12±0.09肺0.29±0.01 0.67±0.27肝0.34±0.02 1.34±1.70脾0.17±0.04 0.10±0.05肾5.92±0.04 6.25±0.09胃0.36±0.01 0.21±0.09小肠 0.14±0.04 0.14±0.09大肠 0.15±0.03 0.13±0.10肌肉 0.20±0.05 0.10±0.02骨0.10±0.02 0.08±0.66肿瘤 0.55±0.18a 0.16±0.11
2.6 放射性磷屏自显影及组织病理学检查结果
在注射99Tcm-T7 30 min 后,相较于MX-1 细胞,PANC-1 细胞显著摄取99Tcm-T7;在正常组织脏器中,以肾脏摄取最为显著,其次为肝脏(图4)。苏木精-伊红染色法及免疫组织化学染色法结果显示,肿瘤实质内未见明显坏死,在PANC-1 细胞中TfR呈高表达,而在MX-1 细胞中TfR 呈低表达(图5)。
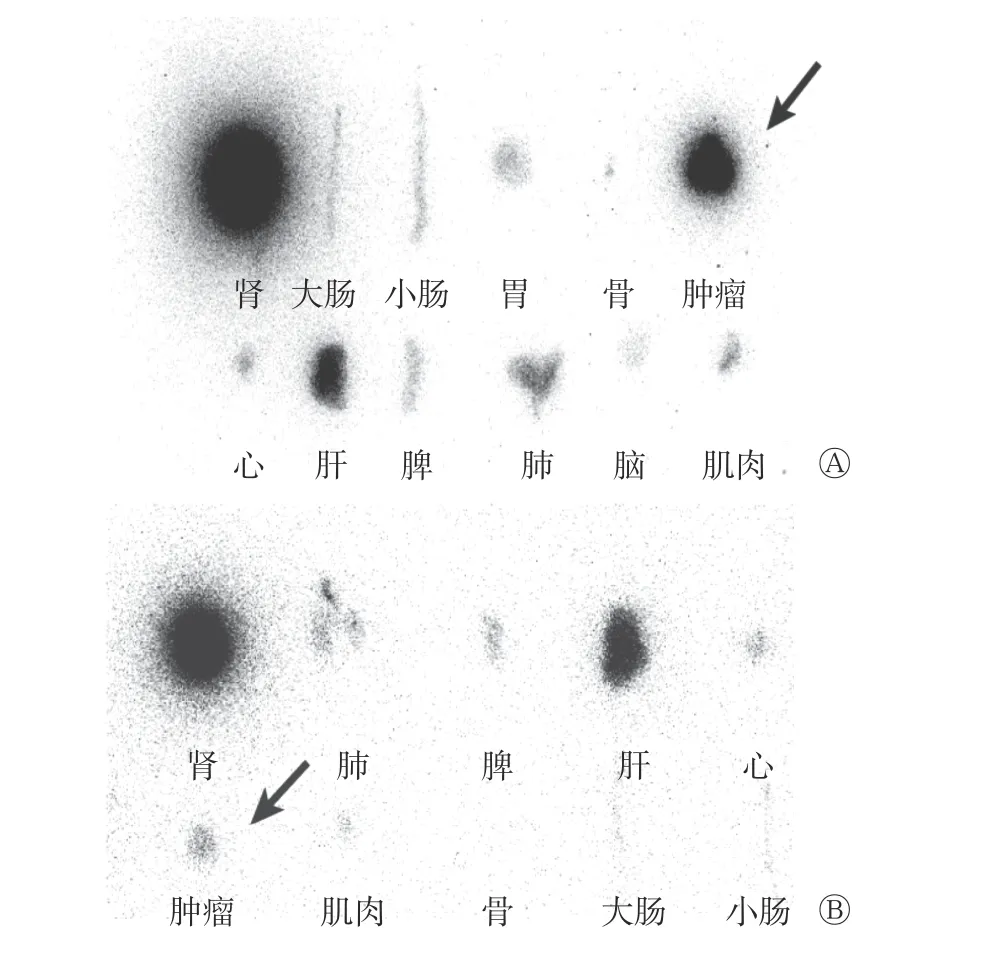
图4 荷人胰腺癌(A)、人乳腺癌(B)裸鼠注射分子探针99Tcm-T7 后的肿瘤组织及离体脏器的放射性磷屏自显影 箭头所示,相较于人乳腺癌MX-1 细胞,人胰腺癌PANC-1 细胞显著摄取99Tcm-T7。T7 为组氨酸-精氨酸-脯氨酸-酪氨酸-异亮氨酸-丙氨酸-组氨酸Figure 4 Radio-autographs of tumor tissues and isolated organs in nude mice bearing human pancreatic cancer and human breast cancer after injection of molecular probe 99Tcm-T7
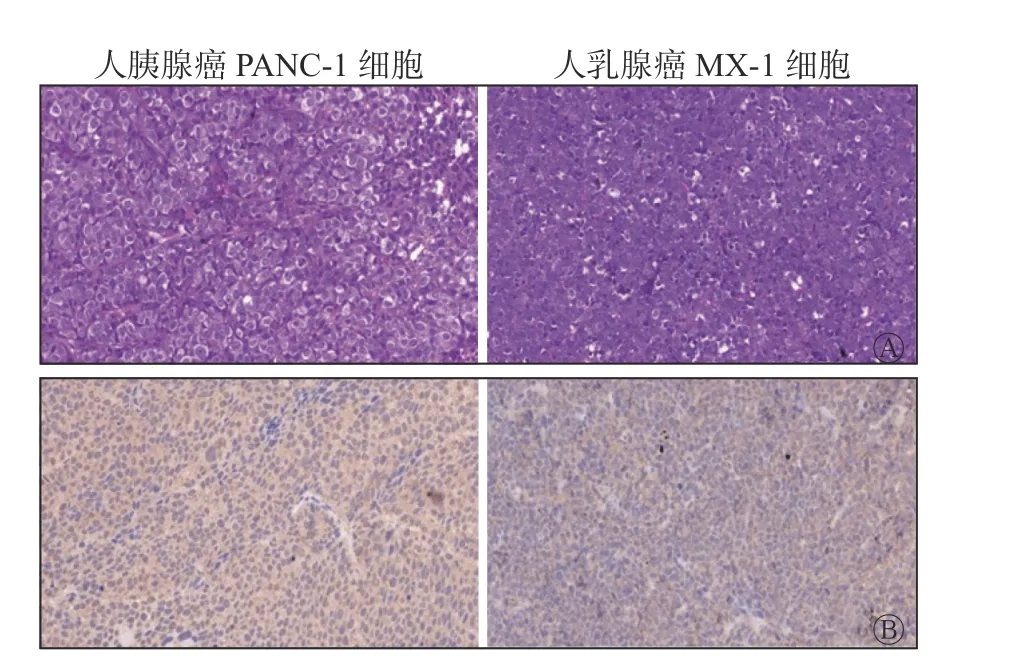
图5 荷人胰腺癌、人乳腺癌裸鼠注射分子探针99Tcm-T7 后的肿瘤组织转铁蛋白受体的组织病理学检查图(×400) A 为苏木精-伊红染色法,镜下可见肿瘤组织内未见明显坏死;B 为免疫组织化学染色法,棕黄色表示肿瘤组织转铁蛋白受体染色,蓝色表示细胞核染色。T7 为组氨酸-精氨酸-脯氨酸-酪氨酸-异亮氨酸-丙氨酸-组氨酸Figure 5 Histopathological examination of transferrin receptors in tumor tissues of nude mice bearing human pancreatic cancer and human breast cancer after injection of molecular probe 99Tcm-T7(×400)
3 讨论
相关研究结果表明,TfR 参与肿瘤细胞的生长、增殖等一系列的生命活动[10-14]。因肿瘤细胞增殖活跃,为了满足其相对旺盛的铁需求,多种肿瘤细胞表面的TfR 水平显著上调。因此,TfR 成为极具研究价值的肿瘤分子靶点之一。
近年来,多个课题组针对TfR 这一分子靶点展开了一系列的研究。2012 年,Holland 等[10]首次构建并利用89Zr-转铁蛋白对前列腺癌小鼠模型行PET/CT 显像,实现了活体监测TfR 的动态变化。Henry 等[11]的研究结果证实,89Zr-转铁蛋白PET显像可用于监测三阴性乳腺癌小鼠对溴结构域蛋白4 抑制剂的疗效反应。但转铁蛋白的分子量较大(相对分子质量76 000~81 000),在血液中的清除速率慢,肝脏摄取本底高,显像时间较长。而小分子多肽T7 具有相对分子质量小、组织穿透性强、血液清除速率快等优势,有望成为更为理想的靶向肿瘤TfR 的分子探针[12-14]。
本研究设计并采用间接标记法合成了靶向TfR 分子的多肽分子探针99Tcm-T7。相较于直接标记法,该标记过程更简易,且对标记分子的生物活性影响更小、标记产物更为稳定[15]。该方法合成的99Tcm-T7 具有标记率高、稳定性好等优点,且micro SPECT/CT 显像操作简便、成本较低,使得该探针更加易于推广应用。
为了验证99Tcm-T7 监测肿瘤表面TfR表达的可行性,本实验针对TfR 表达量不同的2 种人源性肿瘤PANC-1 和MX-1 细胞开展了体内外的相关研究。实验结果表明,高表达TfR 的PANC-1 细胞对99Tcm-T7 摄取显著,且过量的未标记多肽可阻断对99Tcm-T7 的摄取,对应的荷瘤裸鼠模型显像清晰;相对低表达TfR 的MX-1 细胞在体内、体外对99Tcm-T7 的摄取均较低。体外细胞及活体动物实验结果表明,肿瘤表面的TfR 分子介导了99Tcm-T7的特异性摄取,其摄取与肿瘤组织中TfR 的表达水平相关。生物学分布实验结果显示,99Tcm-T7 在体内主要经肾脏排泄,这一特点与多肽的相对分子质量小和极性相关,符合小分子多肽在体内代谢的一般特性[16]。本研究仍存在一定的不足之处,在荷瘤裸鼠活体显像实验中,以荷瘤裸鼠的皮下移植瘤为主,后续需要进一步探索及研究多肽标记探针在监测原位瘤模型中TfR 表达水平的可行性。
综上所述,本研究成功完成了对靶向肿瘤TfR的小分子多肽T7 的核素标记,其制备流程简易,标记率高,稳定性好,体内清除迅速,肿瘤靶向性佳,显像效能良好,具备无创、在体实时监测肿瘤表面TfR 表达的潜能。
利益冲突所有作者声明无利益冲突
作者贡献声明肖晴负责实验的实施、论文的撰写;潘芯负责协助实验及数据的采集;李崇佼负责动物实验的指导;蒋亚群负责放射性药物标记实验的指导;王怡春负责数据的分析、论文的审阅;文兵、雷萍负责基础实验的指导;何勇负责课题的提出与设计、论文的审阅与修订
