HMGB1对草酸钙诱导肾小管上皮细胞分泌NF-κB的调控作用
2022-07-27杨彦超黎承杨
杨彦超,黎承杨
(广西医科大学第一附属医院泌尿外科,广西 南宁530021)
0 引言
肾结石是一种泌尿系统常见的疾病,发病率约为 10%~15%[1]。肾结石由与有机物质混合的矿物质晶体聚集组成,并根据其主要晶体成分来命名,总体可分为三大类,分别是代谢性结石、感染性结石和药物性结石。肾结石的发病机制复杂,可受到代谢、遗传、环境等多因素的相互影响,而临发挥重要的作用床上以草酸钙构成的肾结石最为常见[2]。其中大约有80%的肾结石主要由草酸钙(CaOx)晶体和不同量的磷酸钙(CaP)混合而成。在多项体外细胞实验[3-4]证实,草酸钙可诱导HK-2细胞大量表达炎性细胞蛋白,并引起肾小管出现炎症反应,故草酸钙晶体刺激肾小管细胞产生炎性损伤被认为是在结石形成及发展的过程中发挥不可忽视的作用,是肾结石防治的重点关注领域之一。作为近些年被大量关注的炎性蛋白,炎性高迁移率族蛋白B1(HMGB1)和核因子κB(NF-κB)一直是多种器官出现炎症过程中大量分泌的炎性细胞蛋白,并在多种炎症反应当中起到关键作用。HMGB系列包含HMGB1、HMGB2、HMGB3。HMGB1是第一个被确定的HMGB家族蛋白,其表达几乎在所有种类的细胞中普遍存在, HMGB2主要在成年动物睾丸及淋巴组织中出现,HMGB3基本只在胚胎及造血干细胞中进行表达。真核细胞中HMGB1作为一种核蛋白,在脑、肾、淋巴组织等组织结构中分布非常广泛且含量丰富。HMGB1在细胞核内与DNA不紧密结合,可以发挥维持核小体稳定,在有序调节DNA复制、转录及修复中起关键性作用[5]。由于HMGB1与细胞核染色质结合的不够牢固,当受到炎性刺激导致细胞核膜的通透性增加时,HMGB1可分泌至细胞质及细胞外环境中,通过与其他细胞表面的受体结合,发挥其促炎性作用。被分泌到细胞外的HMGB1可以成为一种炎症介质[6],与内皮细胞、平滑肌细胞等多种细胞表面的TLR4和RAGE受体高亲和度结合,使细胞MAPKs 途经进行激活,对核因子κB(NF-κB)进行活化,最终启动TLR4/NF-κB炎症信号通路。在临床研究中发现,在内毒素(LPS)及炎症因子刺激下,巨噬细胞、上皮细胞等均能分泌HMGBl产生炎症反应 。在对脓毒血症进行分析[7]时发现,在肾组织当中,HMGB1发生聚集,并分泌至尿液当中并高亲和力结合肾小管上皮细胞细胞膜表面的Toll样受体4 (TLR4),致使肾小管上皮细胞变成促炎性分泌细胞。这一现象表明在肾脏发生炎症反应时,HMGB1及其下游介导的炎性细胞因子对肾小管上皮细胞发生炎性反应有重要影响作用。通过我们近期的研究发现,在成功建立细胞-结石体外模型后,处于草酸钙晶体环境当中的肾小管上皮细胞也能大量分泌HMGB1和其他炎性因子。所以,HMGB1是否在草酸钙结石形成过程中发挥中心地位是值得我们进行深入研究的。
根据最新的研究结果可以证实,在肾结石的产生和发展过程中有多种炎性细胞因子产生并发挥重要作用,其中一些炎性细胞蛋白的表达增多,其中包括NF-κB与HMGB1。而这些炎性细胞因子所形成的炎性信号通路联络当中,各个炎性蛋白之间是否存在相互联系非常值得深入研究,在炎性信号通路中HMGB1是否位于中心调控地位是我们所关注的问题。
甘草酸 (Glycyrrhizic Acid)是一种直接高效的高迁移率族蛋白B1(HMGB1)抑制剂,通过调节p38和p-JNK信号通路,而不影响p-ERK信号通路,从而抑制依赖于HMGB1的炎症分子表达和氧化应激反应[8]。
但至今为止,国内外对于通过调控HMGB1来影响草酸钙晶体诱导人肾小管上皮细胞后分泌NF-κB的研究甚少。因此,我们通过体外细胞实验,构建了细胞-草酸钙晶体模型,并通过甘草酸特异性抑制HMGB1,以及利用HMGB1 RNA干扰慢病毒感染正常HK-2细胞来敲低细胞中HMGB1的表达量的方式,以观察HMGB1对于NF-κB的影响作用。
1 对象与方法
1.1 药物与试剂
甘草酸(上海蓝木化工有限公司);草酸钙晶体(美国Sigma Aldrich公司);HMGB1 RNA干扰慢病毒(吉凯基因有限公司);HK-2专用培养基(武汉普诺塞生命科技有限公司);兔抗β-actin多克隆抗体(生工生物工程(上海)股份有限公司);兔抗HMGB1、NF-κB多克隆抗体(美国cell signaling technology公司);HK-2细胞(中华细胞库)。
1.2 细胞培养及模型的建立
HK-2细胞使用HK-2专用培养基,放置于37℃、5%CO2的恒温培养箱中进行培养,待细胞融合度大约80%左右时进行传代,根据实验设计随机进行细胞分组。将HK-2细胞随机分成4组:对照组(HK-2细胞传代后使用HK-2培养基培养);草酸钙晶体干预组(使用HK-2专用培养基进行培养,待细胞融合度达80%后使用含8mmoL/L草酸钙晶体的HK-2专用培养基,干预24h);甘草酸干预+草酸钙晶体干预组(使用HK-2专用培养基进行培养,待细胞融合度达80%后使用5moL/L甘草酸预处理2 h,再在培养基中加入草酸钙晶体使HK-2专用培养基中含5mmol/L甘草酸和8 mmol/L草酸钙晶体,干预24h);HMGB1敲低+草酸钙晶体干预组(利用HMGB1 RNA干扰慢病毒与HK-2细胞共培养,感染效率80%以上后更换含8mmoL/L草酸钙晶体的HK-2专用培养基,培养24h),24h后对细胞进行蛋白提取。
1.3 蛋白质印迹法检测NHMGB1和NF-KB的表达情况
根据实验设计建立对应细胞干预模型后,分别对4组HK-2细胞的蛋白进行提取,分装后放置-80℃冰箱进行冷冻保存。随后通过电泳在SDS-PAGE 10%分离胶上分离样品中所包含的蛋白质样品,再通过电转印技术,将蛋白质转印至PVDF膜上并根据分子量进行剪裁。电转印结束后使用脱脂奶粉对含有目标蛋白的PVDF膜进行封闭1h,然后使用目标蛋白对应一抗在4℃环境中孵育12h,再在24℃且避光条件下与对应蛋白兔抗二抗放置于匀速摇床上恒温孵育1h后,在无菌PBS溶液中清洗三次(10min/次)后,利用LI-COR公司的Odyssey Fc成像系统对条带进行显像,利用ImageJ软件进行分析。
1.4 统计学方法
使用SPSS 22.0软件对所得数据进行统计分析,经分析计量资料均符合正态分布,并显示为Mean±SD。采用方差分析对多组样本间均数进行比较。以P<0.05差异有统计学意义。
2 结果
2.1 草酸钙晶体干预对HK-2细胞HMGB1和NF-κB表达的影响
采用蛋白质印迹法得出结果并进行统计分析可得,草酸钙晶体干预组和对照组相比,HMGB1(1.660±0.056与1.126±0.095,P<0.05)和NF-κB(1.001±0.019与0.651±0.177,P<0.05)的相对表达量明显增加(图1)。
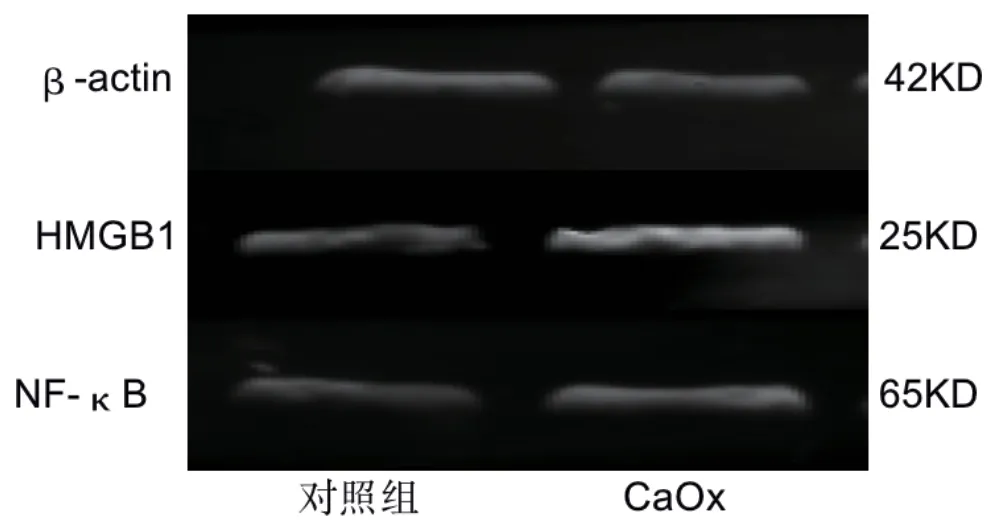
图1 蛋白质印迹法检测对照组和草酸钙晶体刺激组HK-2细胞中HMGB1和NF-κB的表达
2.2 甘草酸预干预对草酸钙晶体诱导HK-2细胞HMGB1和NF-κB表达的影响
采用蛋白质印迹法得出结果并进行统计分析可得,甘草酸干预组与草酸钙晶体干预组对比之 下HMGB1(1.040±0.051与1.685±0.101,P<0.05)和NF-κB(0.287±0.023与4.658±0.108,P<0.05)的相对表达量有显著降低(图2)。
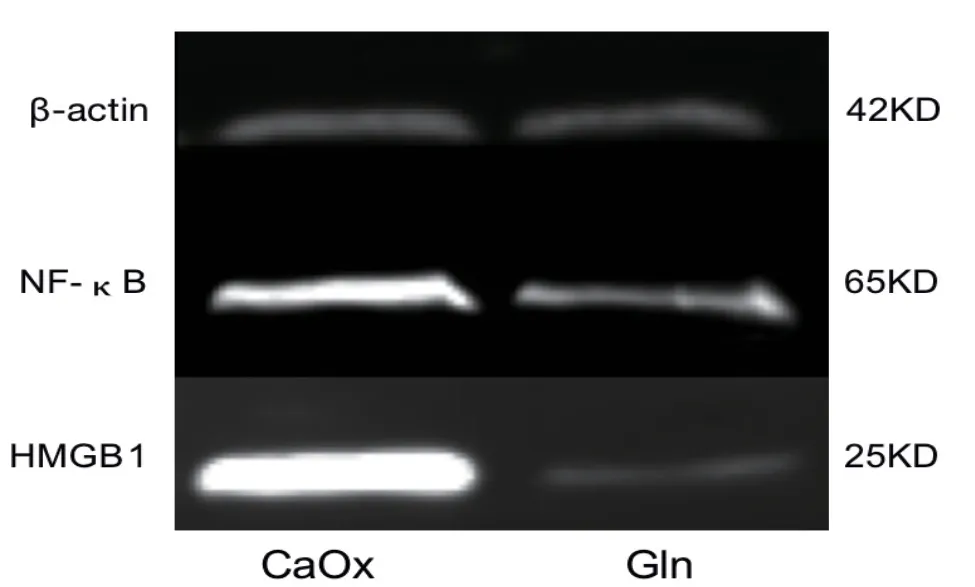
图2 蛋白质印迹法检测草酸钙晶体刺激组和甘草酸干预组HK-2细胞中HMGB1和NF-κB的表达
2.3 用HMGB1 RNA干扰慢病毒技术敲低细胞HMGB1的转录对草酸钙晶体诱导HK-2细胞HMGB1和NF-κB表达的影响
使用HMGB1 RNA干扰慢病毒感染HK-2细胞24h后更换正常HK-2专用培养基进行培养,并每天更换培养基至培养7天后,使用倒置相差荧光显微镜观察慢病毒感染HK-2细胞后表达的绿色荧光蛋白(GFP),病毒感染效率已达到80%(图3)。
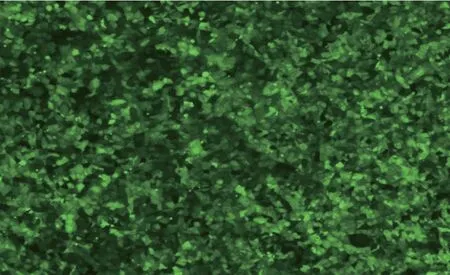
图3 免疫荧光检测HMGB1 RNA干扰慢病毒的感染效率
采用蛋白质印迹法得出结果并进行统计分析可得,HMGB1敲低组和草酸钙晶体干预组对比,HMGB1(0.709-0.012与0.988-0.011,P<0.05)和NF-κB(0.603-0.011与0.872-0.073,P<0.05)的相对表达量有显著降低(图4)。
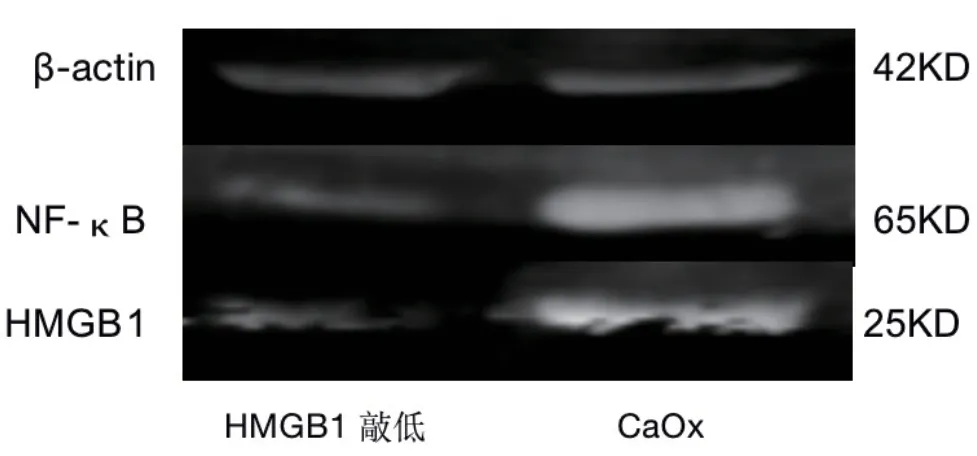
图4 蛋白质印迹法检测HMGB1敲低组和草酸钙晶体干预组HK-2细胞中HMGB1和NF-κB的表达
3 讨论
草酸钙为主要构成成分的肾结石,一直以来都是研究的重点。草酸钙结石的发病机制与炎症、铁死亡,内质网自噬等均有复杂的关系。实验和临床研究结果表明,在草酸钙结石环境中,肾小管上皮细胞被诱导产生过量的活性氧ROS,引起炎症并诱发损伤[9-10]。HMGB1介导的肾内炎症会导致小鼠急性和慢性草酸中毒,并导致促炎因子TLR4和NF-κB诱导肾小管上皮坏死并促进草酸钙沉积[11]。
炎性因子高迁移率族蛋白(HMGB1)是一类在真核细胞中的核蛋白,分布广泛且含量丰富,在凝胶电泳当中迁移较快而被命名[12]。由于HMGB1与细胞核染色质结合的不够牢固,当受到炎性刺激导致细胞核膜的通透性增加时,HMGB1可分泌至细胞质及细胞外环境中,通过与其他细胞表面的受体结合,发挥其促炎性作用。HMGB1从核内分泌至细胞外环境可以通过主动和被动两种途径,既可以主动通过有免疫活性的炎症细胞和单核/巨噬细胞排出胞外,除此以外可以通过坏死组织和细胞进行被动释放[13]。排出到细胞外的HMGB1作为一种介导细胞炎症的细胞因子,通过与细胞膜表面的TLR4和RAGE受体结合来介导细胞内产生炎症反应,从而激活TLR4/NF-κB信号通路,并释放下游炎症因子,如IL-6、IL-1β、TNF-α等。在细胞内分泌的TNF-α、IL-6和HMGB1等又可以增加细胞释放过量的HMGB1,从而通过正反馈循环放大炎症反应[14]。多项研究表明,HMGB1可能在许多炎症性疾病(如败血症和类风湿性关节炎)中作为初始损伤和随后的炎症反应之间的连接分子发挥放大作用,最终导致器官或组织损伤[15 ,16]。在大鼠模型和血管内皮细胞炎性损伤的体外模型中,HMGB1抑制可以有效地发挥对致死性脓毒症的保护作用[17]。
综上所述,HMGB1可以通过影响NF-κB等细胞因子的分泌,调控草酸钙晶体造成的人肾小管上皮细胞的炎性因子分泌,从而减轻细胞的炎性损伤。目前可用于治疗泌尿系结石造成的肾小管上皮细胞的炎性损伤的研究较少,通过干预HMGB1使其下游关联炎性因子分泌减少,对尿石症肾小管上皮细胞的保护和治疗提供了新的策略。
