双色荧光成像在体微型显微镜
2022-07-27蓝凯秋杨西斌徐宝腾刘家林周伟熊大曦
蓝凯秋,杨西斌,徐宝腾,刘家林,周伟,熊大曦
(1 中国科学技术大学 生物医学工程学院(苏州),生命科学与医学部,江苏 苏州 215163)
(2 中国科学院苏州生物医学工程技术研究所,光与健康研究中心,江苏苏州 215163)
0 引言
微型显微镜具有在体微型化、大视场快速成像等优点,近年来被广泛应用于脑科学研究中。基于基因编码类钙指示剂(Genetically Encoded Calcium Indicator,GECI)的发展[1],当实验小鼠脑部产生神经冲动时,神经细胞钙离子内流,而这种钙离子荧光指示剂会随着钙离子浓度变化而发生荧光强度变化,结合微型显微镜可以实现自由行为动物大脑神经活动的可视化。目前应用最为广泛的绿色荧光钙离子指示剂为Gcamp 家族[2]。
2011年GHOSH K K 等开发了头戴式微型显微镜,可以在不影响实验动物自由运动的前提下佩戴在动物头上,帮助神经学家能够以单细胞分辨率记录和监测自由行为啮齿动物的大规模钙动力学[3]。之后微型显微镜也发展出了具有不同功能的形态。STAMATAKIS A M 等开发了将钙离子荧光成像与光遗传学[4]相结合的微型显微镜,可以对实验小鼠脑部神经元钙离子荧光成像的同时用光刺激小鼠大脑其他部位神经元实现光遗传控制[5]。SRINIVASAN S 等通过集成了光学连接器,开发了能方便拆卸更改光源的微型显微镜,可以进行光遗传学实验与钙离子荧光成像[6]。DE GROOT A 等进行了微型显微镜的小型化设计,设计了重量仅为1.6 g 的NINscope。可以同时在小鼠头上戴上两台NINscope,分别对两个独立的大脑区域进行成像,具有同时探索脑部不同部位神经的功能[7]。YANNY K 等将微型显微镜与光场显微成像技术[8]相结合,实现了小鼠脑部3D 荧光成像的功能[9]。BAGRAMYAN A 等在微型显微镜中加入了可调谐液晶透镜来实现可控深度扫描成像[10]。SCOTT B B 等重新设计了光学系统并对大鼠脑部皮层成像,虽然设备重量达到了35 g,但视场达到了7.8 mm×4 mm,并通过交替闪烁的光信号矫正了血液动力学响应对钙离子荧光信号的影响[11]。RYNES M L 等为了在不增加微型显微镜体积和重量的前提下进一步提高成像视场,采用了多光源斜入射照明方式,对实验小鼠大脑皮层成像,视场可达8 mm×10 mm[12]。SHUMAN T 等改变了微型显微镜数据传输方式,将数据存储于Micro SD 卡中,去除了线的限制,并发现小鼠大脑海马区CA1 和齿状回的神经元之间的放电具有一定的同步性,然而,癫痫小鼠神经元间的同步遭到了破坏,因此认为癫痫小鼠空间记忆能力衰退的原因可能为海马区的这种去同步性[13]。除探索小鼠脑科学之外,微型显微镜也被运用于其他地方,SEKIGUCHI K J 等将微型显微镜固定于小鼠脊髓之上,进一步加深对正常脊髓背后的神经编码以及由脊髓疾病引起的病理变化的理解[14]。BOLLIMUNTA A 等将微型显微镜应用于猕猴头部实现显微内窥钙离子荧光成像,虽然由于微型显微镜线缆的限制,只能对猕猴做简单的生物实验,但证明了微型显微镜用于研究非人灵长类动物脑科学的可行性[15]。
随着脑科学研究进一步发展,逐渐产生了多色荧光成像的应用需求,如双色荧光成像可以同时获取脑部不同神经细胞群体出现活动时产生的荧光信息,探索脑部神经的功能与它们之间的联系[16],或者矫正实验小鼠自由移动带来的成像伪影[17]。但微型显微镜在双色荧光成像领域研究较少,主要原因在于目前微型显微镜采用的成像元件梯度折射率透镜(Gradient Index lens,GRIN lens)色差较大,难以实现对同一焦面的多色荧光成像。虽然也有通过使用介电超材料对GRIN 透镜进行色差矫正的研究,但相关元件都需要计算定制,具有较高的门槛与成本[18]。另一种消除色差的方法是为每个颜色通道增加专门的图像传感器,这极大地增加了设备的体积和重量。除此之外,还有双色成像带来的荧光串扰问题,大多数荧光指示剂激发光谱较宽,会有一定的重叠区域,同一激发光可能会导致两种不同的荧光指示剂都发射荧光,造成串扰,需要通过图像处理进行矫正。
本文提出了双色荧光成像微型显微镜(Dual-color Fluorescence Imaging Miniature Microscope,DCFIMM)。首先,利用灰度图像传感器通过时分复用获取不同波段的荧光信息;设计了微型消色差镜头代替GRIN 透镜,实现了对光学成像系统色差的矫正;为了尽可能减小微型显微镜的体积,DCFIMM 采用了与Gcamp6s 和近红外钙离子荧光指示剂[19-20]相对应的双波段滤光片组,此荧光激发波段重叠区域较小,减小了荧光串扰,并通过图像处理将荧光串扰矫正,实现双色荧光同时成像;最终通过仿体实验验证了该设备的技术指标及可靠性,具备较好的双色荧光成像能力,预期在脑科学研究中具有较好的应用价值。
1 DCFIMM 设计
1.1 DCFIMM 结构设计
DCFIMM 包括3D 打印的外壳、主电路板(包含灰度图像传感器CMOS 和微控制单元MCU)、micro SD卡、两块装有LED 的电路板、光学系统、实验底座以及可充电锂电池(90MAH),总重量为6.2 g,可对图像进行30 min 左右的连续记录。
由于对实验动物大脑皮层以下部位荧光成像往往需要直径小于1.5 mm 的GRIN 透镜作为物镜或直径更细的中继GRIN 透镜通过手术植入到实验动物脑部[21],因此以自由行为啮齿动物大脑皮层荧光成像和大脑深层荧光成像为应用方向[22],分别设计了用于大脑表层成像的光学系统组成的DCFIMM-SBI(superficial brain imaging)和大脑深层成像的光学系统组成的DCFIMM-DBI(deep brain imaging)。其结构如图1,区别在于物镜设计和结构的改变,在DCFIMM-DBI 中采用了直径仅为1 mm 的微型双胶合透镜作为物镜,并使用了金属套管用于固定透镜和在生物实验时植入到实验动物脑部增加探测深度,材质为生物相容性较好的不锈钢304。
图1标明了各元件在DCFIMM 中的位置以及照明光路和成像光路。DCFIMM 的光学系统主要包括滤光片组和光学成像系统两部分,DCFIMM 主要元件型号与尺寸如表1所示。其中,结合绿色钙离子荧光指示剂Gcamp6s 以及近红外钙离子荧光指示剂的荧光光谱,对双波段滤光片组进行了选型,尽可能减小荧光激发光谱的重叠区域,有效减小了DCFIMM 的体积和荧光串扰。

表1 DCFIMM 主要元件Table 1 The main component of DCFIMM
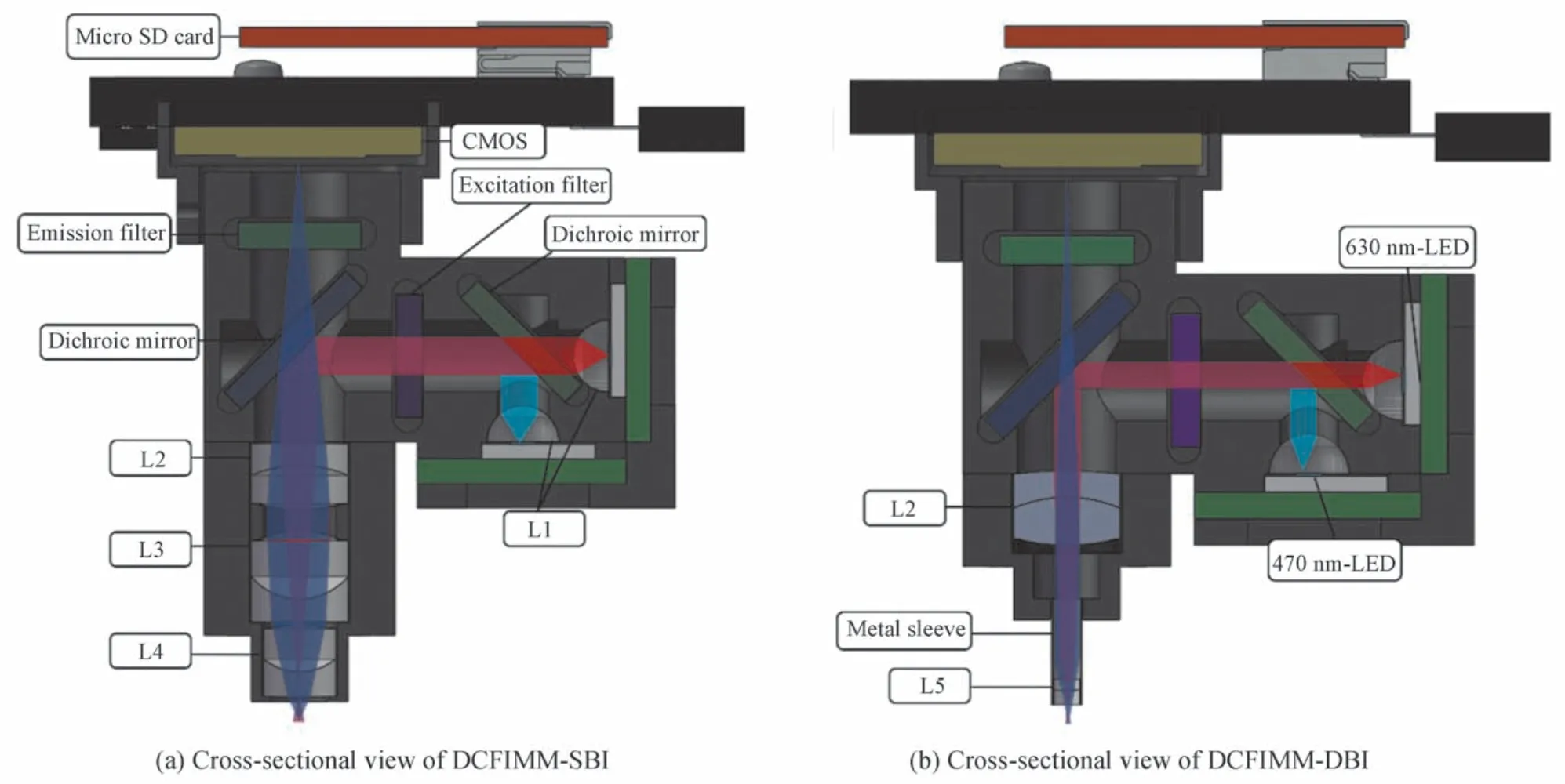
图1 DCFIMM-SBI 及DCFIMM-DBI 剖面图Fig.1 The cross-sectional view of DCFIMM-SBIand DCFIMM-DBI
1.2 DCFIMM 光学设计
GRIN 透镜是目前微型显微镜普遍采用的光学元件,凭借其较为简单的加工工艺,具有直径小、经济、受空间距离限制小等优点而被广泛采用为微型显微镜的物镜。特别是在生物实验中,GRIN 透镜可以在造成较小损伤的条件下植入实验动物脑部,实现成像大脑深层部位神经的功能。但GRIN 透镜也有视场较小,像差难补偿等缺点,尤其对于双色荧光成像来说,有着难以矫正的色散焦移,如图2(a)所示,由于色差影响,GRIN 透镜无法对同一焦面的脑部神经进行双色荧光成像。
相较于GRIN 透镜,光学透镜组具备更为优异的色差矫正能力,光学系统是否消色差取决于初级位置色差系数是否为零,对于薄透镜系统有

式中,φ为透镜的光焦度;υ为透镜玻璃的阿贝数;M为透镜数;h为透镜的半通光口径。可以看出单透镜不能矫正色差,但单正透镜具有负色差,单负透镜具有正色差。因此,消色差的光学系统需要由正、负透镜组成,如图2(b)所示,满足消色差的条件是

图2 透镜聚焦不同波长光示意图Fig.2 Schematic diagram of the lens focusing light of different wavelengths

式中,Ф为光学系统的光焦度。本文采用了微型双胶合透镜组成的消色差镜头代替GRIN 透镜。设计的DCFIMM-SBI 和DCFIMM-DBI 成像光学系统分别如图3(b)、(c)。

图3 光学系统光路Fig.3 Optical path of optical system
图3(a)为由GRIN 透镜(64-519,Edmund)和成像透镜(63-692,Edmund)构成的单色荧光成像微型显微镜光学系统光路图,用于实验对比。为了增大GRIN 透镜光学系统的工作距离使其可以对覆有盖玻片的样品成像,适当调整了GRIN 透镜和成像透镜在微型显微镜中的位置,减小了成像透镜与CMOS 之间的间距。图3(c)中DCFIMM-DBI 光学系统的渐晕光阑由固定微型双胶合透镜的金属套管所致,在增加脑部探测深度的同时导致了边缘视场亮度减弱。
DCFIMM-SBI 和DCFIMM-DBI 成像光学系统的具体元件型号如表2。
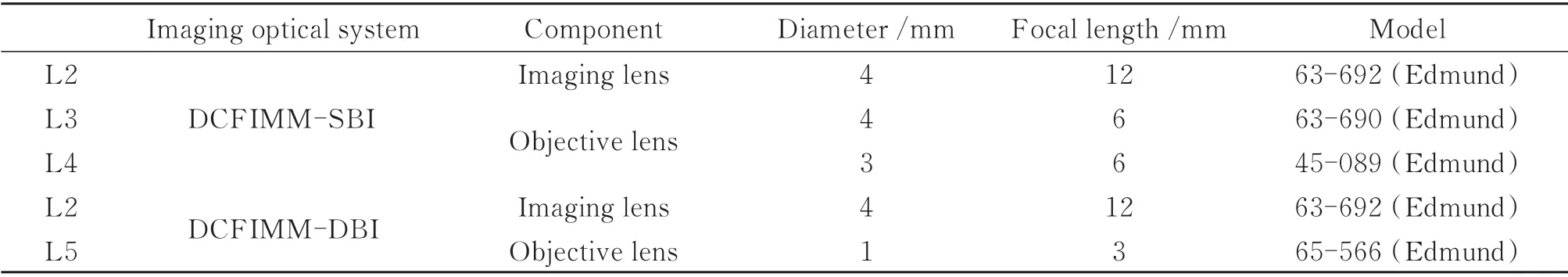
表2 DCFIMM 成像光学系统元件Table 2 The components of DCFIMM imaging optical systems
DCFIMM 的成像光学系统是由物镜和成像透镜组成的无限远矫正光学系统,改变物镜与成像透镜间的间隔不会对光学系统造成影响,DCFIMM 外壳由3D 打印而成,无限远矫正光学系统降低了3D 打印精度不高造成的影响。其次,可以在物镜和成像透镜间插入滤光片,在不影响光学系统的条件下进一步减小微型显微镜的体积。最后,根据不同的实验需求,可以通过更换不同焦距的物镜构建合适放大倍率与工作距离的光学系统,无限远矫正光学系统放大倍数的计算表达式为

式中,M为光学系统放大倍率,fimage为成像透镜焦距,fobject为物镜焦距。结合实验需求,DCFIMM 的成像光学系统设计目标定为以下4 点:首先,要比GRIN 透镜光学系统有更大的工作距离,可以结合微棱镜对垂直大脑皮层平面成像[23],在生物实验时有更大的操作空间;其次,DCFIMM 的光学系统需要更大的视场,能获取更多荧光信息;然后,DCFIMM 的光学系统需要与GRIN 透镜光学系统相当的成像分辨能力,可以对神经元细胞体成像;最后,DCFIMM 的光学系统色差需要矫正,以免影响双色荧光成像效果。通过软件仿真得到DCFIMM 光学设计参数,如表3。

表3 DCFIMM 成像光学系统主要参数Table 3 The main parameters of DCFIMM imaging optical systems
由表3可知,DCFIMM 光学系统的视场和工作距离相较于GRIN 透镜光学系统都有了较大提升。DCFIMM 光学系统与GRIN 透镜光学系统点列图和色散焦移对比如图4。

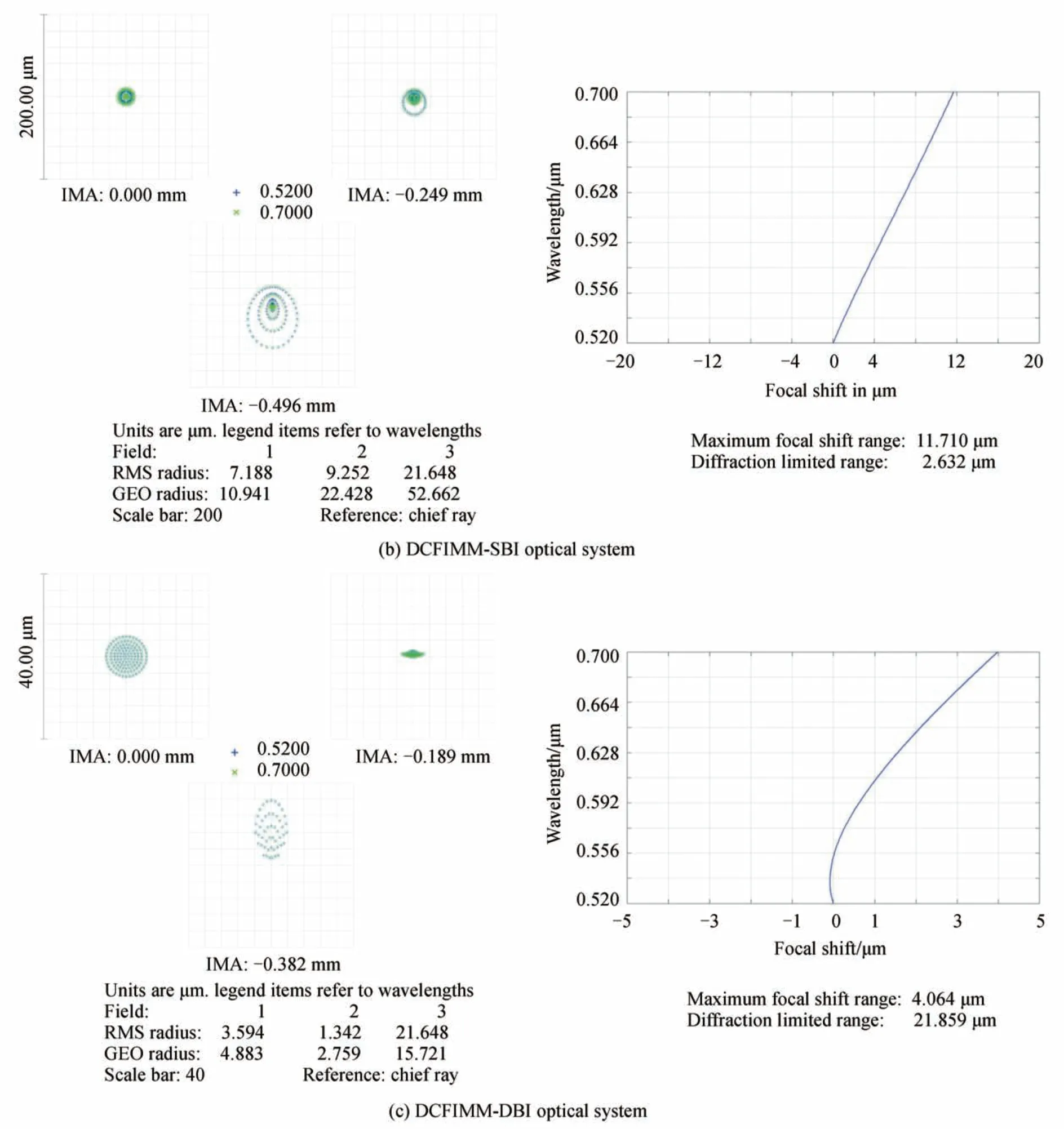
图4 光学系统的点列图和色散焦移Fig.4 Point diagram and chromatic focal shift of the optical systems
如光学系统的点列图可知,DCFIMM-SBI 像点半径RMS 值与GRIN 透镜光学系统接近,分辨能力与GRIN 透镜光学系统相当,DCFIMM-DBI 像点半径RMS 值均小于10 μm,像点集中度高。图4(a)GRIN 透镜光学系统点列图中520 nm 和700 nm 的荧光激发波长所成的像斑有了较大分离,而DCFIMM 光学系统点列图中两波长光所成的像斑大小接近一致,表明DCFIMM 光学系统的色差有了良好的控制。其次,从光学系统的色散焦移图可以看出DCFIMM-SBI 和DCFIMM-DBI 的最大焦移变化分别为11.7 μm 和4.1 μm,相较于GRIN 透镜光学系统49.2 μm 的最大焦移变化也有了较大的改善。
1.3 数据采集与分析
DCFIMM 电路示意如图5(a)。采用可充电锂电池为电路板供电,CMOS(EV76C454,E2V)以20 fps 采集视频图像。如图5(b),当CMOS 工作在奇数帧时,触发MCU(ATSAME70N21A,Atmel)控制中心波长470 nm 的LED 光源发光,当CMOS 工作在偶数帧时,触发中心波长630 nm 的LED 光源发光,从而使DCFIMM 以10 帧/s 获取双色荧光图像。图像数据保存在Micro SD 卡中,实验结束后取出Micro SD 卡进行数据读取和转存。根据不同实验条件,可以对DCFIMM 的工作时间、LED 亮度、CMOS 增益等进行设置。

图5 DCFIMM 电路原理Fig.5 DCFIMM circuit principle
得到视频图像数据后进行分析和图像处理,根据时分复用原理将视频隔一帧抽取,凭借相应激发波长的LED 照射荧光样品的激发亮度更大,将相邻两帧每个像素点的灰度值进行比较,若偶数帧像素点的灰度值大于奇数帧相对应位置像素点的灰度值,则将偶数帧此点的灰度值保留,奇数帧此点的灰度值作为荧光串扰导致的噪声去除。去除荧光串扰后为了区分不同波段的荧光添加相应伪彩,将偶数帧图像添加红色伪彩,奇数帧图像添加绿色伪彩。最后,将两个荧光通道信息图像融合在一起,复制每一帧扩充至与现实时间对应即可得到样品的双色荧光图像视频。
1.4 实验装置
使用USAF 1951 分辨率靶对光学系统的分辨率进行了测试,采用直径13 μm 的绿色荧光微球(FL-PS-G-13,tjdae technology)和红色荧光微球(FL-PS-R-13,tjdae technology),将其配置成荧光微球溶液滴于载玻片上,盖上盖玻片制成荧光微球样品用于验证DCFIMM 的双色荧光成像能力。此外通过对多尺寸荧光微球套件(T14792,TetraSpeck)成像,测试了DCFIMM 的荧光分辨能力,T14792 中每个微球都使用四种不同波长的荧光染料(365/430 nm、505/515 nm、560/580 nm 和660/680 nm)染色。
DCFIMM 成像实验装置如图6,将DCFIMM 实验底座固定在笼板上,实验样品固定于升降台(GCM-1601M,大恒光电)上,实现DCFIMM 与样品之间的相对位移。

图6 DCFIMM 成像实验装置实物Fig.6 Photograph of the DCFIMM imaging experiment
2 实验与结果
2.1 分辨率测试
为了验证DCFIMM 光学系统的成像能力是否可以达到实验要求即分辨率不低于GRIN 透镜光学系统,采用USAF 1951 分辨率靶开展了成像测试,与GRIN 透镜光学系统进行实验对比,结果如图7。
图7中三个光学系统对分辨率靶所成图像的对比度图G7E2 组条纹都有较为明显的波峰,根据瑞利准则,当对比度图波谷的值小于或等于波峰的8/π2(~0.81)时表明该条纹可以被分辨[24]。通过计算测得GRIN透镜、DCFIMM-SBI、DCFIMM-DBI 光学系统的G7E2 组条纹平均波谷波峰对比度值分别为0.71、0.70、0.79,均小于8/π2,表明DCFIMM 光学系统可以分辨分辨率靶的G7E2 组条纹,达到3.47 μm 的分辨率,与GRIN 透镜光学系统的分辨能力相当,达到了设计要求。除分辨能力外,DCFIMM-SBI 光学系统的成像视场达到了1.10 mm×1.10 mm,DCFIMM-DBI 光学系统的成像视场达到了0.77 mm×0.77 mm,均大于GRIN 透镜光学系统0.55 mm×0.55 mm 的视场,在实验时可以获取更多荧光信息。

图7 USAF 1951 分辨率靶成像结果Fig.7 Results of the USAF resolution target imaging experiment
2.2 激发光功率标定
在双色荧光成像实验中,影响荧光样品发射荧光亮度的因素不仅与激发光强度有关,与滤光片组滤光光谱、CMOS 响应光谱、光学系统透射率以及荧光指示剂的荧光光谱都有关联。当设备与样品确定时,LED的强度决定了荧光微球的发射荧光亮度,且不同荧光样品的荧光激发波段会有重叠区域,会有一定的荧光串扰,当470 nm-LED 亮度过大时,激发红色荧光微球的亮度会大于630 nm-LED 激发红色荧光微球的亮度,在图像识别时会出现将红色荧光微球错误识别为绿色荧光微球的情况。所以在对混合荧光微球成像前,需调整LED 的功率对红色荧光微球以及绿色荧光微球成像,确保能正确识别样品。经过LED 功率标定后,当630 nm-LED 功率为3.8 mW,470 nm-LED 功率超过3 mW 时会错误识别红色荧光微球。最终,将470 nm-LED 的功率设置为1.8 mW,630 nm-LED 功率设置为3.8 mW,分别对10 mg/mL 的红色荧光微球和绿色荧光微球样品成像,如图8所示,图像处理后可以看到都正确识别荧光微球的颜色,表明该LED 功率设置可以正确分辨荧光微球样品。

图8 荧光微球成像实验结果Fig.8 Results of the fluorescent microsphere imaging experiment
2.3 双色荧光成像测试
配置1 mg/mL 混合荧光微球样品,用DCFIMM-SBI 对样品成像,得到的图像如图9(a)~(c)。

图9 混合荧光微球成像实验结果Fig.9 Results of the hybrid fluorescent microsphere imaging experiment
图9(a)是获取的混合荧光微球样品视频的偶数帧截图,由630 nm-LED 光激发样品,图9(b)是奇数帧截图,由470 nm-LED 光激发样品。通过亮度的对比正确识别了混合荧光微球颜色,经过图像处理后如图9(c),且相邻位置不同颜色的荧光微球仍被清晰分辨,如图9(e)~(g),证明DCFIMM-SBI 具有双色荧光成像的能力。此外还对4 μm 直径的共染色微球(T14792,TetraSpeck)成像,经过图像处理后如图9(d),微球的红色荧光与绿色荧光几乎成同样大小的像斑,证明色差得到了良好矫正。
为了验证DCFIMM-DBI 光学系统的色差是否得到矫正,通过对混合荧光微球样品调焦成像进行验证,并与GRIN 透镜光学系统对比。GRIN 透镜光学系统成像实验结果如图10(a),图中上方数字表示样品调焦距离。如图10(a)左图所示,由于GRIN 透镜色差的影响,当绿色荧光微球对焦时,红色荧光离焦,470 nm-LED 激发白色箭头所指处微球的荧光强度大于630 nm-LED 激发的荧光强度,箭头处微球被识别为绿色荧光微球。当红色荧光微球对焦时,绿色荧光微球离焦,630 nm-LED 激发白色箭头所指处微球的荧光强度大于47 0nm-LED 激发的荧光强度,箭头处微球被识别为红色荧光微球,如图10(a)。实验证明成像过程中GRIN 透镜的色差会导致离焦荧光样品成像模糊且亮度降低,最终导致双色成像效果差以及对混合荧光微球识别错误。

图10 混合荧光微球调焦对比成像实验结果Fig.10 Results of the hybrid fluorescent microsphere focusing and contrast imaging experiment
用DCFIMM-DBI 对混合荧光微球调焦成像,结果如图10(b)。由于DCFIMM-DBI 更大的成像视场,可以对更多数目的荧光微球成像,并且成功在绿色荧光微球中识别了红色荧光微球,两种波长的荧光微球几乎同时对焦清晰成像,调焦后仍能正确识别混合荧光微球,表明DCFIMM-DBI 的色散焦移得到了良好的矫正,证明了此设备具有双色荧光成像的能力。
3 结论
本文提出了双色荧光成像微型显微镜DCFIMM,通过双LED 随CMOS 信号交替触发获取两种不同波长的荧光信息,并通过双波段滤光片组滤除多余杂光,中心波长为470 nm 和630 nm 的激发光滤光波段也使荧光串扰得到了良好的控制。其次,根据不同的实验需求设计了两套光学系统与结构,为了矫正微型显微镜光学系统的色差,设计了由双胶合透镜组成的消色差镜头作为DCFIMM 物镜,在DCFIMM-DBI 中为了增加可探测脑部的深度,用金属套管将微型双胶合透镜固定。通过DCFIMM 对USAF 1951 分辨率靶成像,测得此设备的分辨率为3.47 μm,DCFIMM-SBI和DCFIMM-DBI视场分别为1.10 mm×1.10 mm和0.77 mm×0.77 mm,相较于单色荧光成像微型显微镜,有着相当的分辨能力和更大的视场。双色荧光混合微球成像实验证明了DCFIMM 的色差得到了良好的矫正,具有双波段荧光成像的能力,展示了所设计的DCFIMM 应用于脑科学研究的潜力。下一步,本设备将用于小动物在体成像实验,测试该设备在实验动物脑部成像时组织散射对成像效果的影响。未来期望能改进DCFIMM,能在矫正色差的同时,增大照明面积与均匀性并减小DCFIMM-DBI 的渐晕效应,应用于生物实验。
