性成熟前不同日龄伊拉兔睾丸和附睾形态学与组织学特征
2022-07-27铁雅楠杨喜喜王志亮王欣荣
铁雅楠,杨喜喜,王志亮,王欣荣
(甘肃农业大学动物科学技术学院,兰州 730070)
睾丸是雄性动物最重要的生殖器官,具有产生精子、传递遗传信息、分泌雄激素、刺激其他性器官发育以及维持机体正常第二性征的作用[1]。附睾则是由输出小管将其与睾丸表层相连的附属器官,它不仅是精子运输的通道,还是精子浓缩,获得运动能力、受精能力以及精子储存的部位[2]。因此,雄性动物的性别分化、性发育、性成熟、繁殖力的维持均与睾丸、附睾的发育密切相关[3]。睾丸及附睾的发育状况及组织学水平的研究可全面映射其结构与功能的变化规律。目前有不少关于动物睾丸组织结构的报道,如贾文玉等[4]研究表明随月龄的增加,羔羊睾丸重量和体积不断增大,在3月龄后增加显著;李红美等[5]研究表明随着日龄增加,太湖猪睾丸曲细精管、精原细胞、初级精母细胞及精子细胞直径均逐渐增加。另外关于马[6]、鸡[7]、小鼠[8]、牛[9]等动物睾丸组织结构的研究均有报道,但对伊拉兔睾丸的生长发育规律报道较少。
伊拉兔属于中型肉兔,公兔在120日龄左右出现爬跨行为,达到初情期,150~160日龄达到性成熟,而体成熟较性成熟晚,一般在性成熟后1~2个月;但这些伊拉兔初情期及性成熟的判定依据大多以行为学观察的结果为主[10-11],而有关伊拉兔初情期及性成熟期出现的组织学、细胞学方面的证据较少。因此本试验以伊拉兔为研究对象,结合兔行为学的基础研究,采用解剖学和组织学方法,对性成熟前不同日龄伊拉兔的睾丸和附睾开展形态学和组织学研究,并测定其组织学参数,包括睾丸细胞、生精小管面积、生精上皮厚度、附睾管直径、柱状上皮细胞厚度及纤毛长度等,根据睾丸、附睾组织形态学变化、细胞学发育特点,以及组织学特征的出现,来判断伊拉兔初情期和性成熟期达到的标志,为伊拉兔初情期、性成熟的确切时间提供直接研究证据,也可为家兔生殖特性的深入研究以及种兔选择、种用价值评定提供相关参考。
1 材料与方法
1.1 试验动物及样品采集
从甘肃某养殖公司购买30日龄体重为1.0 kg±0.2 kg的健康伊拉公兔45只,按照相同饲养标准饲养于甘肃农业大学动物饲养基地,按照日龄研究间隔(30、45、60、75、90、105、120、135、150日龄)共分为9组,每组5只,每隔15 d采集1组兔的样品。采用耳缘静脉注射空气法将伊拉兔处死,采集不同日龄伊拉兔的睾丸和附睾。
1.2 主要试剂及仪器
苏木精染液购自武汉谷歌生物科技有限公司;无水乙醇、二甲苯、盐酸和中性树胶均购自国药集团化学试剂有限公司。石蜡切片机(Leica UC7)购自上海莱卡仪器有限公司;正置光学显微镜(Olympus dp-71)购自尼康公司;游标卡尺(0~150 mm)购自上海恒量量具有限公司;自动脱水机(JJ-12J)、包埋机(JB-P5)和冻台(JB-L5)均购自武汉俊杰电子有限公司;组织摊片机(KD-P)购自浙江金华科迪仪器设备有限公司;电子天平(ME104E)购自深圳林涛仪器有限公司。
1.3 测定指标及方法
1.3.1 睾丸和附睾物理参数测定 用电子天平称量睾丸、附睾的重量;用游标卡尺测量睾丸纵轴长度为睾丸长径,横轴长度为睾丸短径,与横轴垂直的厚度为睾丸厚径,睾丸指数按如下公式计算[12]。
睾丸指数=睾丸重(g)/活体重(kg)
1.3.2 睾丸和附睾组织切片制备及观察 物理参数测定后,将睾丸和附睾在4%多聚甲醛中固定24 h,经脱水、透明、浸蜡、包埋、切片、摊片、粘片和烤片,脱蜡至水后将切片用苏木素染色、盐酸分化、自来水返蓝、水洗后依次投入浓度梯度为50%、75%、85%、95%的酒精中脱水,再加入伊红染色,经无水乙醇、1/2二甲苯(酒精与二甲苯1∶1混合液)、纯二甲苯中透明,最后用中性树胶封片。将制作好的组织切片置于显微镜下观察,并对3个以上的视野拍照,采集其整体或局部照片。
1.4 数据统计及分析
用Image Pro Plus 6.0软件统计睾丸和附睾的物理参数。用SPSS 25.0软件单因素方差分析和LSD法比较各组差异,结果用平均值±标准差表示,P<0.05表示差异显著。
2 结 果
2.1 不同日龄伊拉兔睾丸形态学和组织学变化
2.1.1 睾丸的物理参数 由表1可知,随日龄的增加,睾丸指数、睾丸重、睾丸长径、睾丸短径、睾丸厚径等指标逐渐增加,且150日龄的睾丸指数、睾丸重、睾丸长径、睾丸厚径均显著大于其他各组(P<0.05),而105、120、135、150日龄组睾丸短径显著大于其他各组(P<0.05);105、120、135日龄组睾丸指数、睾丸重、睾丸厚径显著大于30、45、60、75、90日龄组(P<0.05);90日龄组睾丸指数、睾丸重显著高于30、45、60日龄组(P<0.05);60、75、90、105、120、135日龄睾丸长径显著大于30、45日龄组(P<0.05),其余各日龄之间差异不显著(P>0.05)。

表1 不同日龄伊拉兔睾丸的物理参数
2.1.2 睾丸生精小管的物理参数 由表2可知,135、150日龄组生精小管直径显著大于30、45、60、75、90、105日龄组(P<0.05),90、105、120日龄组显著大于30、45、60、75日龄组,75日龄组显著大于30、45、60日龄组(P<0.05);生精小管面积、上皮厚度在120、135、150日龄组显著大于其他日龄组(P<0.05),在75、90、105日龄组显著大于30、45、60日龄组(P<0.05);支持细胞数在90、105、120、135、150日龄组显著大于30、45日龄组(P<0.05);135、150日龄组间质细胞数显著大于30日龄组(P<0.05),其余各日龄间差异不显著(P>0.05)。

表2 不同日龄伊拉兔睾丸生精小管的物理参数
2.1.3 睾丸组织学观察 由图1可知,在光镜下观察到30、45、60日龄睾丸内生精小管排列稀疏,而60日龄较30、45日龄排列紧密,生精小管外可见基膜和梭形肌样细胞,间质组织较多,间质内可见单个或成群分布的间质细胞,生精小管管腔为实心组织,生精小管界膜清晰,仅有1~2层细胞紧贴于基膜上,只能看见精原细胞与支持细胞,精原细胞胞体小、核圆形、着色较深;支持细胞为卵圆形、核仁清晰(图1A~1C)。75、90、105日龄睾丸内生精小管排列紧密,间质成分逐渐增多,生精小管明显逐渐增粗,管腔逐渐形成,生精细胞层数增多,为2~4层,除精原细胞与支持细胞外,生精小管中出现初级精母细胞,位于生精上皮的中层,胞体大,核圆形,着色深;在90、105日龄分别出现圆形精子细胞和长形精子细胞,但无成型精子出现(图1D~1F)。镜下观察120、135、150日龄的睾丸组织,发现其生精小管排列紧密,间质细胞数逐渐增多并成群分布,生精小管增粗明显,管腔腔隙逐渐增大,生精上皮厚度明显增厚,生精细胞层数逐渐增多,细胞自基膜向管腔面有序排列为4~6层,可见各级不同的生精细胞和支持细胞,精原细胞和处于不同分裂期的初级精母细胞明显增多,另外在近管腔面出现较多的精子细胞和变形的精子(图1G~1I)。
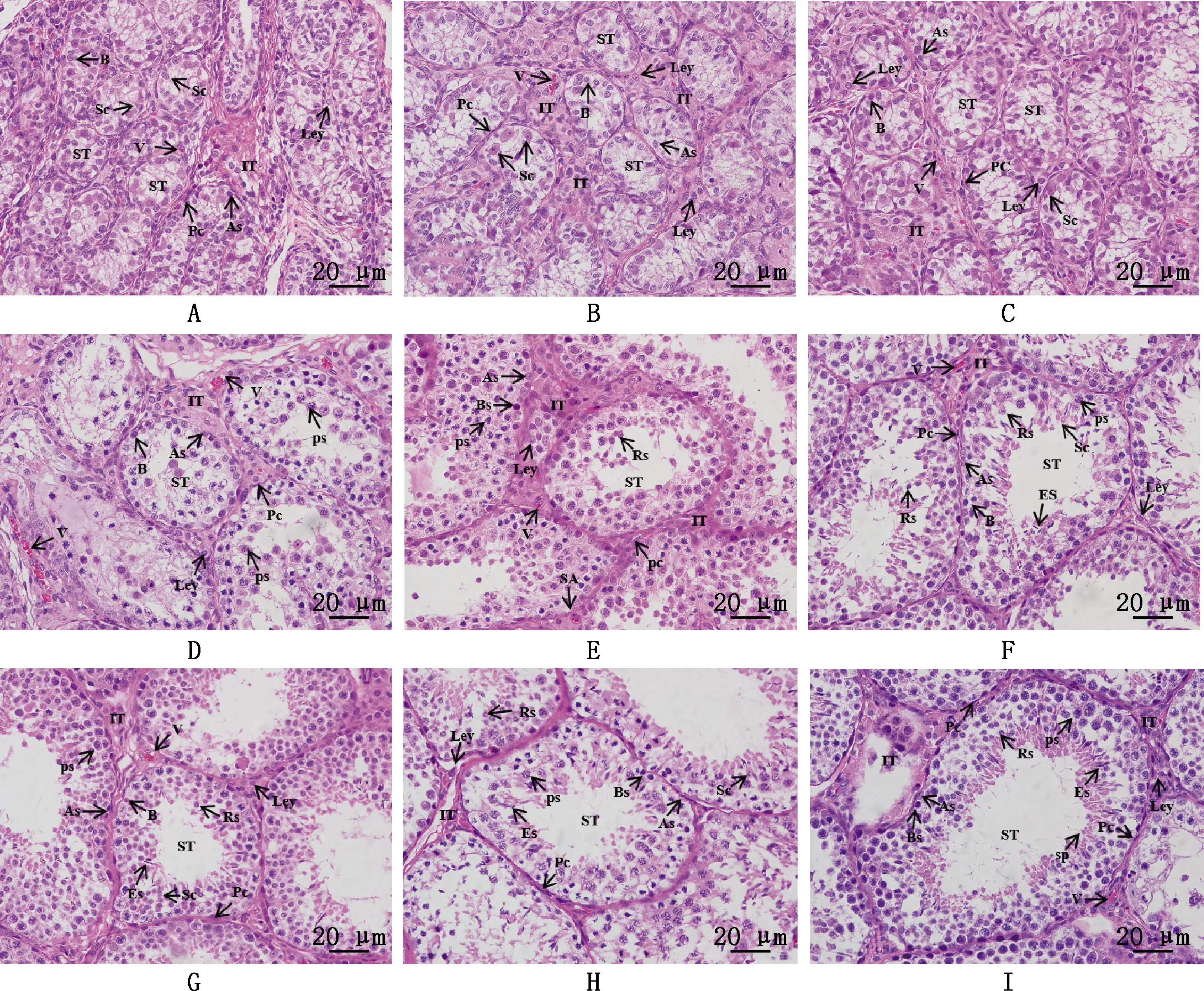
①A~I,分别为30、45、60、75、90、105、120、135和150日龄睾丸组织切片。②A,A型精原细胞;B,B型精原细胞;Sc,Sertoli细胞;ST,生精小管;IT,间质;PC,管周肌样细胞;Ley,Leyding细胞;ps,初级精母细胞;Es,长形精子细胞;Rs,圆形精子细胞;sp,精子;V,血管
2.2 不同日龄伊拉兔附睾形态学和组织学变化
2.2.1 附睾不同部位管径 由表3可知,120、135、150日龄组伊拉兔附睾头、体、尾的管腔外径均显著大于其他各日龄组,且150日龄组显著大于120、135日龄组(P<0.05);105日龄组附睾头、尾管腔外径及内径显著大于30、45、60、75、90日龄组(P<0.05);60、75日龄组附睾头管腔外径及附睾体、附睾尾内径显著大于30、45日龄组(P<0.05);45日龄组附睾头、体、尾外径及附睾体、尾内径显著大于30日龄组(P<0.05);75、90日龄组附睾头、体的管腔外径及附睾体、尾内径显著大于30、45日龄组(P<0.05);45、60、75、90日龄组附睾头、体、尾管腔外径及附睾体、尾管腔内径显著大于30日龄组(P<0.05);60日龄组附睾头管腔外径、附睾体、尾管腔内径显著大于30、45日龄组(P<0.05),其余各日龄间差异不显著(P>0.05)。
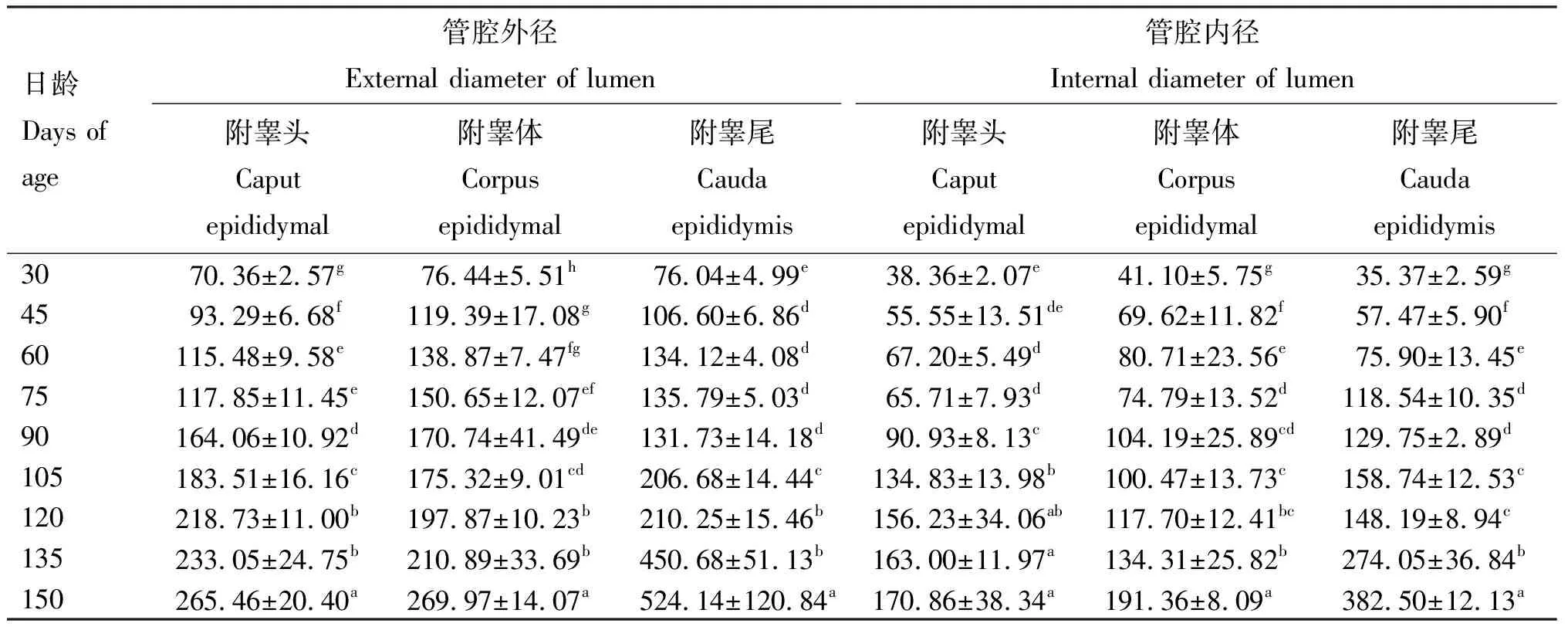
表3 不同日龄伊拉兔附睾组织不同部位管腔内径与外径长度
2.2.2 附睾不同部位上皮厚度和纤毛长度 由表4可知,105、120、135、150日龄组附睾头柱状上皮厚度显著大于其他各日龄组(P<0.05),且60、75、90日龄组显著大于30、45日龄组(P<0.05);90、105、120、135、150日龄组附睾尾柱状上皮厚度显著大于其他各日龄组(P<0.05);75、90、105、120、135、150日龄组附睾体柱状上皮厚度显著大于30、45、60日龄组(P<0.05),60日龄组显著大于30日龄组(P<0.05);60、75日龄组附睾尾的柱状上皮厚度显著大于30、45日龄组(P<0.05),45日龄组显著大于30日龄组(P<0.05);其余各日龄间差异不显著(P>0.05)。
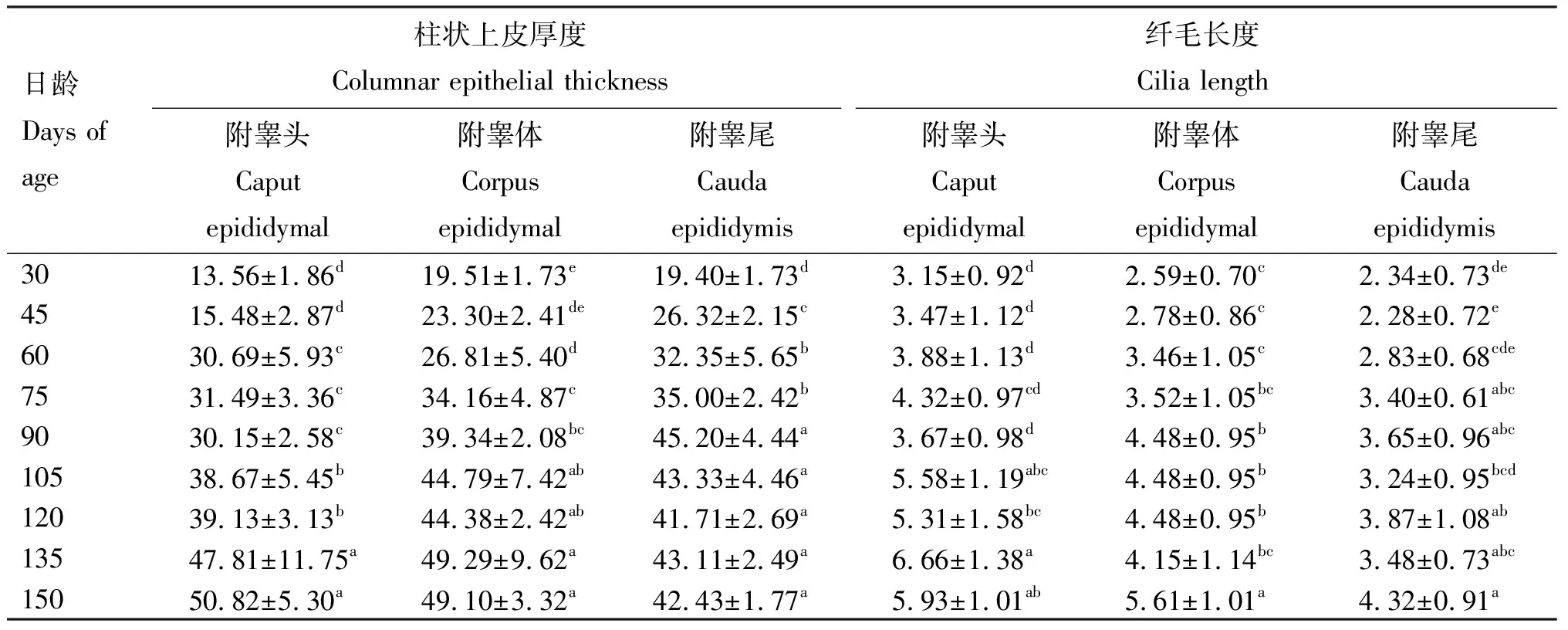
表4 不同日龄伊拉兔附睾不同部位柱状上皮厚度和纤毛长度
在纤毛长度方面,135、150日龄组附睾头的纤毛长度显著大于30、45、60、75、90日龄组(P<0.05),135日龄组显著大于30、45、60、75、90、120日龄组(P<0.05);150日龄组附睾体纤毛长度显著大于其他各日龄组(P<0.05),90、105、120日龄组显著大于30、45、60日龄组(P<0.05);75、90、105、120、135、150日龄组附睾尾的纤毛长度显著大于30、45日龄组(P<0.05);其余各日龄间差异不显著(P>0.05)。
2.2.3 附睾组织学观察 由图2可知,附睾管上皮主要由主细胞、基细胞、晕细胞、顶细胞及管周肌样细胞组成,上皮可见2~4层的细胞。管周肌样细胞核呈长梭形环绕于附睾管固有膜外周,基细胞呈单层状分布,紧贴于附睾管固有膜底部,而主细胞呈长柱状分布于上皮中,平滑肌纤维排列整齐,环绕于附睾管外周(图2A~2I)。随日龄的增加,30~150日龄附睾管管径不断增大,柱状上皮厚度不断增厚,纤毛也随之增长,部分纤毛发生脱落现象(图2A~2I)。随日龄的增长,附睾管逐渐排列紧密,在30~105日龄附睾管管腔中未出现精子(图2A~2E),有脱落的柱状上皮细胞。120日龄管腔中出现精子,数量较少(图2F),135、150日龄管腔中有大量精子存在,密集分布于管腔腔隙中(图2H~2I)。
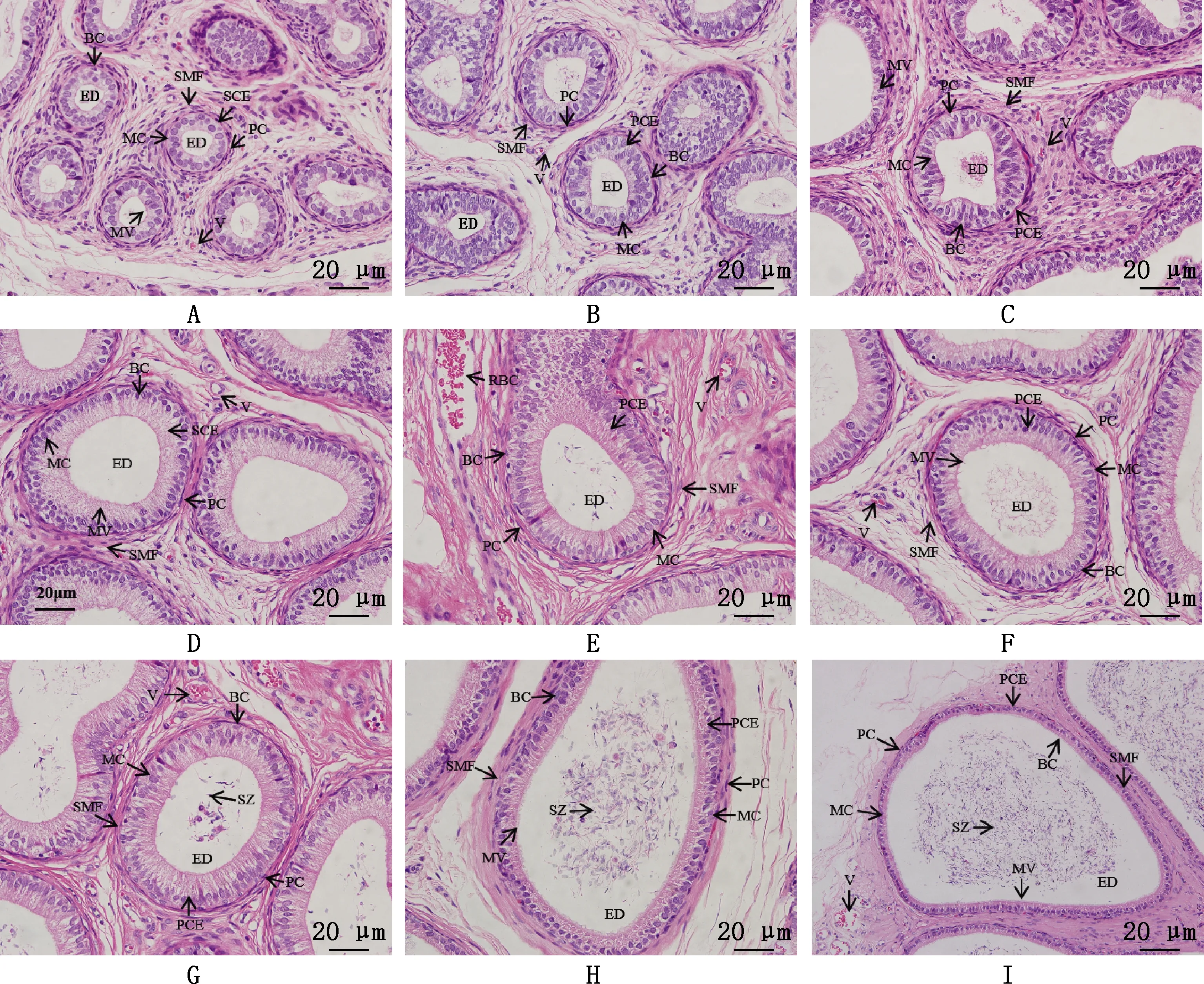
①A~I,分别为30、45、60、75、90、105、120、135和150日龄附睾组织切片。②SMF,平滑肌纤维;SCE,单复层柱状上皮;PCE,假复层柱状上皮;BC,基细胞;MC,主细胞;MV,微绒毛;ED,附睾管;V,血管;SZ,精子;PC,管周肌样细胞;RBC,红细胞
3 讨 论
3.1 不同日龄伊拉兔睾丸的形态学与组织学特征
睾丸可分泌雄激素,对雄性生殖系统的发育起着重要作用[13],而睾丸指数在一定程度反映其所处的发育阶段和生理状况[14]。本研究发现,随着日龄的增加,伊拉兔睾丸指数、睾丸重均呈现递增趋势,且在135~150日龄阶段增长速率相对较快,150日龄达到峰值,说明此阶段睾丸生长发育迅速,可能是其性腺发育的关键期,这与前人的研究结果一致[15]。另外,本研究发现,随着日龄的增加,伊拉兔的睾丸长径、睾丸短径、睾丸厚径均显著增长,且在150日龄性成熟时均达到峰值。生精小管形态结构及睾丸内相关细胞增殖分化是睾丸发育的标志,睾丸重量的增加与生精小管上皮的发育有直接关系[16]。本研究中,随着日龄的增加,生精小管直径、横截面积及生精上皮厚度显著增长。研究表明,大鼠出生后生精小管直径显著增大是因支持细胞的快速增长,且生精小管面积在3月龄达到最大[17]。本研究中,随支持细胞和生精细胞的增加,在150日龄时生精小管的直径达到最大。在公牛上的研究表明,新生及6~10周公牛睾丸支持细胞的数量决定了成年后睾丸的大小、生精细胞数量及精子数量[18];对香猪睾丸的研究也证明,支持细胞在初情期前停止增殖,此后支持细胞数量维持稳定[19]。本研究发现,随着日龄的增加和生精上皮的发育,支持细胞数不断增多,且在120~150日龄阶段支持细胞的增长维持相对稳定,表明伊拉兔在120日龄达到初情期。此外在30~60日龄阶段,睾丸内生精小管排列稀疏,间质组织较多,生精小管管腔为实心组织,说明此时睾丸分泌的睾酮较少,生精小管管腔未被刺激分化形成。贾书花等[20]研究发现,从胚胎睾丸形成到青春期前,睾丸没有得到激素刺激,生精细胞不发育,曲细精管的生精上皮由精原细胞和支持细胞组成,几乎无管腔,而动物进入青春期后,睾丸受垂体分泌的促黄体生成素(LH)和促卵泡素(FSH)以及睾丸间质细胞分泌的睾酮(T)调控,生精细胞开始发育,管腔逐渐形成并产生精子,这与本试验结果一致。本研究发现,在伊拉兔75日龄时,睾丸上皮逐渐发育,初级精母细胞、圆形精子细胞均出现,生精小管管腔逐渐形成,且在150日龄时生精小管管腔达到最大,管腔内有大量的精子出现。有研究进一步表明,小鼠在出生后35 d其生精小管内可见大量精子,同时附睾中的精子数量也增多,并且具有受精能力,表明此时小鼠已达到性成熟[21],与本研究伊拉兔在150日龄时结果一致,说明伊拉兔此时基本达到性成熟。间质细胞分泌的睾酮是影响精子发生和性功能的主要激素[22]。本研究中随伊拉兔日龄的增加,其睾丸间质细胞数也随之增加,且在150日龄达到最大值,说明随着日龄增加伊拉兔睾丸不断发育,150日龄时基本发育成熟。
3.2 不同日龄伊拉兔附睾的形态学与组织学特征
附睾是附着在睾丸背部且含有大量高度卷曲附睾管的器官,连接着睾丸和输出小管,睾丸产生的精子先到达附睾,通过附睾的运输,最后将精液输出到输精管。附睾在解剖学上可大致分为头、体和尾3部分,具有特定功能和形态特征的上皮细胞位于这些区域中,它们形成了血—表皮屏障,为精子的浓缩、成熟和储存建立了独特的管腔微环境[23]。相关研究显示,附睾各部分管壁上皮细胞主要由主细胞、基细胞、顶细胞和晕细胞及管周肌样细胞组成,由于其有独特的上皮细胞类型和功能特点,组织学也有明显差异[24]。本研究结果显示,伊拉兔附睾管周肌样细胞核呈长梭形环绕于附睾管固有膜外周,基细胞呈单层状分布,紧贴于附睾管固有膜底部,而主细胞呈长柱状分布于上皮中,平滑肌纤维排列整齐,环绕于附睾管外周。随着日龄的增加,附睾头、附睾体和附睾尾管腔外径、内径均显著增长,在150日龄均达到最大。研究表明,棕色田鼠附睾管腔直径随日龄而变化,45日龄附睾管腔显著增大,60日龄附睾管腔直径达到最大[25];杨栋慧等[26]研究发现,从附睾头到附睾尾,附睾的管腔直径逐渐增加,上皮厚度逐渐减小,平滑肌厚度逐渐增厚,这些研究结果与本试验在伊拉兔上的结果一致。
研究显示,附睾上皮具有吸收和分泌功能,可以分泌甘油磷酸胆碱和糖蛋白,有助于维持精子的活力[27]。精子在附睾内缺乏运动能力,精子从附睾头到附睾尾是依靠附睾管纤毛上皮的摆动,以及平滑肌的协助收缩作用,推动精子进入输精管[28]。在棕色田鼠60日龄的附睾中发现大量精子,且纤毛长度达到最长,表明棕色田鼠已达到性成熟[25]。本研究发现,随着伊拉兔日龄的增加,附睾头、体和尾部的柱状上皮均极显著增长,附睾管中的纤毛也随之增长,在150日龄均达到最大值。在30~105日龄阶段的附睾管中尚未出现精子,仅有部分管腔中有脱落的柱状上皮细胞,而在120日龄的附睾管中发现少量精子,且在135、150日龄的附睾管中发现大量精子,这说明伊拉兔达到初情期大约在120日龄,而性成熟大约在150日龄。
4 结 论
本研究结果发现,随着伊拉兔日龄的增加,睾丸和附睾的发育是同步的,睾丸支持细胞的增加在120日龄趋于相对稳定,且附睾中有精子出现,说明伊拉兔在120日龄达到初情期。在150日龄时,睾丸生精小管、附睾管直径均达到最大值,管腔中有大量精子出现,说明此时睾丸和附睾已发育成熟,伊拉兔基本达到性成熟。
