奶牛子宫内膜上皮细胞氧化应激模型的建立及奶牛脂肪间充质干细胞对其迁移的影响
2022-07-27鲁文赓司琳清田春雨袁思琦谢何昕周继伟金吉东韩英浩
鲁文赓,司琳清,田春雨,袁思琦,谢何昕,周继伟,金吉东,韩英浩
(1.黑龙江八一农垦大学动物科技学院,大庆 163319;2.榆树市农业综合行政执法大队,榆树 130400;3.科菲特饲料(长春)有限公司,长春 130012;4.黑龙江八一农垦大学生命科学技术学院,大庆 163319)
奶牛在围产期特别是产后其抗氧化能力降低,为满足分娩和泌乳等生理活动需求其代谢增加,高代谢水平将导致活性氧(ROS)产生增多,ROS的产生与抗氧化能力之间的不平衡促使氧化应激发生,继而影响子宫健康并促进子宫内膜炎的发生发展。研究表明,奶牛的急性子宫感染与脂质过氧化水平升高和抗氧化能力下降有关[1-4]。子宫内膜感染后,中性粒细胞到达子宫内吞噬病原体产生大量的ROS会通过激活促炎因子的转录来加剧炎症反应,并使蛋白质、脂质和DNA氧化,进而造成子宫内膜上皮细胞死亡,加重组织损伤[5-7]。因此,修复奶牛子宫内膜上皮的氧化损伤对子宫内膜炎的防治十分关键。尽管损伤后的组织修复和再生机制尚未明确,但相关研究表明其涉及细胞迁移和增殖、细胞外基质重塑等,而细胞外调节蛋白激酶(Erk)是信号从表面受体传导至细胞核的关键分子,参与调节细胞分化、增殖、迁移等多种生命活动[8]。
间充质干细胞(MSCs)是由成体组织基质中获得的具有再生功能的多能干细胞,在损伤修复中发挥着重要的生物学功能[9]。张延玲[10]研究表明,月经血中子宫内膜来源MSCs可以修复损伤子宫并通过激活Erk来促进脐内皮细胞的迁移。随着现代医学对MSCs的深入研究,其在动物临床中的研究也愈加广泛,詹小舒等[11]研究发现,犬脐带MSCs来源的外泌体可以促进血管内皮细胞迁移;在奶牛中的研究发现,骨髓和脂肪MSCs的条件培养基均可在体外抑制金黄色葡萄球菌的活性,为兽医临床中奶牛乳腺炎的治疗提供理论基础[12-13]。Lu等[14]研究发现,使用脂多糖(LPS)诱导体外奶牛子宫内膜炎模型后与奶牛脂肪间充质干细胞(bAD-MSCs)共培养可以显著抑制炎性反应与细胞凋亡,但bAD-MSCs对氧化应激导致奶牛子宫内膜上皮细胞损伤的作用还不清楚。由于H2O2会使细胞氧化并产生具有高度活性的自由基,被广泛用于细胞氧化应激模型的构建[15]。本试验使用H2O2构建奶牛子宫内膜上皮细胞氧化应激模型并探讨bAD-MSCs是否可以促进氧化应激状态下奶牛子宫内膜上皮细胞的迁移,以期为临床上防治由氧化应激导致的奶牛子宫内膜上皮损伤提供新的思路。
1 材料与方法
1.1 材料
1.1.1 主要试剂 DMEM/F12购自Gibco公司;胎牛血清(FBS)购自四季青公司;胰蛋白酶、青-链霉素、MTT试剂、活性氧检测试剂盒、ECL显影液均购自Solarbio公司;H2O2购自Simga公司;Erk抗体、pErk抗体、β-actin抗体均购自Santa公司;辣根过氧化物酶(HRP)标记的山羊抗鼠IgG二抗购自BioBasic公司。
1.1.2 主要仪器 细胞培养箱(CB160)购自Binder公司;酶标仪(Elx800)购自BioTek公司;流式细胞仪(CytoFLEX)购自Beckman公司;蛋白成像系统(Amersham Imager 600)购自Cytiva公司。
1.2 方法
1.2.1 细胞的复苏与传代培养 将黑龙江八一农垦大学动物产科学实验室分离培养并鉴定的原代bAD-MSCs与奶牛子宫内膜上皮细胞复苏并接种至培养皿中,待细胞汇合度达到80%~90%时,使用0.25%的胰蛋白酶消化细胞,待大部分细胞从培养皿底部脱落下来时,加入含10% FBS的培养基终止消化。随后将终止消化的细胞悬液以1 000 r/min离心3 min并重悬,以1∶2进行传代培养,使用第4代细胞进行后续试验。
1.2.2 H2O2诱导奶牛子宫内膜上皮细胞氧化应激最佳浓度筛选 将奶牛子宫内膜上皮细胞以每孔1×104个接种于96孔板中,待细胞汇合度为80%~90%时,弃去培养液,分别加入含有0(对照组)、5、25、50、100、200 μmol/L H2O2的培养基(DMEM/F12+1% FBS),分别刺激2、4、6、8、12 h,每组3个重复。在每孔中加入5 g/L MTT溶液10 μL,于37 ℃培养箱中避光孵育2 h,每孔加入100 μL细胞级二甲基亚砜(DMSO)溶液,于37 ℃培养箱中避光孵育10 min,测定各组D490 nm值,计算细胞存活率。细胞存活率(%)=(试验组D490 nm/对照组D490 nm)×100%。
1.2.3 H2O2诱导奶牛子宫内膜上皮细胞氧化应激最佳时间筛选 将奶牛子宫内膜上皮细胞以每孔2.5×105个接种于6孔板中,待细胞汇合度为80%~90%时,弃培养液,对照组加入不含H2O2的培养基,H2O2刺激组加入含50 μmol/L H2O2培养基,在2、4、6、8、12 h收集细胞,使用PBS充分洗涤,离心后加入10 μmol/L DCFH-DA荧光探针重悬细胞,37 ℃避光孵育15 min,用PBS洗掉多余探针,用流式细胞仪在激发光488 nm、发射光525 nm下检测荧光强度。
1.2.4 bAD-MSCs对氧化应激状态下奶牛子宫内膜上皮细胞迁移的影响 将奶牛子宫内膜上皮细胞以每孔2×105个接种于6孔板中,待细胞汇合度为80%~90%时,弃培养液,对照组加入无H2O2的培养基,试验组加入50 μmol/L H2O2的培养基,2 h后使用200 μL枪头均匀划线,用PBS洗去死细胞,拍照记录,此时记为划痕0 h。将培养基全部更换为无H2O2的培养基,试验组使用孔径为0.4 μm的transwell,根据与奶牛子宫内膜上皮细胞共培养的细胞类型及小室接种细胞的密度构建不同的间接共培养体系,分为对照组、H2O2组、H2O2处理奶牛子宫内膜上皮细胞与bAD-MSCs按1∶0.5、1∶1共培养组(H2O2+bAD-MSCs(1∶0.5)组、H2O2+bAD-MSCs(1∶1)组)、H2O2处理奶牛子宫内膜上皮细胞与奶牛乳腺上皮细胞(MACT)按1∶0.5、1∶1共培养组(H2O2+MACT(1∶0.5)组、H2O2+MACT(1∶1))组6组,按以上顺序记为1、2、3、4、5、6,24 h后拍照记录,记为划痕24 h。使用ImageJ v1.51测量划痕之间的面积,分别与各组划痕0 h比较评估细胞迁移能力。
1.2.5 bAD-MSCs对氧化应激状态下奶牛子宫内膜上皮细胞中Erk蛋白表达水平的影响 收集1.2.4中各组奶牛子宫内膜上皮细胞,使用RIPA裂解液提取蛋白,使用考马斯亮蓝法测定蛋白浓度,根据蛋白浓度计算蛋白上样量,蛋白样品与蛋白上样缓冲液混合,每孔上样量为15 μL,SDS聚丙烯酰胺凝胶电泳,湿转法转移至NC膜上,50 g/L脱脂奶粉室温下封闭1 h,与β-actin(1∶1 000)、Erk(1∶1 000)、pErk(1∶1 000)抗体4 ℃过夜孵育,室温下使用HRP标记的山羊抗鼠IgG二抗(1∶3 000)孵育1 h,曝光显影,利用ImageJ v1.51统计灰度值,计算pErk与Erk的比值表示pErk蛋白的相对表达量。
1.3 数据统计分析
用SPSS 26.0软件进行单因素方差分析(One-Way ANOVA),组间差异采用邓肯氏多重比较,结果用平均值±标准差表示,P<0.05表示差异显著。用GraphPad Prism 8.0.2软件进行绘图。
2 结 果
2.1 H2O2诱导奶牛子宫内膜上皮细胞氧化应激最佳浓度的筛选
由图1可知,5 μmol/L H2O2刺激奶牛子宫内膜上皮细胞2 h时,细胞存活率显著高于对照组(P<0.05),4、6、8、12 h组细胞存活率均低于对照组(P<0.05);25、50、100、200 μmol/L H2O2组细胞存活率均低于对照组(P<0.05),分别为70%~90%、50%~80%、10%~60%、10%~30%。因此,选取50 μmol/L H2O2构建氧化应激模型。
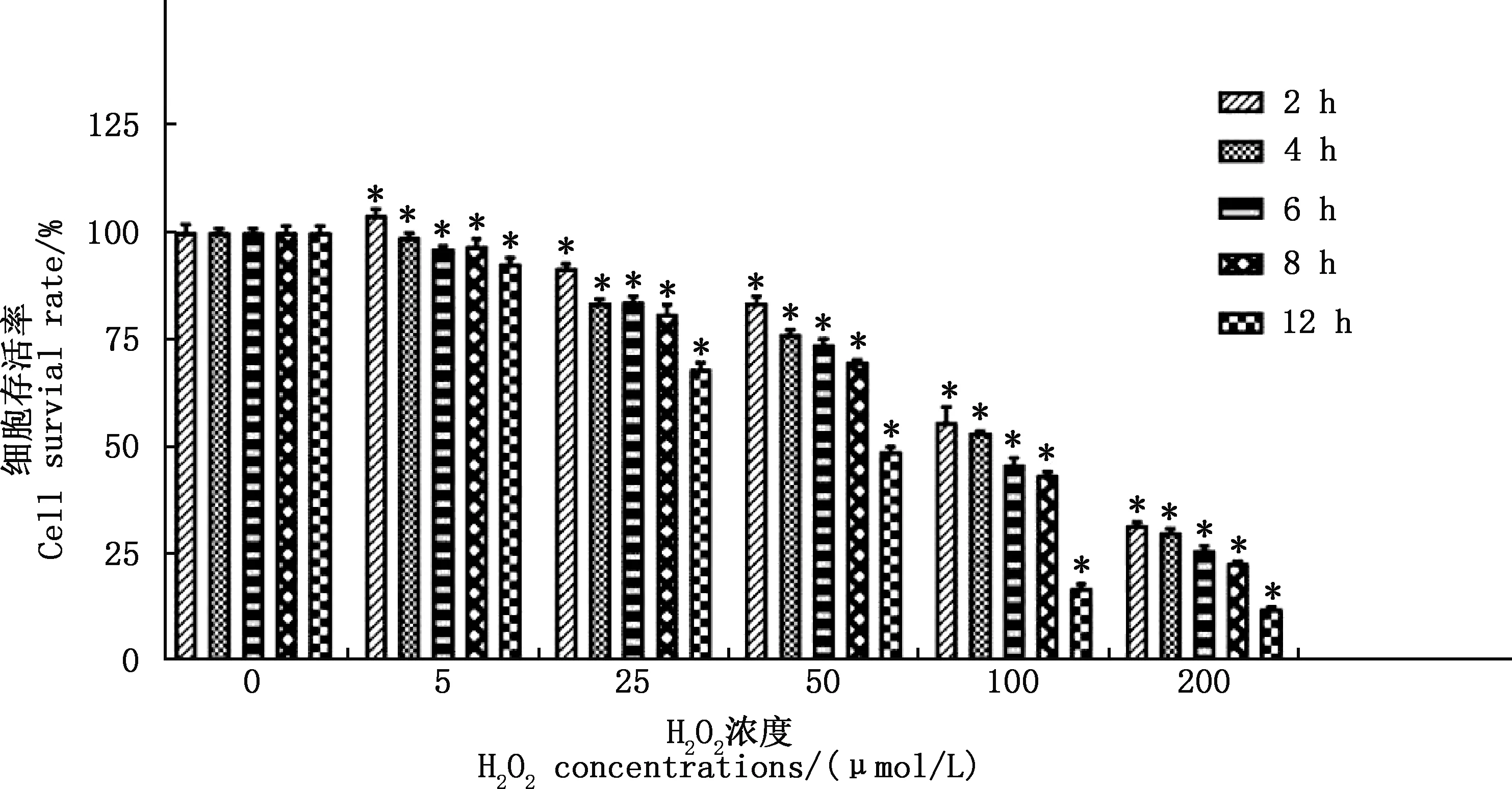
与0 μmol/L H2O2组相比,*,差异显著(P<0.05)
2.2 H2O2诱导奶牛子宫内膜上皮细胞氧化应激最佳时间的筛选
由图2可知,用50 μmol/L H2O2刺激2 h时,细胞内ROS水平显著高于对照组(P<0.05),4、6、8、12 h组ROS水平均显著低于2 h组(P<0.05)。因此,后续试验选取50 μmol/L H2O2刺激2 h构建奶牛子宫内膜上皮细胞氧化应激模型。
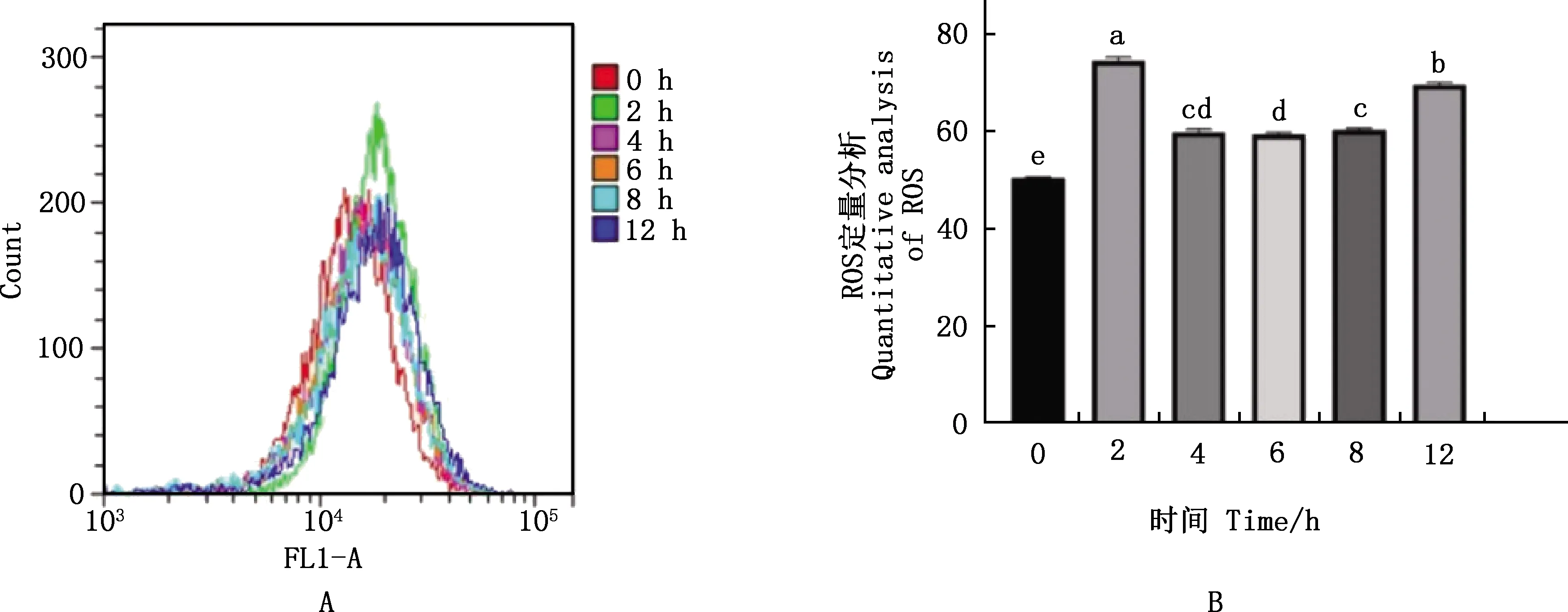
①A,流式细胞术检测ROS的生成情况;B,ROS生成定量分析。②肩标不同字母表示差异显著(P<0.05);肩标相同字母表示差异不显著(P>0.05)。下同
2.3 bAD-MSCs对氧化应激状态下奶牛子宫内膜上皮细胞迁移的影响
由图3、4可知,与对照组相比,50 μmol/L H2O2组奶牛子宫内膜上皮细胞的迁移能力显著降低(P<0.05);与H2O2组相比,bAD-MSCs共培养组奶牛子宫内膜上皮细胞的迁移能力均显著增加(P<0.05),MACT共培养组奶牛子宫内膜上皮细胞的迁移能力均显著降低(P<0.05),且1∶0.5 bAD-MSCs和1∶1 MACT共培养组奶牛子宫内膜上皮细胞的迁移能力分别显著低于1∶1 bAD-MSCs和1∶0.5 MACT共培养组(P<0.05)。

1,对照组;2,H2O2组;3,H2O2+bAD-MSCs(1∶0.5)组;4,H2O2+bAD-MSCs(1∶1)组;5,H2O2+MACT(1∶0.5)组;6,H2O2+MACT(1∶1)组。图4、5同
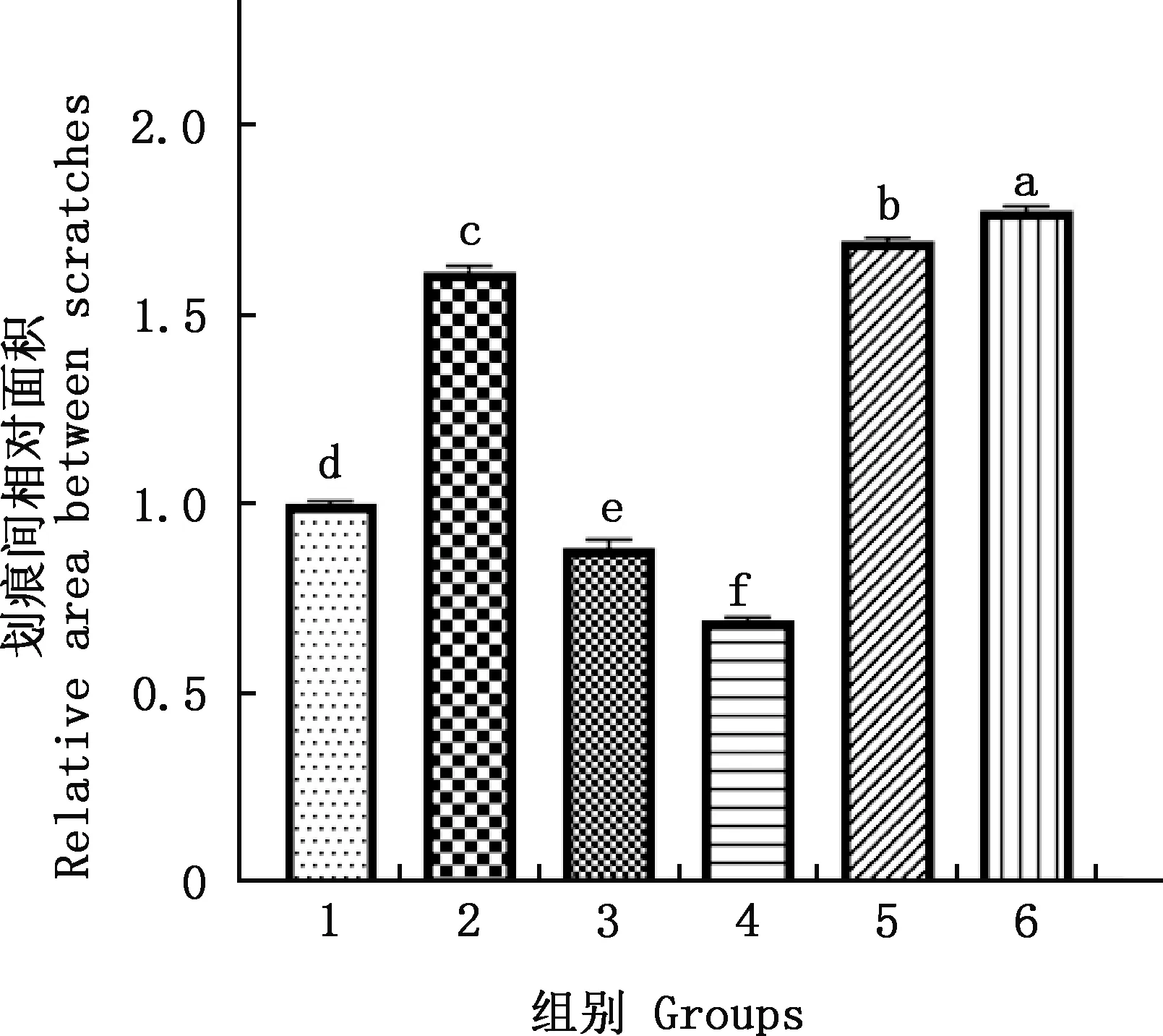
图4 各组奶牛子宫内膜上皮细胞划痕间面积定量分析
2.4 bAD-MSCs对氧化应激状态下奶牛子宫内膜上皮细胞中Erk蛋白表达水平的影响
由图5可知,与对照组相比,50 μmol/L H2O2组奶牛子宫内膜上皮细胞中pErk蛋白表达水平显著降低(P<0.05);与H2O2组相比,bAD-MSCs共培组奶牛子宫内膜上皮细胞中pErk蛋白表达水平均显著升高(P<0.05),MACT共培养组奶牛子宫内膜上皮细胞中pErk蛋白表达水平均显著降低(P<0.05),且1∶0.5 bAD-MSCs和1∶1 MACT共培养组奶牛子宫内膜上皮细胞中pErk蛋白表达水平分别显著低于1∶1 bAD-MSCs和1∶0.5 MACT共培养组(P<0.05)。

A,pErk、Erk蛋白Western blotting检测;B,pErk和Erk蛋白比值
3 讨 论
氧化应激是指机体内ROS生成过多、抗氧化能力下降造成的细胞及组织损伤,奶牛在围产期经历了营养、激素等多种变化导致机体内ROS产生增多,使子宫内膜上皮细胞的结构和功能被破坏,从而易于被病原微生物感染。当细菌侵入子宫内膜后,中性粒细胞首先到达炎症部位去吞噬病原微生物,在这个过程中会产生大量ROS,此时ROS除了会造成细胞组织损伤外,还会通过激活细胞信号级联促进白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)、IL-6等促炎细胞因子,加剧炎症反应,所以对ROS造成细胞及组织损伤的修复对疾病的治疗也十分重要,但此过程在体外模拟较为困难。H2O2作为一种常见的ROS,通常被用于探究自由基介导的氧化损伤机制及抗氧化剂对氧化损伤的修复机制,因此本研究选择H2O2作为奶牛子宫内膜上皮细胞氧化应激模型的应激源。细胞存活率和细胞内ROS水平是评估造模是否成功的关键指标,最佳的造模条件既要极大程度减轻细胞损伤又要使ROS水平显著升高,目前的试验结果显示50%~80%的细胞存活率均可以造模成功[16-18]。本试验结果发现,5 μmol/L H2O2刺激2 h时,细胞存活率高于100%,这是因为H2O2在低浓度时可以作为第二信使刺激细胞增殖[19-22],H2O2浓度为25、50、100、200 μmol/L时细胞存活率分别为70%~90%、50%~80%、10%~60%、10%~30%,细胞存活率低于50%时细胞大量死亡且形成不可逆损伤,不适合作为造模条件[21],因此本试验最终选择用50 μmol/L H2O2作为最佳刺激浓度。为了进一步筛选最佳作用时间,本试验使用流式细胞术检测细胞内ROS水平,结果表明,在2 h时细胞内ROS水平较对照组显著升高,而4、6、8、12 h组较2 h组呈现出降低的结果,这是由于ROS仅在活细胞中可以检测出,随着作用时间延长,奶牛子宫内膜上皮细胞的存活率逐渐降低,ROS含量下降,仅能说明活细胞中的ROS含量下降,这并不能代表由H2O2刺激产生总ROS的含量[22]。本研究使用50 μmol/L H2O2刺激奶牛子宫内膜上皮细胞2 h来构建氧化应激模型并进行后续试验。这与张梦龙[23]、赵璧忱[24]得出的400 μmol/L H2O2刺激2 h有所区别,可能是由于H2O2化学性质活泼、不稳定,且不同的储存方式与其化学活性也息息相关,因此关于构建氧化应激模型的浓度和时间在不同实验室之间均存在较大的差异。另外,细胞的不同培养方法也可能会影响其对H2O2的耐受性,如不同的细胞培养液、冻存液及细胞在培养皿(瓶)的汇合度等。
MSCs作为一种多能干细胞,在现代临床医学中已被广泛应用于组织再生和自身免疫性疾病的治疗[25],MSCs主要通过以下2种方式实现损伤组织的修复,第一种是通过其归巢能力迁移到受损部位发挥其功能[26],但是移植MSCs在临床上具有一定风险与挑战,移植细胞存活率低、免疫排斥反应、到达损伤部位时间长,甚至动脉内注射MSCs可导致心肌微梗死的发生[27];第二种是通过其旁分泌功能促进细胞的增殖迁移进而使受损组织或器官得以修复[28]。所以本研究使用细胞划痕试验并通过transwell构建共培养体系来探究bAD-MSCs是否可以通过旁分泌作用对氧化应激状态下奶牛子宫内膜上皮细胞迁移起到积极作用。试验结果表明,与对照组相比,H2O2刺激降低了奶牛子宫内膜上皮细胞的迁移能力,而与H2O2组相比,bAD-MSCs共培养组奶牛子宫内膜上皮细胞的迁移能力显著增强,这可能是因为MSCs通过其旁分泌作用产生了丰富的生物活性分子,包括生长因子、趋化因子、细胞因子和小细胞外囊泡(如外泌体)等介质来调节免疫反应和损伤组织的修复。而MACT共培养组奶牛子宫内膜上皮细胞表现为迁移能力降低,这是因为在MACT共培养组中划痕处有大量细胞坏死,脱离培养板底部,使划痕之间的面积增加,另外未发生氧化应激的MACT也可能会竞争性地吸收培养基中的营养成分,加剧细胞坏死进程。
研究发现,Erk蛋白参与调控多种生理病理过程中的细胞增殖与迁移[29-30],Shabbir等[31]研究证明,MSCs的外泌体可以通过Erk1/2信号通路促进正常和慢性创伤性成纤维细胞的迁移。本研究结果显示,bAD-MSCs共培养组奶牛子宫内膜上皮细胞中pErk蛋白水平较H2O2组显著升高,但是与对照组相比,其迁移能力较高,pErk蛋白水平却较低,这提示MSCs的旁分泌功能对细胞迁移的影响不仅是通过调控Erk信号通路来实现的。有研究表明,MSCs可以通过旁分泌作用激活多种与伤口愈合相关的信号通路,如蛋白激酶B(Akt)、Erk、细胞信号传导与转录激活因子3(STAT3),并诱导多种营养因子的表达。特别是MSCs外泌体中含有STAT3,STAT3通过诱导大量基因表达以调控细胞增殖、迁移和血管生成,包括参与细胞周期控制的骨髓细胞瘤病毒癌基因同源物(c-myc)、细胞周期蛋白(cyclin)、IL-6、肝细胞生长因子(HGF)、血管内皮生长因子(VEGF)[32-33],但其中所涉及的活性分子较多,机制复杂,且不同来源的MSCs分泌的活性分子在种类与含量上均存在一定的差异,所以关于其具体的活性分子及调控机制需要进一步深入探究。
4 结 论
本试验结果表明,用50 μmol/L H2O2刺激2 h可成功构建奶牛子宫内膜上皮细胞氧化应激模型。bAD-MSCs可以促进氧化应激状态下奶牛子宫内膜上皮细胞的迁移,且参与调控Erk蛋白的表达。结果为临床上治疗由子宫感染造成的奶牛子宫内膜上皮细胞氧化损伤提供了新的思路。
