miR-449b对绵羊早期胚胎发育的影响
2022-07-27任秀美奥姚旭东蒙亚琦郭延华张译元赵兴旺王立民
任秀美奥,姚旭东,蒙亚琦,郭延华,唐 红,张译元,赵兴旺,王立民,周 平
(1.石河子大学动物科技学院,石河子 832000;2.新疆农垦科学院,省部共建绵羊遗传改良与健康养殖国家重点实验室,石河子 832000;3.石河子总场农业服务发展中心,石河子 832000)
在自然受精过程中,精子除提供单倍体基因组外,还提供精源性RNA(核糖核酸)并参与早期胚胎的发育调控[1],精源性RNA的含量很少,但对受精、早期胚胎发育以及表观遗传等均发挥重要调控作用[2]。微小核糖核酸(miRNA)是大小为20~25 nt的单链非编码 RNA,占脊椎动物基因的1%~3%,约超过30%的基因被其调控[3]。精源性信使核糖核酸(mRNA)和miRNA对胚胎转录和基因表达有重要作用[4]。Wang等[5]发现miR-449b在牛精子中高表达,提示miR-449b进入卵母细胞中参与受精后胚胎的发育,同时miR-449b在受精卵重编程过程中发挥着重要作用。对小鼠生殖细胞研究发现,miR-449簇与miR-34b/c在调节小鼠睾丸组织发育过程中具有协同作用[6]。对牛体细胞核移植的供体细胞转染精源性miR-449b,通过靶向组蛋白去乙酰化酶1(HDAC1)的表达,提高核移植2-细胞和8-细胞胚胎的组蛋白H3K9乙酰化水平,促进表观重编程[5]。以上研究表明,在胚胎发育过程中精源性miR-449b调节因子具有重要作用。羊睾丸组织高通量测序显示,miR-449b在羊睾丸组组中表达[7]。H3K9三甲基化(H3K9me3)依赖性异染色质是早期胚胎发育过程中的主要障碍之一[8],参与早期胚胎基因调控和印迹X失活过程[9-11]。编码H3K9me3相关染色质因子的基因缺失会导致基因无法正常表达和胚胎致死[12-13]。Yuan等[14]和Conine等[15]在缺乏精子RNA的早期胚胎中未发现基因组甲基化异常,但Wang等[8]对小鼠早期胚胎中H3K9me3修饰的全基因组研究发现,H3K9me3在启动子和长末端重复序列(LTR)中表现出明显的动态特征,受精后母系基因组与父系基因组都进行大规模的H3K9me3重建,且H3K9me3能在原核期胚胎的雌原核和2-细胞期胚胎中检测到。目前关于miR-449b对早期胚胎组蛋白H3K9me3影响的研究鲜见报道。本试验通过比较绵羊成纤维细胞、成熟卵母细胞与精子中miR-449b的含量,探索miR-449b的表达情况,通过显微注射法为孤雌胚胎补充正常受精过程中带入的miR-449b,同时使用免疫荧光染色观察补充miR-449b对绵羊2-细胞期孤雌胚胎组蛋白H3K9me3的影响,研究miR-449b对绵羊早期胚胎组蛋白甲基化的影响,为绵羊早期胚胎发育机制的研究提供参考。
1 材料与方法
1.1 材料
1.1.1 样品 于石河子屠宰场采集绵羊卵巢;在新疆农垦科学院绵羊新种质资源培育基地采集1月龄纯种萨福克公羊(3只)的耳组织,以及3岁左右纯种萨福克公羊(5只)的精液。绵羊卵巢保存于加双抗的37 ℃生理盐水中2 h内运回实验室。采集的耳组织放入含双抗的0.9%生理盐水中,与采集的新鲜精液一起,常温下2 h内运送回实验室。
1.1.2 主要试剂及仪器 TRIzol购自Invitrogen公司;Mir-X miRNA First-Strand Synthesis Kit、无水乙醇、细胞培养液均购自TaKaRa公司;PBS缓冲液购自Biological Industries公司;卵母细胞成熟液、胚胎培养液、显微操作液、受精液、氯仿、Percoll、DEPC、二甲基氨基嘌呤(6-DMAP)、4,6-二脒基-2-苯基吲哚二月桂酸酯(DAPI)、透明质酸酶、石蜡油均购自Sigma公司;RNase-free水购自天根生化科技(北京)有限公司;4%多聚甲醛、透膜液、封闭液、清洗液均购自上海碧云天生物技术有限公司;兔抗H3K9me3抗体、山羊抗兔IgG均购自Abcam公司;实时荧光定量PCR仪(LightCycler 480 Ⅱ)购自Roch公司;梯度PCR仪(Labcycler 48)购自SensoQuest公司;超净工作台(VS-840垂直流)购自上海博迅医疗生物仪器股份有限公司;CO2培养箱(Galaxy 48R)、显微注射仪(Femtojet)、显微操作系统(Transfer Man 4r)均购自Eppendorf公司;拉针仪(PC-100)、断针仪(MF-830)、生物显微镜(SMZ800)、激光共聚焦显微镜(Stellaris 5)均购自Nikon公司。
1.1.3 miR-449b模拟物及其对照的设计与合成 根据miRBase中提供的miR-449b-5p的序列(登录号:MIMAT0036232)设计miR-449b的模拟物(miR-449b mimic)及其模拟物对照(NC mimic)序列,miR-449b mimic:5′-AGGCAGUGUAUUGUU-AGCUGGC-3′,NC mimic:5′-UCACAACCUCCU-AGAAAGAGUAGA-3′。序列由上海吉荧生物技术有限公司合成。将miR-449b mimic与NC mimic粉末溶解并稀释成20 μmol/L,―80 ℃保存备用。
1.2 精子、成熟卵母细胞与成纤维细胞的获取
1.2.1 精子 将5只羊的精液混合后,用Percoll密度梯度离心法纯化精子,在10 mL尖底离心玻璃管底部加入2 mL 90% Percoll离心液,在其上方倾斜缓慢加入45% Percoll离心液,将200 μL精液缓慢加入离心管中45% Percoll密度梯度离心液表面,2 000 r/min离心10 min,离心后玻璃离心管尖底有云雾状精子,将离心管上层与中下层的浑浊液体和死、弱精子轻轻吸走,留少量底部精子和液体,用200 μL钝化枪头将精子吸走,加入37 ℃预热的1 mL PBS液中,1 500 r/min离心5 min,将上清液尽可能吸掉,留精子沉淀用于精子RNA的提取。
1.2.2 成熟卵母细胞 用剪刀除去多余结缔组织,用生理盐水清洗3次至无血液和异物。用刀片刺破直径为2~8 mm的卵泡,体视镜下挑选包裹2~3层颗粒细胞的卵丘-卵母细胞复合体(COCs),用采卵液清洗2遍,放入卵母细胞成熟液进行体外培养,38.5 ℃、5% CO2饱和湿度的培养箱中培养16~18 h。将成熟卵母细胞用0.1%透明质酸酶消化,脱去颗粒细胞,显微镜下挑选胞质均匀的卵母细胞备用。
1.2.3 成纤维细胞 在培养皿内将耳组织剪碎至大小约0.1 cm3的小块,按0.5 cm间距接种于培养皿中,待组织贴壁后,加细胞培养液,置于37 ℃、5% CO2细胞培养箱中培养。每2~3 d换1次液,当组织块周围爬出的细胞生长至80%~90%时进行传代培养。
1.3 精子、成熟卵母细胞与成纤维细胞中miR-449b的表达
1.3.1 精子、成熟卵母细胞与成纤维细胞RNA的提取 按照TRIzol试剂说明书提取绵羊精子RNA,―80 ℃保存备用。以50个胚胎为1组,使用GenEluteTM单细胞RNA纯化试剂盒,按步骤提取成熟卵母细胞RNA,―80 ℃保存备用。待成纤维细胞铺满10 cm培养皿的90%左右,用0.25%胰蛋白酶消化细胞,PBS清洗2~3次,加入1 mL TRIzol裂解液后按照步骤提取总RNA,―80 ℃保存备用。
1.3.2 精子、成熟卵母细胞与成纤维细胞RNA的反转录 将精子、成熟卵母细胞与成纤维细胞的RNA按照Mir-X miRNA First-Strand Synthesis Kit说明书进行反转录。反转录体系10 μL:mRQ Buffer(2×)5 μL,RNA 3.75 μL,mRQ Enzyme 1.25 μL。反应程序:37 ℃ 1 h,85 ℃ 5 min,反转录所得cDNA立即进行实时荧光定量PCR或―80 ℃保存备用。
1.3.3 实时荧光定量PCR检测miR-449b的表达 根据GenBank中绵羊miR-449b序列(登录号:MIMAT0036232)用miRNA RT Primer软件设计miR-449b正向引物F:GGGAGGCAGTGTAT-TGTTAGCTG,反向通用引物与U6内参引物由Mir-X miRNA First-Strand Synthesis Kit提供。PCR反应体系20 μL:SYBR Green Ⅰ 10 μL,上、下游引物各0.5 μL,cDNA 1 μL,ddH2O 8 μL。PCR反应程序:95 ℃预变性50 s;95 ℃变性5 s,60 ℃延伸20 s,共45个循环。熔解曲线:95 ℃ 60 s,55 ℃ 30 s,95 ℃ 30 s。
1.4 孤雌激活胚胎制备
卵母细胞成熟后,用0.1%透明质酸酶消化,脱去颗粒细胞,显微镜下挑选胞质均匀的卵母细胞转移至提前准备好的注射微滴中,用固定针固定卵母细胞,视野下调至透明带与注射针尖清晰可见,将0.9%生理盐水(对照组,Con)、NC mimic、miR-449b mimic分别注射进胞质中,以均匀扩散为标准,迅速撤出注射针。将注射后的卵母细胞在成熟液中恢复0.5~1 h,去除死亡的卵母细胞,剩余卵母细胞进行孤雌激活,激活步骤如下:将注射后的卵母细胞移至7%无水乙醇中激活8 min;用发育液清洗2次,再放入6-DMAP中激活4 h,用发育液清洗2次,放入发育液微滴中,在38.5 ℃、5% CO2饱和湿度的培养箱中培养,观察并拍照,收集2-细胞胚胎,第2、7天分别统计卵裂率和囊胚率。
1.5 IVF胚胎制备
将绵羊精子按照1.2.1方法处理,最后获得活力>80%的精子,将精子稀释成1×106~5×106/mL,在培养箱中平衡2 h,将带有少量颗粒细胞的卵母细胞置于受精液滴中并加入精子,于38.5 ℃、5% CO2饱和湿度的培养箱中进行IVF;受精18 h后将卵母细胞转入胚胎发育液中,在38.5 ℃、5% CO2饱和湿度的培养箱中进行体外培养,收集2-细胞胚胎用于H3K9me3免疫荧光染色。
1.6 胚胎H3K9me3免疫荧光染色
收集IVF 2-细胞胚胎及Con、NC mimic和miR-449b mimic组2-细胞胚胎,用0.1% PVA洗3次,用4%多聚甲醛在室温下固定30 min,然后将固定好的胚胎放入透膜液中,孵育30 min后用封闭液封闭1~2 h,用0.1% PVA清洗3次,将4种类型胚胎与兔抗H3K9me3抗体(1∶500 稀释)一抗4 ℃孵育过夜,用PBS清洗3次,每次5 min,与山羊抗兔IgG(1∶100)二抗室温共孵育2 h,用PBS清洗3次,每次5 min,再用DAPI复染5~8 min,置于激光共聚焦显微镜下观察并拍照,使用ImageJ 1.48对H3K9me3进行荧光强度分析。
1.7 数据统计分析
实时荧光定量RCR结果用2-ΔΔCt法进行计算。H3K9me3免疫荧光强度用ImageJ 1.48软件进行统计。用GraphPad Prism 6.0进行单因素方差分析(One-Way ANOVA),组间差异采用Bonferroni法进行比较。结果用平均值±标准差表示,P<0.05表示差异显著。
2 结 果
2.1 绵羊精子纯化与卵母细胞培养
新鲜绵羊精液经Percoll密度梯度离心纯化后所得精子形态正常,活力为85%(图1A);绵羊成熟COCs颗粒细胞扩散良好,卵母细胞胞质均匀(图1B);绵羊耳组织培养3 d后周围有梭形细胞爬出,体外培养具有贴壁生长特性(图1C)。

图1 绵羊精子(A)、成熟卵母细胞(B)与成纤维细胞(C)形态(40×)
2.2 miR-449b在绵羊成纤维细胞、成熟卵母细胞与精子中的表达
由图2可知,miR-449b在精子中的表达显著高于成熟卵母细胞和成纤维细胞(P<0.05),成熟卵母细胞与成纤维细胞中miR-449b的表达差异不显著(P>0.05)。
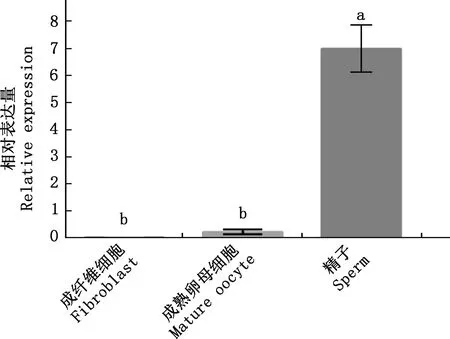
肩标不同字母表示差异显著(P<0.05);肩标相同字母表示差异不显著(P>0.05)。图4同
2.3 各组胚胎的卵裂率与囊胚率
由表2、图3可知,与Con组相比,miR-449b mimic和NC mimic组卵裂率均显著降低(P<0.05),且NC mimic组卵裂率显著低于miR-449b mimic组(P<0.05);miR-449b mimic组囊胚率提高,但差异不显著(P>0.05)。

图3 各组胚胎发育情况(40×)

表2 各组胚胎的卵裂率与囊胚率
2.4 各组2-细胞胚胎中H3K9me3表达量的变化
由图4A可知,IVF、Con、NC mimic与miR-449b mimic组2-细胞胚胎均表达组蛋白H3K9me3,且都在细胞核表达。由图4B可知,与Con组相比,NC mimic组2-细胞胚胎组蛋白H3K9me3的表达水平显著增加(P<0.05),miR-449b mimic组2-细胞胚胎组蛋白H3K9me3的表达水平显著降低(P<0.05);miR-449b mimic组2-细胞胚胎组蛋白H3K9me3显著低于NC mimic组(P<0.05),且与IVF组无显著差异(P>0.05)。

A,各组2-细胞胚胎中组蛋白H3K9me3的免疫荧光检测(40×);B,组蛋白H3K9me3的相对荧光强度
3 讨 论
成熟精子是携带最少细胞质、高度特化压缩的细胞,不发生复制、转录或翻译[2],且含有少量mRNA、miRNA、内源性小干扰RNA(endo-siRNA)和piwi相互作用RNA(piRNA)[16-17]。采用单精子显微注射(ICSI)将部分缺失miRNA和endo-siRNA的精子与正常卵母细胞受精,所得胚胎发育能力明显降低,当补充正常精子总RNA或small RNA后胚胎发育能力与卵胞浆内ICSI胚胎移植后的出生率得到提高,表明精子miRNA和endo-siRNA对正常胚胎发育至关重要[14]。miRNA能结合靶基因mRNA的3′-UTR区域,降低靶基因mRNA转录后水平,调控基因表达从而影响细胞的分化、增殖、代谢等多个过程[18-19]。miR-449簇包括miR-449a、miR-449b、miR-449c、miR-449d,其中miR-449b具有组织特异性表达,在睾丸中高表达,其许多靶基因在生物学过程中发挥重要作用[20]。本试验对比绵羊成纤维细胞、成熟卵母细胞与精子中miR-449b的相对表达,结果表明miR-449b在精子中高表达,这与Wang等[5]结果一致,提示精子miR-449b参与胚胎的早期发育。
关于miRNA对早期胚胎发育的相关研究越来越多,包括在小鼠精子中高表达的miR-34c,其可以调控DNA的合成[21],说明miR-34c对小鼠胚胎的第一次卵裂至关重要。牛体外受精胚胎桑椹胚和囊胚阶段高表达miR-130b,抑制miR-130b的表达显著降低桑椹胚和囊胚的形成[22]。牛精子携带的miR-202b抑制靶基因胞裂蛋白7(SEPT7)的表达,调节纺锤体的形成和细胞骨架的稳定性,从而延缓体细胞核移植胚胎的第一次分裂[23]。Wang等[5]通过制备牛体细胞核移植胚胎模型研究miR-449b的作用,结果显示,miR-449b可延迟牛植入前克隆胚胎的第一次卵裂时间、促进表观遗传重编程和降低凋亡指数。为探究miR-449b对绵羊早期胚胎的作用,本试验将miR-449b mimic显微注射至绵羊成熟卵母细胞,结果发现miR-449b mimic组孤雌激活胚胎卵裂率比NC mimic组明显提高,miR-449b mimic组孤雌激活胚胎囊胚率提高但不显著。说明miR-449b在绵羊早期胚胎卵裂率与囊胚形成方面发挥重要作用,绵羊miRNA参与早期胚胎发育过程。
基因组在胚胎发育早期被广泛去甲基化对胚胎正常发育至关重要,在发育过程中必须经过调控才能保持基因组稳定性[24]。其中组蛋白甲基化是影响核重编程效率的主要因素之一,且组蛋白甲基化比组蛋白乙酰化修饰更加复杂,其中H3氨基端的K4和K9作为组蛋白甲基化的多发位点,组蛋白甲基化转移酶催化H3K4和H3K9位点进行单甲基化、二甲基化和三甲基化水平的改变[25]。本试验利用免疫荧光染色检测对成熟卵母细胞补充miR-449b后组蛋白H3K9me3水平的改变,结果表明miR-449b能降低绵羊早期胚胎中组蛋白H3K9me3的表达水平。小鼠上的研究发现,正常受精后H3K9me3异染色质重编程清除启动子区域H3K9me3的障碍,为合子基因组激活建立不受限制的表观遗传环境,这可能是胚胎达到全能性状态所必需的[26]。在早期胚胎发育过程中,H3K9me3标记的基因相对较少且稳定,而大部分LTRs逐渐被H3K9me3依赖性异染色质标记,2-细胞胚胎特异性LTRs的表达水平是提高细胞发育潜能的标志[27-28],一些逆转录转座子上H3K9me3水平的增加与LTRs在2-细胞阶段后的沉默有关[8]。本试验结果发现,组蛋白H3K9me3在miR-449b mimic组2-细胞胚胎显著低于NC mimic与对照组胚胎,其表达水平与体外受精胚胎相似,表明miR-449b参与早期胚胎发育过程中组蛋白甲基化重编程。
4 结 论
miR-449b在绵羊精子中高表达,且能显著提高绵羊早期胚胎的发育率,降低早期胚胎中组蛋白H3K9me3的表达水平,表明miR-449b在早期胚胎发育过程中发挥重要作用,为进一步探索早期胚胎发育的分子机制提供参考。
