纳米粉碎对乳清浓缩蛋白及其微凝胶颗粒结构和界面性质的影响
2022-07-26郭雅娴李姿坤张喜瑞张满梁彬姬长建孙婵婵
郭雅娴,李姿坤,张喜瑞,张满,梁彬,姬长建,孙婵婵*
(1.烟台大学生命科学学院,山东 烟台 264003;2.鲁东大学食品工程学院,山东 烟台 264001;3.齐鲁师范学院物理与电子工程学院,山东 济南 250200)
乳清浓缩蛋白是牛奶中蛋白质的一种,乳清浓缩蛋白中含有α-乳白蛋白、β-乳球蛋白、乳铁蛋白、生长因子[1]等营养物质,具有蛋白质功效比值高、易被人体消化吸收等特点,是一种国际公认的优质人体蛋白质补充剂。此外,乳清浓缩蛋白还具有良好的乳化性、水合性、凝胶性、起泡性等,常作为乳化剂及发泡剂等应用在食品工业中。
近年来,为了增强蛋白质界面性质,常用的改性方法主要包括化学改性、物理改性、生物改性。物理改性通常是指利用机械方法,如球磨、高压均质等对物质进行破碎以减小其颗粒尺寸。与化学改性相比,物理改性操作简单,不会产生污染性废液。微粒化技术和纳米粉碎都属于物理改性方法。
纳米粉碎可以显著改变原材料的大小、结构和比表面积等,能够使物质界面性质得到增强,是近年来迅速发展形成的一种新兴的高科技工业技术,目前被广泛应用于食品[3]、化妆品、医疗等领域。
微粒化技术是通过热处理将蛋白质变成一种凝胶状态,再经过高速剪切等操作使蛋白质形成微凝胶颗粒。微凝胶颗粒是指粒径大小在10 nm~1 000 nm之间的胶体分散体系,粒子具有三维网络结构和在溶剂中溶胀的性质,具有稳定的空间结构,其尺寸小,比表面积大,表面有很多悬挂链段[2],所以能够不可逆地被吸附在相界面上,增强食品多相体系的稳定性。
为进一步扩展乳清浓缩蛋白在食品领域中的应用,解决国内蛋白质微凝胶颗粒粒径大、粒径分布不集中、制备能耗高等问题,本文以乳清浓缩蛋白为对照,考察纳米粉碎对乳清浓缩蛋白(whey protein concentrate,WPC)和乳清浓缩蛋白微凝胶颗粒(whey protein concentrate micro-gel particles,WPM) 多尺度结构和界面性质的影响,为蛋白质微凝胶颗粒的制备和高效应用提供支持。
1 材料与方法
1.1 材料与试剂
乳清浓缩蛋白粉(蛋白质含量80%):新西兰恒天然公司;大豆油:益海嘉里金龙鱼粮油食品股份有限公司;磷酸盐缓冲溶液(色谱纯):北京伊诺凯科技有限公司;氯化钠(色谱纯):烟台博纳实验器材有限公司;甘氨酸:北京鼎国昌盛生物技术有限公司;三羟甲基氨基甲烷[tris-(hydroxymethyl)-aminomethane,Tris]:美国Genview公司;5,5'-二硫代-2-硝基苯甲酸:上海华蓝化学科技有限公司。
1.2 仪器与设备
CJM-SY-B型高能纳米磨:中国秦皇岛太极环纳米产品有限公司;SY-2-6电热恒温水浴锅:天津市欧诺仪器有限公司;Ultra-Turrax T25高速乳化剪切机:德国IKA公司;LC-20AT高效液相色谱仪、RF-20A紫外检测器:日本岛津公司;FL-2500荧光分光光度计:日本日立集团;MS-DWS光学微流变分析仪、Turbiscan ASG静态多散射稳定性分析仪:法国Formulaction公司;CKX41倒置荧光显微镜:日本Olympus有限责任公司;BT-2001激光粒度分布仪:丹东百特仪器有限公司;T6新世纪紫外分光光度计:北京普析通用仪器有限公司。
1.3 试验方法
1.3.1 乳清浓缩蛋白的纳米粉碎预处理
将1 kg乳清浓缩蛋白粉加入到高能纳米磨的研磨槽中,按照质量比6∶1加入研磨球。为了防止蛋白质的热变性,研磨槽中工作温度采用冷却循环系统,控制在35℃以下。将纳米粉碎4 h和8 h的乳清浓缩蛋白样品分别命名为sWPC-4h和sWPC-8h。
1.3.2 乳清浓缩蛋白微凝胶颗粒的制备
采用微粒化技术制备乳清浓缩蛋白微凝胶颗粒。具体操作流程和技术参数:分别将WPC、sWPC-4h和sWPC-8h各12 g均匀分散于100 mL去离子水中,85℃处理30 min,4℃陈化10 h,10 000 r/min高速均质处理10 min。
WPM、sWPM-4h和 sWPM-8h分别为以 WPC、sWPC-4h和sWPC-8h为原料制备的微凝胶颗粒样品。
1.3.3 纳米粉碎对乳清浓缩蛋白及其微凝胶颗粒粒径的影响
以去离子水为分散介质,采用激光粒度分布仪对乳清浓缩蛋白及其微凝胶颗粒的粒径进行测定:将样品添加到装有800 mL去离子水的搅拌式测量池中,为了避免蛋白质的多重散射效应,保证测量的准确性,遮光度应达到10%~15%[4]。每个不同处理方式的样品均测量3次[5],取平均值。
1.3.4 纳米粉碎对乳清浓缩蛋白及其微凝胶颗粒分子量的影响
采用高效液相色谱仪检测各蛋白质样品分子量。色谱条件[6]:LC-20AT高效液相色谱仪和RF-20A紫外检测器组成的高效液相系统;分析柱为Biosep-SECS4000;洗脱液为0.1 mol/L磷酸盐缓冲溶液(pH6.7);流速0.6 mL/min。洗脱液经0.45 μm滤膜过滤后,超声脱气。将10 mg/mL样品溶液以10 000 r/min离心10 min,取上清液,用0.45 μm水相过滤器过滤,上样量20 μL,采用恒流洗脱。
1.3.5 纳米粉碎对乳清浓缩蛋白及其微凝胶颗粒游离巯基含量的影响
参考刘鑫硕[7]的Ellman试剂分析方法,并稍作改动,称取样品各50 mg,加入8 mL Tris-甘氨酸缓冲液,充分溶解,8 000 r/min离心10 min。量取1 mL上清液,加入2 mL Tris-甘氨酸缓冲液,0.02 mL Ellman试剂,充分混匀,室温反应25 min,采用紫外分光光度计测定412 nm处吸光度。
1.3.6 纳米粉碎对乳清浓缩蛋白及其微凝胶颗粒内源性荧光光谱的影响
将乳清浓缩蛋白及其微凝胶颗粒进行冷冻干燥处理,将冻干粉溶解于5mmol/L的磷酸盐缓冲液中,配制浓度为0.05mg/mL蛋白质待测液,将pH值调至7备用。设置荧光分光光度计的激发波长为295nm,激发和发射的狭缝距离为5nm[8],扫描波长范围为300nm~400 nm。
1.3.7 O/W型乳液的制备
取适量 WPC、sWPC-4h、sWPC-8h、WPM、sWPM-4h、sWPM-8h分别与大豆油混合,置于50 mL离心管中,12 000 r/min高速乳化均质处理3 min,即得到含油量为40%的O/W型乳液。
1.3.8 乳液微流变特性的测定
光学微流变分析仪是基于多散斑扩散光谱(multi-speckle diffusing wave spectroscopy,MS-DWS) 技术测定乳液微流变特性。光束照射到乳液中悬浮的油滴时发生多次散射[9],散射后的光被含有轨迹分析程序的图像处理系统接收并进行分析,得到散斑图像[10]。对每个油滴的位移分析后,绘制其均方位移曲线,进而计算得到微流变特性。
取20 mL乳液样品于测试瓶(平底圆柱形玻璃管,高140 mm,直径16 mm)中,然后测定各乳液的黏性、弹性、固液平衡值和流动性指数。
1.3.9 乳液稳定性的测定
采用静态多散射稳定性分析仪对乳液的稳定性进行测定,采用脉冲近红外光源(波长880 nm)自下而上扫描样品[11],两个光学探测器分别同步搜集透射光(transmission,TM)和背散射光(backscattering,BS)。在一定时间连续扫描样品,获得透射光与背散射光信号对样品高度的函数曲线图,即可反映出样品中颗粒运动趋势,进而预测出乳液的稳定性[12]。由于乳液均呈现白色不透明状,样品透射光量较小,本测定中主要选用背散射光强。
取20 mL乳液样品于测试瓶(平底圆柱形玻璃管,高140 mm,直径16 mm)中,在室温(25℃)下每2 h扫描1次,连续扫描24 h。
1.3.10 乳液微观形态的观察
取少量乳液样品置于载玻片上,小心盖上盖玻片,避免气泡的产生。采用倒置荧光显微镜(400倍)进行观察并拍照。
2 结果与分析
2.1 纳米粉碎对乳清浓缩蛋白及其微凝胶颗粒粒径的影响
纳米粉碎对乳清浓缩蛋白及其微凝胶颗粒粒径分布的影响见图1。
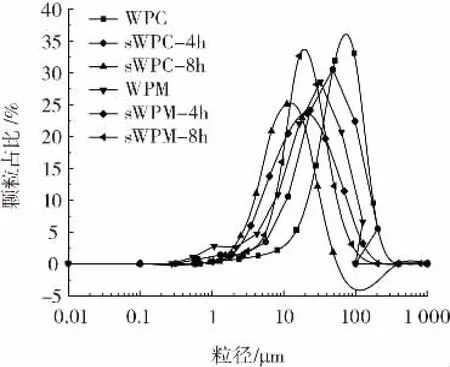
图1 纳米粉碎对乳清浓缩蛋白及其微凝胶颗粒粒径分布的影响Fig.1 Effect of nano grinding on particle size distribution of WPC and WPM
由图1可知,经过纳米粉碎的乳清浓缩蛋白微凝胶颗粒的粒径分布更加集中,有效粒径的范围和占比更大;各样品粒径分布均呈现正态分布,因此可以采用中位粒径表征粒径大小。
将各样品中位粒径进行汇总,结果见表1。

表1 纳米粉碎对乳清浓缩蛋白及其微凝胶颗粒中位粒径的影响Table 1 Effect of nano grinding on median particle size of WPC and WPM
由表1可知,纳米粉碎和微粒化技术处理均可以显著降低乳清浓缩蛋白的中位粒径(p<0.05)。且随着纳米粉碎时间的延长,中位粒径随之减小(p<0.05)。说明纳米粉碎和微粒化技术均破坏了蛋白质分子间的作用力,减小了蛋白质的尺寸。
2.2 纳米粉碎对乳清浓缩蛋白及其微凝胶颗粒分子量的影响
乳清浓缩蛋白及其微凝胶颗粒的高效液相色谱见图2。

图2 乳清浓缩蛋白及其微凝胶颗粒的高效液相色谱图Fig.2High performance liquid chromatograms of WPC and WPM
由图2可知,WPC在11、22、24 min附近分别洗脱出了3种物质,查阅文献可知[13],峰1为牛血清白蛋白,峰2为β-乳球蛋白,峰3为α-乳白蛋白。与色谱图对应的保留时间和峰面积数据如表2所示。

表2 纳米粉碎对WPC及WPM的保留时间与峰面积的影响Table 2 Effect of nano grinding on retention time and area of peaks of WPC and WPM
由表2可知,经过纳米粉碎处理后的乳清浓缩蛋白及其微凝胶颗粒出峰时间无明显变化,说明蛋白质的分子量无明显差异。经纳米粉碎后,sWPC-4h和sWPC-8h的峰1、峰2和峰3的峰面积均大于WPC,且随纳米粉碎处理时间的延长总体呈现增大的趋势。这可能是由于纳米粉碎破坏了蛋白质分子的内部结构,导致牛血清白蛋白、β-乳球蛋白和α-乳白蛋白在流动相中的溶解性增加。
WPM中未洗脱出峰1,可能是由于蛋白质变性形成不溶性聚集物,在流动相中溶解度降低,低于检测限。与WPM相比,sWPM-4h、sWPM-8h峰3的面积增加是因为α-乳白蛋白为一种钙离子结合蛋白,在经过纳米粉碎后,钙离子仍紧密结合在蛋白质上,导致其有较高的热稳定性。
2.3 纳米粉碎对乳清浓缩蛋白及其微凝胶颗粒游离巯基含量的影响
游离巯基含量的变化会影响蛋白质的二级、三级结构[14]。纳米粉碎对乳清浓缩蛋白及其微凝胶颗粒游离巯基含量的影响见表3。

表3 纳米粉碎对乳清浓缩蛋白及其微凝胶颗粒游离巯基含量的影响Table 3 Effect of nano grinding on the content of free sulfhydryl groups in WPC and WPM
由表3可以看出,纳米粉碎和微粒化技术处理均降低了乳清浓缩蛋白的游离巯基含量,这可能是由于纳米粉碎和微粒化技术将大颗粒蛋白破碎成小颗粒的过程中,原本被埋藏在分子内部的游离巯基暴露而被氧化成二硫键,这使得蛋白质的空间结构更为紧密。结合高效液相色谱结果,蛋白质分子量并无明显差异,说明样品经过纳米粉碎后,其一级结构并未受到破坏,说明二硫键的形成是在分子内,而不是在分子间。
2.4 纳米粉碎对乳清浓缩蛋白及其微凝胶颗粒内源性荧光光谱的影响
6种样品的内源性荧光光谱见图3。
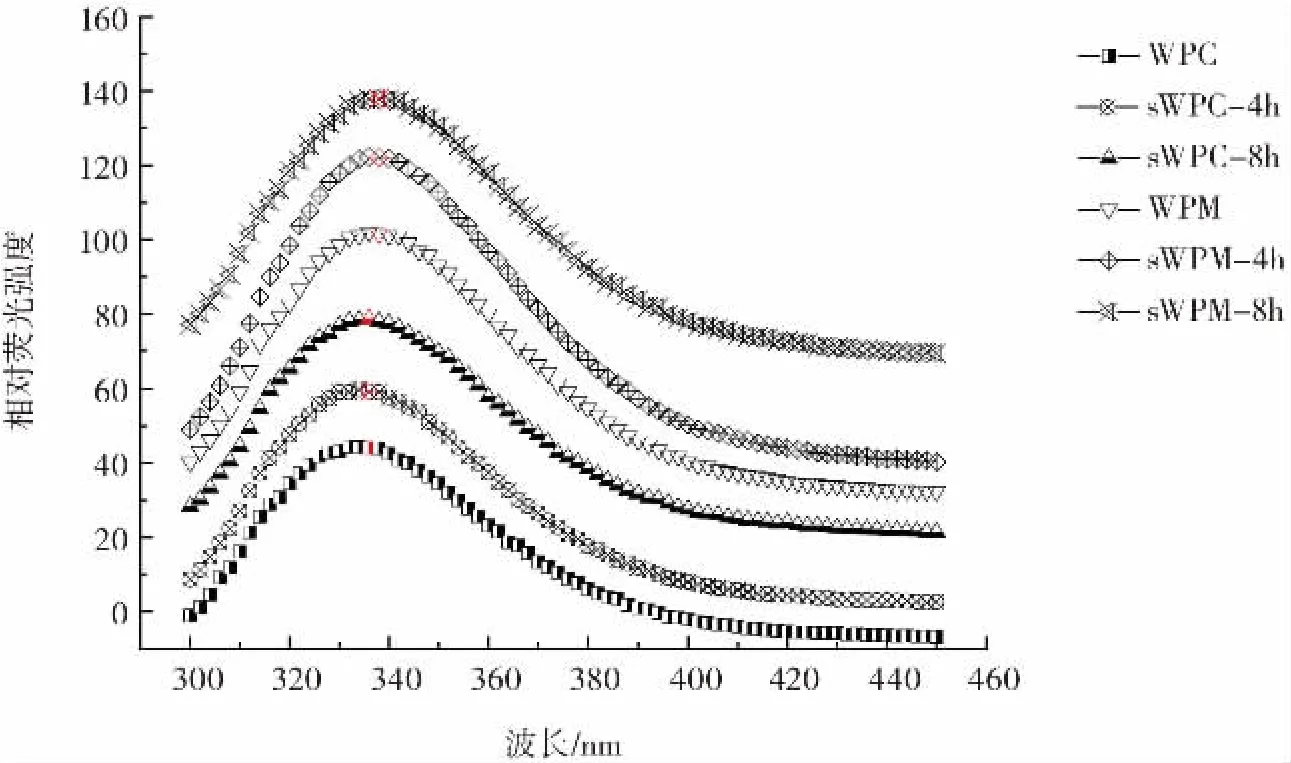
图3 纳米粉碎对乳清浓缩蛋白及其微凝胶颗粒内源性荧光光谱的影响Fig.3 Effect of nano grinding on endogenous fluorescence spectra of WPC and WPM
由图 3 可知,WPC、sWPC-4h、sWPC-8h、WPM、sWPM-4h、sWPM-8h的最大吸收波长(λmax) 分别为333、334、336、337、338、339 nm。说明纳米粉碎和微粒化处理后的乳清浓缩蛋白及其微凝胶颗粒的λmax均出现不同程度的红移。表明纳米粉碎和微粒化技术处理,使得原本在WPC内部的酪氨酸、色氨酸、苯丙氨酸等疏水性发色基团暴露出来,蛋白质的表面疏水性发生改变。而蛋白质多尺度结构的改变会进一步导致其功能性质的改变,如界面性质等。
2.5 乳液的微流变特性
采用光学微流变分析仪测定各乳液的微流变特性,结果如图4、图5所示。

图4 各乳液的弹性和黏性测定结果Fig.4 Elasticity index and viscosity index of emulsions

图5 乳液的固液平衡值和流动性指数测定结果Fig.5 Solid-liquid balance and fluidity index
由图4可知,在考察时间内,微凝胶颗粒乳液的黏性和弹性均大于乳清浓缩蛋白乳液。其中,sWPM-8h乳液具有最强的黏性和弹性,呈现出典型黏弹性流体特性。由图4a可知,随着时间的延长,sWPC-4h乳液的弹性逐渐大于WPC,sWPM-4h乳液的弹性逐渐接近于WPM;由图4b可知sWPC-8h乳液的黏性略高于sWPC-4h和WPC。
天然乳清浓缩蛋白是球蛋白,疏水基团内埋[15],使得其在乳液中与油的作用相对较弱。由以上可知,经过纳米粉碎预处理可使蛋白质和油结合更加紧密,这使得乳液的黏性和弹性均得到增强。
固液平衡值(solid-liquid balance,SLB)表征了样品的相态:SLB=0.5说明样品内部达到固液平衡,即不呈现典型的固体相态或液体相态;当0<SLB<0.5时,说明样品呈现固态主导的相态(凝胶态),且该数值越小,说明样品呈现越典型的凝胶态特征;而如果0.5<SLB<1.0说明样品呈现液体主导的相态(流态),且数值越大说明样品的流动性越大[16]。
由图 5可以看出,WPC、sWPC-4h、sWPC-8h 3 个样品制备的乳液的SLB均大于0.5,呈现出流体特性。sWPM-4h和sWPM-8h制备的乳液的SLB值都小于0.5,说明均呈现类固体的凝胶态。这可能是因为sWPM-4h和sWPM-8h中亲水基团和疏水基团的分布比例适中,能够很好地在水油界面保持稳定,形成较小的油滴,从而形成结构致密的乳液[17-18]。图5显示,WPC和sWPC-4h乳液流动性指数较大且较为接近,sWPC-8h、WPM、sWPM-4h、sWPM-8h次之。说明纳米粉碎能够提高乳清浓缩蛋白的界面性质。
2.6 乳液贮藏稳定性分析
图6展示了各乳液的背散射光强随着时间的变化情况。
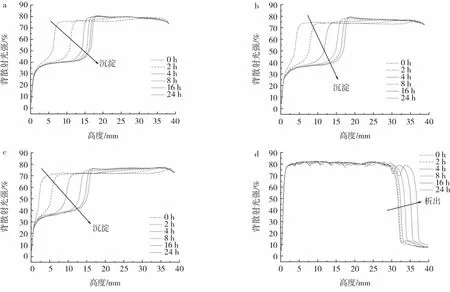
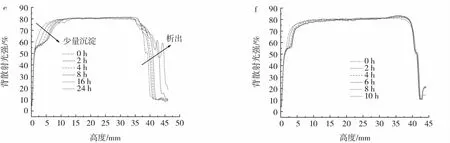
图6 乳液背散射光强随着时间的改变Fig.6 Back-scattering light profile in the function of test tube height for emulsions
WPC、sWPC-4h和sWPC-8h乳液在室温下贮藏过程中,样品的底部均出现了蛋白质沉淀,但是并没有出现油的析出。这是由于部分蛋白质与油滴结合形成密度小于连续相的聚集体[19-20],在贮藏过程中向顶部移动,而未与油滴结合的蛋白质则快速向底部移动,表现为沉淀的发生[21-22]。WPM和sWPM-4h乳液的上层均出现了油的析出。这是由于此时乳液中油滴过多,蛋白质覆盖率不足,油相暴露,油滴为趋于稳定会和邻近油滴共用蛋白质,从而导致絮凝。由于密度较小,油滴聚集后会快速向顶部移动,表现为顶层析出。由图6可以看出,sWPM-8h乳液整体的背散射光强比较稳定,没有明显变化,展示了极高的贮藏稳定性。
2.7 乳液的微观结构观察
在蛋白质分子中,色氨酸、酪氨酸以及苯丙氨酸3个氨基酸残基均能够发射荧光[23]。采用倒置荧光显微镜观察各乳液的微观结构,经特定滤光片,会看到蛋白质样品呈现明黄色,如图7所示。

图7 乳液的微观结构Fig.7 Microstructure of emulsions
由图7可以看出,油滴在乳液中均能够以圆形液滴均匀存在。乳液中蛋白质吸附在油水界面上,它能降低两相的界面张力,促进乳液形成,并且还能形成一层保护膜,保护油滴不被破坏,使乳液处于稳定状态。
相同含油量的乳液油滴由大到小依次为WPC、sWPC-4h、sWPC-8h、WPM、sWPM-4h、sWPM-8h。结合微观结构观察和稳定性测定结果可以发现,油滴的大小与稳定性成反比,这与Sun等[24]研究结果一致,表明乳液油滴粒径的减小增加了乳液的稳定性。
3 结论
纳米粉碎可以显著减小WPC和WPM的粒径,且随着处理时间的延长,粒径随之减小,其中sWPM-8h粒径最小。此外,纳米粉碎后,WPM粒径分布的集中程度得到增强。纳米粉碎和微粒化技术处理后,蛋白质分子量并无明显差异。WPC和WPM的游离巯基含量减少,证明了分子内二硫键的形成,这有利于蛋白质的紧密空间结构的形成。WPC和WPM的最大吸收波长出现红移,说明纳米粉碎和微粒化技术增强了蛋白质的表面疏水性。经纳米粉碎和微粒化处理后,乳液黏弹性和储藏稳定性整体上增强,固液平衡值整体上降低,乳液油滴大小减小。其中,sWPM-8h乳液具有最强的黏性和弹性、较小的固液平衡值、最小的流动性指数和最高的贮藏稳定性。以上结果说明纳米粉碎和微粒化技术能够改善乳清浓缩蛋白的界面性质。
