玉米须中正丁醇萃取物的活性成分分析及其降血糖作用
2022-07-26张晓玉潘宇翔王佳张婷婷陈海霞
张晓玉,潘宇翔,王佳,张婷婷,陈海霞
(天津大学药物科学与技术学院,天津 300072)
2型糖尿病(type 2 diabetic mellitus,T2DM)又称为非胰岛素依赖性糖尿病,是最常见的内分泌代谢疾病之一[1]。尽管现有很多用于治疗T2DM的药物,但是多数药物存在副作用。药用植物及其植物化学物质对T2DM有很好的治疗效果[2],不仅更安全,而且有助于改善人体抗氧化系统,具有改善胰岛素抵抗或促进其分泌的作用[3]。
玉米须(Zea mays L.)是禾本科玉蜀黍属植物的干燥花柱和柱头[4],是我国传统的中药材和农产品副产物,民间常以玉米须制成药茶辅助治疗糖尿病、高血压病[5]。它的活性成分复杂多样,主要包括多糖、多酚、甾醇、皂苷、有机酸[6]、生物碱[7]等。据报道,玉米须提取物具有多种生物活性,例如抗氧化[8]、降血糖[9]、神经保护[10]以及抗肥胖[11]等。用大鼠进行的玉米须亚慢性毒性实验结果表明,玉米须安全且无副作用[12]。玉米须富含多酚类化合物,具有很强的自由基清除能力,是良好的天然抗氧化剂来源。研究表明,玉米须的乙醇溶液(体积分数为50%)提取物可以通过抗前脂肪细胞增殖、抗脂肪生成和诱导脂肪分解来预防超重和肥胖的发生[13]。玉米须-玉米芯可以减少T2DM大鼠血糖值、改善脂代谢紊乱、减少脂质过氧化,从而明显减轻对糖尿病大鼠胰岛形态结构的损伤[14]。然而,目前关于玉米须不同极性溶剂萃取物活性成分的分析和降血糖活性的研究较少。本研究对玉米须乙醇提取物不同极性溶剂萃取物进行体外抗氧化及消化酶抑制活性分析,并对其正丁醇萃取物进行活性成分分析,同时探究正丁醇萃取物对高脂饮食和链脲佐菌素诱导的T2DM小鼠的降血糖作用,为相关研究提供数据支撑。
1 材料与方法
1.1 材料与仪器
1.1.1 实验动物
昆明小鼠[雄性,18 g~22 g,许可证号:SXCK(京)2014-0008]:北京华阜康生物科技股份有限公司。
屏障环境(SPF级)动物房饲养,环境温度20℃~22℃,相对湿度45%~55%,每天照明12 h。实验期间小鼠自由进食和饮水。严格按照《实验动物管理和使用指南》进行动物实验。
1.1.2 动物饲料
基础饲料(粗蛋白质≥18.0%、粗脂肪≥4.0%、粗纤维≤5.0%、粗灰分≤6.5%、矿物质0.6%~1.2%、水分含量≤8.0%)、高脂饲料(77%基础饲料、15%精制猪油、5%蔗糖、2%胆固醇、0.2%胆酸钠、0.7%盐):北京华阜康生物科技股份有限公司。
1.1.3 材料、试剂与仪器
玉米须:市售;链脲佐菌素(streptozotocin,STZ)、α-淀粉酶(3 700 U/g)、α-葡萄糖苷酶(50 U/mg):上海西格玛奥德里奇贸易有限公司;肝糖原测定试剂盒、肌糖原测定试剂盒、总胆固醇(total cholesterol,TC)测定试剂盒、甘油三酯(triglyceride,TG)测定试剂盒、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)测定试剂盒、低密度脂蛋白胆固醇(lowdensity lipoprotein cholesterol,LDL-C) 测定试剂盒、非酯化脂肪酸(non-esterified fatty acid,NEFA)测定试剂盒、糖化血清蛋白(glycated serum protein,GSP)测定试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)活性测定试剂盒、过氧化氢酶(catalase,CAT)活性测定试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GPX)活性测定试剂盒、丙二醛(malondialdehyde,MDA)测定试剂盒:南京建成生物工程研究所;胰岛素酶联免疫吸附(enzyme-linked immunosorbent assay,ELISA)测定试剂盒:武汉华美生物工程有限公司;阿卡波糖:北京拜耳医药保健有限公司;罗格列酮:成都恒瑞制药有限公司;葡萄糖(分析纯):北京索莱宝科技有限公司;乙醇、石油醚、乙酸乙酯、正丁醇(均为分析纯):天津市江天化工技术股份有限公司;乙腈(色谱纯):天津康科德科技有限公司。
BP-211D高精度天平:赛多利斯(上海)贸易有限公司;POCT型血糖仪:杭州艾康生物技术有限公司;N-1100型旋转蒸发仪:东京理化机械株式会社;TU-1810PC紫外分光光度计:北京普析通用仪器有限公司;6420型三重串联四极杆质谱仪:美国安捷伦科技有限公司。
1.2 方法
1.2.1 玉米须乙醇提取物及其不同极性溶剂萃取物的制备
将2 kg玉米须用体积分数为80%的乙醇溶液在80℃下提取3次,过滤并合并3次所得滤液,减压蒸发滤液以除去乙醇。将乙醇提取物分散在水中,分别用石油醚、乙酸乙酯和正丁醇萃取,得到石油醚萃取物(petroleum ether fraction,PEF)、乙酸乙酯萃取物(ethyl acetate fraction,EAF)以及正丁醇萃取物(n-butanol fraction,NBF)。
1.2.2 玉米须乙醇提取物不同极性溶剂萃取物总多酚、总黄酮和总甾醇含量测定
通过多酚与蛋白质相互作用产生沉淀以及使氯化铁显色判断萃取物中是否含有多酚。以没食子酸为对照品,采用福林-西奥卡特比色法[15]测定样品总多酚含量(total polyphenols content,TPC),TPC 以没食子酸计,单位表示为mg GAE/g干玉米须。
以芦丁为对照品,通过比色法[15]测定样品总黄酮含量(total flavonoids content,TFC),TFC 以芦丁计,单位表示为mg RE/g干玉米须。
以β-谷甾醇为对照品,参考Miao等[16]的方法通过比色法测定样品总甾醇含量(total sterols content,TSC),总甾醇含量以β-谷甾醇计,单位表示为mg SE/g干玉米须。
1.2.3 玉米须乙醇提取物不同极性溶剂萃取物抗氧化和消化酶抑制活性测定
参考Fu等[17]的研究方法,测定玉米须乙醇提取物不同极性溶剂萃取物的DPPH自由基清除活性。参考Nakajima等[18]的研究方法,测定各萃取物的铁离子还原/抗氧化能力(ferric ion reducing antioxidant power,FRAP)。参考Chen等[19]的研究方法,测定各萃取物对α-淀粉酶抑制活性,以阿卡波糖为参照。参考Rahmi等[20]的研究方法,测定各萃取物对α-葡萄糖苷酶的抑制活性,以阿卡波糖为参照。
1.2.4 NBF的液相色谱串联质谱(liquid chromatography tandem mass spectrometry,LC-MS/MS)分析
用LC-MS/MS法对NBF中的活性成分进行分析。使用高效液相色谱仪,检测器为二极管阵列检测器(diode array detector,DAD),三重串联四极杆质谱仪配备电喷雾离子源(electron spray ionization,ESI)。Kromasil 100-5 C18(250 mm×4.6 mm,5 μm)液相色谱柱,流动相A(0.1%乙酸,99.9%水),流动相B(乙腈)。梯度洗脱:90%A,10%B(0~2 min);90%~80%A,10%~20%B(2 min~15 min);80%~70%A,20%~30%B(15 min~17 min);70%A,30%B(17 min~30 min),70%~0%A,30%~100%B(30 min~40 min);0%~90%A,100%~10%B(40 min~45 min),柱温为 30 ℃,流速为 0.5 mL/min,进样量为 10 μL。
分析物在正离子模式下扫描,全扫描光谱的范围为 100 amu~1 000 amu。
1.2.5 动物实验设计
使用高脂饮食和STZ诱导的T2DM小鼠研究NBF的降血糖作用。小鼠适应喂养2 d后,除空白对照(NC)组外,其余小鼠均用高脂饲料喂养,并在4周后72 h内按90 mg/kg bw的剂量两次腹腔注射STZ(溶于盐水),NC组按同样标准注射生理盐水。3 d后,将小鼠禁食过夜,尾静脉采集血样,测量空腹血糖水平。选高血糖(血糖含量>11.6 mmol/L)小鼠作为糖尿病小鼠进一步研究。
将糖尿病小鼠随机分为5组,每组8只,高脂饲料喂养。NC组:生理盐水灌胃,基础饲料喂养;阳性对照(PC)组:2 mg/kg bw 罗格列酮(rosiglitazone,RSG)灌胃;糖尿病对照(DC)组:生理盐水灌胃;其他3组分别用 100、200、400 mg/kg bw NBF 灌胃,连续灌胃 28 d。每天记录小鼠的进食量、饮水量和体质量。实验结束后,将各组小鼠禁食过夜后颈椎脱臼处死。将血样收集在离心管中并立即离心(1 700×g,4℃,10 min),将肝脏、肾脏和胰腺收集在微量试管中,所有样品于-80℃保存。
1.2.6 空腹血糖的测定及口服葡萄糖耐量试验
在第7、14、21、28天将小鼠禁食过夜后尾静脉采集血样,进行空腹血糖(fasting blood glucose,FBG)水平的测量。第26天禁食过夜后,小鼠口服2 g/kg bw 10%葡萄糖,0、30、60、90、120 min 后尾静脉采集血样。对小鼠进行口服葡萄糖耐量试验(oral glucose tolerance test,OGTT),使用血糖仪测量血糖水平。
1.2.7 降血糖机制相关指标检测及组织切片病理学检查
按照试剂盒的说明测定血清中TC、TG、HDL-C、LDL-C、NEFA、GSP 水平和肝脏中 CAT、SOD、MDA、GPX水平,以及肝糖原和肌糖原水平,按照ELISA测定试剂盒的说明测定血清中胰岛素水平。取小鼠肝脏、肾脏和胰腺,用4%甲醛固定后石蜡包埋切片,并用苏木精-伊红染色(hematoxylin-eosin staining,H&E)法染色,在电子显微镜下观察并拍摄各组小鼠组织病理学状态。
1.3 统计分析
使用SPSS 20.0进行数据分析。所有结果均表示为平均值±标准差。通过单因素方差分析和Dunnett’s t检验分析组间差异。P<0.05认为具有显著差异,P<0.01认为具有极显著差异。
2 结果与分析
2.1 总多酚、总黄酮和总甾醇含量分析
玉米须乙醇提取物中加入牛血清白蛋白溶液后,有黄色沉淀生成;与氯化铁溶液反应,颜色迅速由黄色变为深绿色,表明玉米须乙醇提取物中存在有两个相邻羟基的多酚化合物。玉米须乙醇提取物不同极性溶剂萃取物的得率、TPC、TFC和TSC见表1。

表1 不同极性溶剂萃取物得率、总多酚、总黄酮和总甾醇含量的比较分析Table 1 Comparison of yield,total polyphenols content,total flavonoids content,and total sterols content of different polar solvent fraction
由表1可知,PEF的得率最高(1.83%),EAF的得率最低(0.90%)。不同极性溶剂萃取物活性成分含量不同,不同极性溶剂萃取物TFC均低于TPC,TPC和TFC 大小顺序均为 NBF>EAF>PEF(P<0.05),推断黄酮类化合物可能是玉米须多酚的主要组分。TSC大小顺序为 PEF>EAF>NBF(P<0.05)。相关研究表明,NBF中TPC[(164.1±9.7)μg GAE/g干玉米须]最高(P<0.05),而PEF中TPC[(16.4±0.9)μg GAE/g干玉米须]最低[21],与本研究结果相似。
2.2 抗氧化和消化酶抑制活性测定
氧化作用与糖尿病和代谢紊乱在内的多种疾病的发生有很大的相关性[22],从植物中提取的天然抗氧化剂由于其能有效消除自由基且毒性较小已被广泛研究。本研究比较了玉米须乙醇提取物不同极性溶剂萃取物的抗氧化和消化酶抑制活性,结果见图1。

图1 玉米须乙醇提取物不同极性溶剂萃取物抗氧化和消化酶抑制活性Fig.1 Antioxidant and digestive enzyme inhibitory activities of different polar solvent extracts of corn silk alcohol extract
由图1可知,从DPPH自由基清除率和FRAP来看,NBF和EAF的抗氧化活性明显高于PEF,且NBF的DPPH自由基清除活性和FRAP最强。玉米须乙醇提取物不同极性溶剂萃取物的α-淀粉酶抑制率大小顺序:EAF>NBF>PEF,其中EAF和NBF的抑制率均显著高于阿卡波糖(P<0.05),PEF的抑制率显著低于阿卡波糖(P<0.05)。不同极性溶剂萃取物对α-葡萄糖苷酶的抑制作用与对α-淀粉酶抑制作用趋势一致。结合PEF中TSC最高,但其抗氧化活性和消化酶抑制活性最低,说明甾醇不是玉米须发挥抗氧化和消化酶抑制作用的主要活性成分。EAF和NBF的抗氧化和消化酶抑制活性高于PEF,说明黄酮等多酚类化合物是起到抗氧化和消化酶抑制活性的主要成分。据报道,植物提取物的抗氧化活性与总多酚的含量有关,而黄酮类化合物作为一种有效的抗氧化剂是最常见和分布最广的植物酚类化合物[21]。NBF有较高的得率,且其中总多酚和总黄酮含量最高,有较好的抗氧化和消化酶抑制活性,因此,选择NBF用于进一步的LC-MS/MS分析和小鼠体内实验研究。
2.3 NBF的LC-MS/MS分析
对NBF进行LC-MS/MS分析,15种主要化合物的保留时间和质荷比(m/z)列于表2。基峰图如图2所示。

图2 LC-MS/MS的基峰图Fig.2 Base peak chromatogram of LC-MS/MS
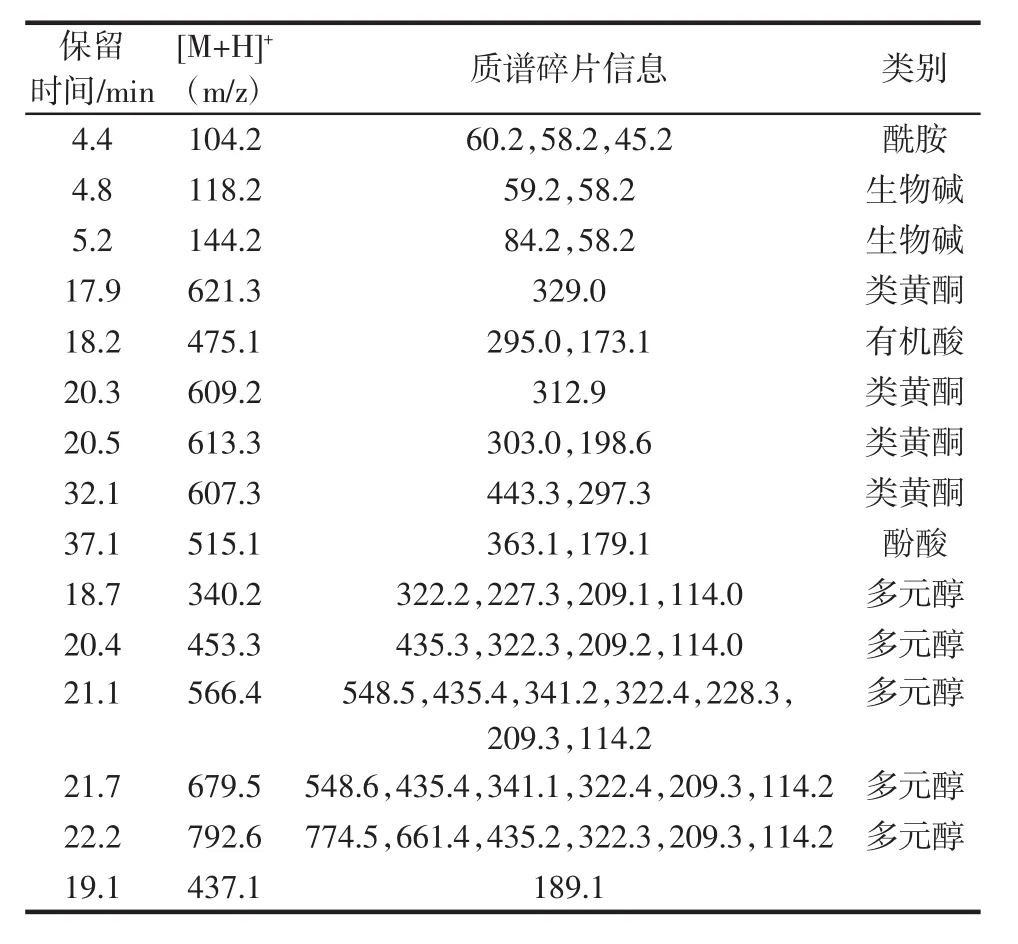
表2 NBF的LC-MS/MS初步分析Table 2 Tentative analysis of NBF by LC-MS/MS
由表2和图2可知,初步鉴定出了15种化合物,NBF富含的多酚化合物大部分以糖苷的形式存在。在NBF中发现并鉴定了5种多酚化合物(4种类黄酮和1种酚酸),LC-MS/MS数据表明NBF中确实存在黄酮类化合物,它们是多酚化合物的主要成分。根据[M+H]+,保留时间为4.4 min的化合物可能是酰胺,保留时间为4.8、5.2 min的化合物可能是生物碱,均为含氮化合物。其余多数化合物都具有部分相似的碎片,它们都首先失去H2O,意味着结构中可能存在羟基,可能是同系化合物。推断这些同系物是一类具有环和长链结构的多元醇化合物,更详细的分析需要进一步分离和研究。
2.4 NBF对糖尿病小鼠的降血糖作用
2.4.1 进食量、饮水量和体质量分析
高脂饮食联合STZ注射可以诱导T2DM小鼠模型,高脂饮食可以诱导胰岛素抵抗,小剂量注射STZ可以破坏部分胰岛β细胞,使胰岛素分泌减少[23]。NBF对小鼠体质量的影响见表3,对小鼠进食量和饮水量的影响见表4。

表3 NBF对小鼠体质量的影响Table 3 Effect of NBF on body weight of mice

表4 NBF对小鼠进食量和饮水量的影响Table 4 Effect of NBF on food intake and water consumption of mice
由表3可知,DC组小鼠第1周体质量极显著低于NC组小鼠(P<0.01)。NBF灌胃后,小鼠体质量增加,生长速度明显高于DC组。高脂饮食和STZ诱导的糖尿病小鼠主要症状是进食量和饮水量的增加[24]。由表4可知,DC组的进食量和饮水量与NC组相比显著升高;NBF组的进食量和饮水量均随时间延长呈先增大后减小的趋势。最后1周,NBF组的进食量和饮水量极显著小于DC组(P<0.01)。结果表明,与DC组相比,不同剂量NBF可减少进食量和饮水量,使小鼠体质量增加。推测NBF通过修复β细胞使血糖水平恢复正常,减轻尿糖和多尿的症状,从而减少饮水和进食,减少糖分流失并改善体质量。
2.4.2 NBF对血糖水平和糖原水平的影响
高血糖是糖尿病的主要特征,长期的高血糖会损害眼睛等人体组织器官。常用FBG水平和OGTT评估药物对葡萄糖代谢的影响[25]。NBF对血糖水平和糖原水平的影响见图3。

图3 NBF对血糖水平和糖原水平的影响Fig.3 Effects of NBF on blood glucose level and glycogen level
由图3A可知,与NC组相比,高脂饮食与STZ注射相结合使FBG水平极显著升高(P<0.01)。灌胃4周后,DC组小鼠的FBG水平基本保持不变,而NBF组小鼠FBG水平明显下降。由图3B可知,NC组和DC组在OGTT期间血糖水平差异明显。给予葡萄糖后,各组小鼠血糖水平在30 min时出现高峰值,随后下降直至实验结束。NBF组血糖水平下降速度明显快于DC组。实验结束时(120 min),DC组血糖水平无明显下降,NBF组血糖水平恢复至正常水平。此外,由图3C可知,与NC组相比,DC组的曲线下面积(area under the cure,AUC)升高了约150%。相对于DC组,NBF组AUC分别降低了29.11%、28.58%和19.63%。
这些结果表明NBF改善了糖尿病小鼠的葡萄糖耐受性并起到了降血糖作用。许多富含黄酮和多酚的植物提取物被认为可以增加葡萄糖耐量并具有降血糖作用[26-27]。也有报道称,从玉米须提取的粗黄酮可以显著降低血糖水平[28]。结合本研究表明,玉米须的黄酮类和多酚类化合物在降血糖方面发挥着重要作用。
糖尿病小鼠CAT和GPX等抗氧化酶的表达相对较低,β细胞也可能产生氧化应激[29]。由图3D可知,NBF给药后,血清胰岛素水平与DC组相比显著降低(P<0.05),这可能与NBF能提高胰岛素敏感性有关。富含多酚的NBF具有良好的抗氧化活性,可以消除自由基,修复胰腺等人体组织器官。研究表明,多酚在多种动物模型中具有抗肥胖和降血糖作用[30]。本研究发现NBF可以改善T2DM小鼠的葡萄糖耐受性,修复胰岛细胞,抑制消化酶活性,从而起到降血糖作用。
糖原代谢作为体内碳水化合物代谢的重要组成部分,出现代谢紊乱可能使血糖水平升高而引起糖尿病。由图3E可知,DC组小鼠肝糖原水平较NC组极显著降低(P<0.01)。NBF(100、400 mg/kg bw)组小鼠肝糖原水平较DC组显著升高(P<0.05),肌糖原水平各组之间无显著差异。这些结果表明NBF的降血糖作用可能通过促进肝糖原合成而实现的。
2.4.3 NBF对糖化血清蛋白、非酯化脂肪酸和血脂水平的影响
血清葡萄糖水平过高会使蛋白质、脂质和核酸等大分子发生糖基化,产生高级糖基化终产物,使其出现结构异常,细胞功能受到影响[31]。NBF对NEFA、GSP和血脂水平的影响见表5。

表5 NBF对TC、TG、HDL-C、LDL-C、NEFA和GSP水平的影响Table 5 Effects of NBF on levels of TC,TG,HDL-C,LDL-C,NEFA and GSP
由表5可知,NBF组GSP水平较DC组极显著降低(P<0.01),表明NBF可以通过降低GSP水平起到降血糖作用。
NEFA与胰岛素抵抗和肥胖等代谢紊乱有关。NEFA氧化可影响糖尿病患者的胰岛素敏感性并引起代谢紊乱。与NC组相比,DC组小鼠NEFA水平极显著增加(P<0.01)。剂量为 200、400 mg/kg bw的NBF组小鼠NEFA水平极显著低于DC组(P<0.01)。此外,与NC组相比,DC组的血清TC和TG水平极显著增加(P<0.01)。当小鼠NBF灌胃4周后,血清TC和TG水平呈剂量依赖性下降。NBF组HDL-C水平较DC组显著升高,而LDL-C水平则极显著降低(P<0.01)。结果均表明NBF可以成为一种很有前景的降脂药物。推测NBF主要通过清除自由基、抑制氧化、减少脂质吸收、加速脂质降解来发挥降脂作用,从而发挥缓解和治疗糖尿病的作用。
2.4.4 NBF对抗氧化酶活性的影响
本研究测定了包括CAT、GPX和SOD在内的抗氧化酶的活性,并测定了各组小鼠MDA水平,结果见表6。

表6 NBF对MDA水平和抗氧化酶活性的影响Table 6 Effects of NBF on MDA level and antioxidant enzymes activities
由表6可知,NBF可以提高抗氧化酶活性,抑制氧化应激。DC组小鼠CAT、GPX和SOD活性较NC组极显著降低(P<0.01)。与 DC 组相比,NBF(200 mg/kg bw)可显著恢复糖尿病小鼠抗氧化酶活性。与DC组相比,NBF组(400 mg/kg bw)脂质氧化的终产物MDA水平显著降低(P<0.05)。许多疾病的治疗效果是由抗氧化特性介导的[32],改善体内抗氧化环境对糖尿病的治疗具有重要意义。NBF的体外抗氧化活性比较高,充分补充外源性抗氧化剂可以提高CAT、GPX和SOD等酶的活性,有效抑制自由基的氧化,从而预防或治疗因氧化而引起的疾病。
2.4.5 肾脏、肝脏以及胰腺组织切片病理学检查
H&E染色的肾脏、肝脏以及胰腺组织病理切片图如图4所示。
由图4A2可知,DC组小鼠与NC组小鼠相比肾脏出现严重损伤。DC组可见肾小管损伤;部分肾小球充血、硬化、肥大;系膜细胞增生肥大;淋巴细胞浸润。NBF可以明显减轻肾脏组织学损伤,NBF组肾小球硬化均消失,400 mg/kg bw NBF组肾脏未发现明显异常。
T2DM是一种可造成全身性损害的代谢性疾病,肝脏作为靶器官之一,不可避免会受到影响[33]。由图4B1可知,NC组肝细胞形态正常、肝细胞索排列有序,DC组小鼠中观察到包括细胞变性、细胞坏死和肝索混乱在内的明显的肝损伤。NBF并没有使症状有太大改善,但使坏死细胞减少,这可能是由于NBF改善了肝脏化学环境。
由图4C1可知,NC组胰腺切片显示β细胞结构完整,排列均匀。相比之下,DC组切片显示β细胞减少、出现局灶性坏死和淋巴细胞浸润。与DC组相比,NBF组胰腺病变明显减轻,400 mg/kg bw NBF组胰腺β细胞数量更多,分布更均匀,胰岛结构更完整。
有研究表明,黄酮类化合物和有机酸联合治疗可以显著改善STZ诱导的糖尿病大鼠肾脏结构退化,可以保护肾脏的结构和功能[34]。本研究发现,NBF富含多酚和有机酸。肝脏、肾脏和胰腺组织学结果表明NBF可以修复受损的细胞和器官,在T2DM的治疗中,对改善糖代谢和脂代谢紊乱,提高抗氧化活性和胰岛素分泌有重要作用。组织病理学检查显示NBF可以修复肝脏、肾脏和胰腺的病理变化,这可能是NBF改善糖尿病症状的作用机制之一。
3 结论
玉米须的降血糖潜力使其成为一种有价值的农业副产品。从玉米须乙醇提取物中提取出PEF、EAF和NBF,通过体外抗氧化和消化酶抑制研究发现,NBF具有以不同方式降低血糖的潜力。通过LC-MS/MS分析,推测NBF主要含有黄酮苷、生物碱和多元醇等化合物,但需要进一步研究。在动物实验中发现NBF可以缓解体质量减轻、降低血糖水平和调节血清胰岛素水平。OGTT发现NBF可改善T2DM小鼠的葡萄糖耐受性。NBF处理后脂质水平得到调节,抗氧化酶活性增加。从组织病理学观察来看,NBF还发挥细胞保护作用。这表明NBF通过抑制消化酶活性、改善抗氧化环境、修复组织器官等作用起到降血糖作用。这些结果表明,玉米须乙醇提取物的正丁醇萃取物具有良好的降血糖功效。
