1株南美蟛蜞菊内生真菌Aspergillus sp.PQJ-1次级代谢产物及其抗菌活性研究
2022-07-26李文杏王一诺张荣浚陈文豪
李文杏,王一诺,马 涛,张荣浚,惠 阳,陈文豪*
(1.热带药用资源化学教育部重点实验室/海南师范大学 化学与化工学院,海南 海口 571158;2.热带药用植物化学海南省重点实验室/海南师范大学 化学与化工学院,海南 海口 571158)
植物内生真菌资源丰富,其次生代谢产物种类繁多,具有促进植物生长、提高植物抗逆性、抑制病原菌、抗癌、降解环境污染物等功效,被广泛应用于医学、农业和环保方面,前景广阔[1-2]。
曲霉属(Aspergillus)真菌次级代谢产物已被广泛研究。其能够产生多种结构类型和丰富生物活性的次级代谢产物,为活性天然产物的重要来源之一[3]。例如具有抗肿瘤活性的malformin A、3β,15β-二羟基-(22E,24R)-麦角甾-5,8(14),22-三烯-7-酮[4];抑制α-葡萄糖苷酶活性的丁内酯[5];具有抗菌活性的clava⁃tone和clavatol;具有抗植物病原菌的聚酮类、萜类、肽类[6]。以上研究结果显示,曲霉属真菌次级代谢产物具有药用先导化合物研究开发的重要前景。
本文研究了1 株南美蟛蜞菊(Sphagneticola trilobata)来源内生真菌Aspergillussp.PQJ-1 的次级代谢产物,综合运用HPLC等色谱分离手段,从中分离得到6个化合物,通过核磁共振(NMR)、质谱(MS)等方法分别鉴定为cyclo-D-Trp-L-Pro(1),1H-indole-3-carboxaldehyde(2),isoeugenin(3),flufaran(4),aflatoxinB1(5),sterigmato-cystin(6)。化合物1~6的化学结构式如下:
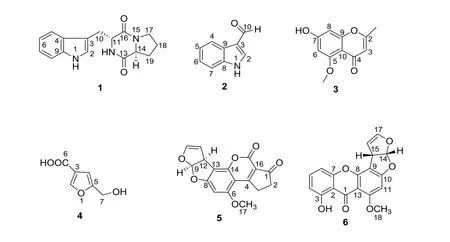
图1 化合物1~6的化学结构Figure 1 Chemical structures of compounds 1~6
1 材料与方法
1.1 仪器与试剂
MAT-95-MS 质谱仪,德国Finnigan 公司;Bruker AV-400MHz 超导核磁共振仪,瑞士Bruker 公司;Agi⁃lent1260分析型高效液相色谱仪,美国安捷伦公司;EYELAN-100旋转蒸发仪,日本东京理化有限公司;YO⁃KO-ZK 紫外分析暗箱,武汉药科新技术开发有限公司;Sephadex LH-20 凝胶,安法玛西亚技术上海有限公司;柱色谱硅胶,青岛海洋化工厂;氘代试剂,艾览化工科技有限公司;其他常用溶剂,西陇化工股份有限公司。
1.2 菌株的分离及培养
1.2.1 菌株来源
真菌Aspergillussp.PQJ-1来源于南美蟛蜞菊,南美蟛蜞菊于2020年7月采自海南师范大学桂林洋校区,经海南师范大学生命科学院关亚丽教授鉴定为南美蟛蜞菊(Sphagneticola trilobata)。根据菌株Aspergillussp.PQJ-1 形态特征和18S rRNA 基因序列(GenBank 登录号NO.OM269036)进行鉴定,菌种存放于海南师范大学热带药用资源化学教育部重点实验室。菌株以PDA为培养基,4 ℃保存。
1.2.2 菌株的培养
菌株Aspergillussp.PQJ-1 用PDA 液体培养基恒温28 ℃静置培养35 d,1 000 mL 三角锥形瓶每瓶加入300 mL培养液,120 ℃的高温灭菌锅灭菌20 min,待培养基冷却后接种,共发酵300瓶。
1.3 提取与分离
采用乙酸乙酯萃取发酵液,萃取3次,减压浓缩得到乙酸乙酯提取物总浸膏(150 g),将总浸膏用正相硅胶柱色谱进行分离,用三氯甲烷-丙酮(体积比10∶1~0∶10)体系进行梯度洗脱,得到7 个组份(Fr.1-Fr7)。其中Fr.1(13.0 g)经反复正相硅胶柱色谱梯度洗脱分离,得到化合物4(1.2 g),最后经半制备HPLC以乙腈-水(体积比55∶45,流速3 mL/min)制备得到化合物1(10.2 mg)。Fr.2(18.5 g)经反复正向硅胶柱色谱梯度洗脱分离,再经半制备HPLC 以乙腈∶水(体积比33∶67,流速3 mL/min)制备得到化合物2(6.3 mg)、化合物3(5.7 mg)、化合物5(7.2 mg)、化合物6(7.5 mg)。
1.4 生物活性测试
1.4.1 抗菌活性
采用96孔板微量稀释法,测定所有化合物对耐甲氧西林金黄色葡萄球菌(Staphylococcus autrus subsp)、白色念珠菌(Candida albicans)、大肠杆菌(Escherichia coli)的抗菌活性,环丙沙星为阳性对照,二甲基亚砜(DMSO)为阴性对照,在细胞培养箱中培养24 h后,观察从上到下不长菌的澄清的孔即为该测试样品的最小抑菌浓度MIC[7]。
2 实验结果
2.1 化合物结构鉴定
化合物1:黄色粉末,分子式:C16H17N3O2;ESI-MSm/z:284.3[M+H]+。1H NMR(CDCl3,400 MHz):δ7.59(H,dd,J=0.4,5.2 Hz,H-5),7.40(1H,d,J=5.6 Hz,H-8),7.24(1H,m,H-7),7.14(1H,m,H-6),7.12(1H,d,J= 1.2 Hz,H-2),4.36(1H,dd,J= 2.4,8.0 Hz,H-11),4.07(1H,t,J= 4.8 Hz,H-14),3.77(1H,ddd,J= 0.4,2.4,10.0 Hz,H-10b),3.64(1H,m,H-17a),3.58(1H,m,H-17b),2.97(1H,dd,J= 7.2,10.0 Hz,H-10a),2.32(1H,m,H-19a),2.02(1H,m,H-19b),2.01(1H,m,H-18a),1.91(1H,m,H-18b)。13C NMR(CDCl3,100 MHz):δ169.8(C-13),166.0(C-16),137.1(C-9),127.2(C-4),123.7(C-2),123.3(C-7),120.5(C-6),119.0(C-5),112.0(C-8),110.5(C-30),59.7(C-14),55.0(C-11),45.9(C-17),28.8(C-19),27.3(C-10),23.1(C-18)。以上数据与参考文献[8]数据一致,因此确定化合物1为cyclo-D-Trp-L-Pro。
化合物2:浅黄色粉末,分子式:C9H7NO; ESI-MSm/z:146.2[M+H]+。1H NMR(DMSO-d6,400 MHz):δ9.93(1H,s,H-10),8.28(1H,s,H-2),8.10(1H,d,J= 8.0 Hz,H-4),7.52(1H,d,J= 8.0 Hz,H-7),7.26(2H,m,H-5 and H-6)。13C NMR(DMSO-d6,100 MHz):δ185.0(C-10),138.5(C-2),137.1(C-8),124.2(C-9),123.5(C-6),122.1(C-5),120.8(C-4),118.2(C-3),112.5(C-7)。数据与参考文献[9]一致,因此确定化合物2为1H-Indole-3-carboxaldehyde。
化合物3:淡黄色油状物,分子式:C11H10O4,ESI-MSm/z:205.0[M-H]-。1H NMR(DMSO-d6,400 MHz):δ6.56(1H,d,J=2.4 Hz,H-8),6.51(1H,d,J=2.4 Hz,H-6),5.57(1H,s,H-3),3.91(1H,s,OCH3),2.52(3H,s,2-CH3)。13C-NMR(DMSO-d6,100 MHz):δ169.4(C-4),161.8(C-5),160.9(C-7),156.2(C-9),138.1(C-2),116.2(C-8),105.8(C-10),100.5(C-6),86.5(C-3),56.5(OCH3),23.0(CH3)。以上数据与参考文献[10]一致,因此确定化合物3为isoeugenin。
化合物4:无色针状晶体,分子式:C6H6O4,ESI-MSm/z:143.1[M+H]+。1H NMR(Acetone-d6,400 MHz):δ7.96(1H,s,H-2),6.43(1H,s,H-4),4.44(2H,s,H-7)。13C-NMR(Acetone-d6,100 MHz):δ174.6(C-6),169.7(C-5),146.8(C-3),138.5(C-2),109.7(C-4),61.1(C-7)。以上数据与参考文献[11]一致,因此确定化合物4为flufaran。
化合物5:浅黄色粉末,分子式:C17H12O6,ESI-MSm/z:313.1[M+H]+。1H NMR(DMSO-d6,400 MHz):δ6.93(1H,d,J=8.0 Hz,H-11),6.75(1H,s,H-9),6.73(1H,s,H-10),5.40(1H,t,J=2.4 Hz,H-7),4.75(1H,dd,J= 6.8,2.0 Hz,H-12),3.93(3H,s,H-17),3.25(2H,t,J= 4.0 Hz,H-3),2.47(2H,t,J=5.2 Hz,H-2)。13C-NMR(DMSO-d6,100 MHz):δ200.9(C-1),177.4(C-15),164.9(C-4),161.3(C-8),154.3(C-6),152.0(C-14),145.7(C-10),116.4(C-16),113.4(C-11),107.1(C-13),103.3(C-5),102.4(C-7),91.3(C-9),57.0(C-17),46.9(C-12),34.8(C-2),28.7(C-3)。以上数据与参考文献[12]一致,因此确定化合物5为aflatoxin B1。
化合物6:浅黄色粉末,分子式:C18H12O6,ESI-MSm/z:325.1[M+H]+。1H NMR(DMSO-d6,400 MHz):δ13.22(1H,s,OH-3),7.50(1H,t,J=8.4 Hz,H-5),6.84(2H,d,J=7.6 Hz,H-6,14),6.76(1H,d,J=8.4 Hz,H-4),6.50(1H,t,J=2.4 Hz,H-15),6.44(1H,s,H-11),5.45(1H,t,J=2.8 Hz,H-16),4.82(1H,dt,J=2.0,7.2 Hz,H-17),4.00(3H,s,CH3-18)。13C-NMR(DMSO-d6,100 MHz):δ181.6(C-1),164.8(C-10),163.5(C-12),162.4(C-3),155.1(C-7),154.2(C-8),145.5(C-17),135.9(C-5),113.4(C-14),111.4(C-4),109.1(C-2),106.7(C-6),106.1(C-9),106.0(C-13),102.6(C-16),90.6(C-11),56.9(C-18),48.2(C-15)。以上数据与参考文献[13]一致,因此确定化合物6为sterigmatocystin。
2.2 抗菌活性实验结果
对化合物1~6进行了抗菌活性测试,发现化合物1、5、6对耐甲氧西林金黄色葡萄球菌显示微弱抗菌活性,MIC 值分别为25、25 和12.5µg/mL,阳性对照环丙沙星(Ciprofloxacin)的MIC 值为1.56µg/mL;化合物1、2、4~6对白色念珠菌活性与阳性对照效果相当。
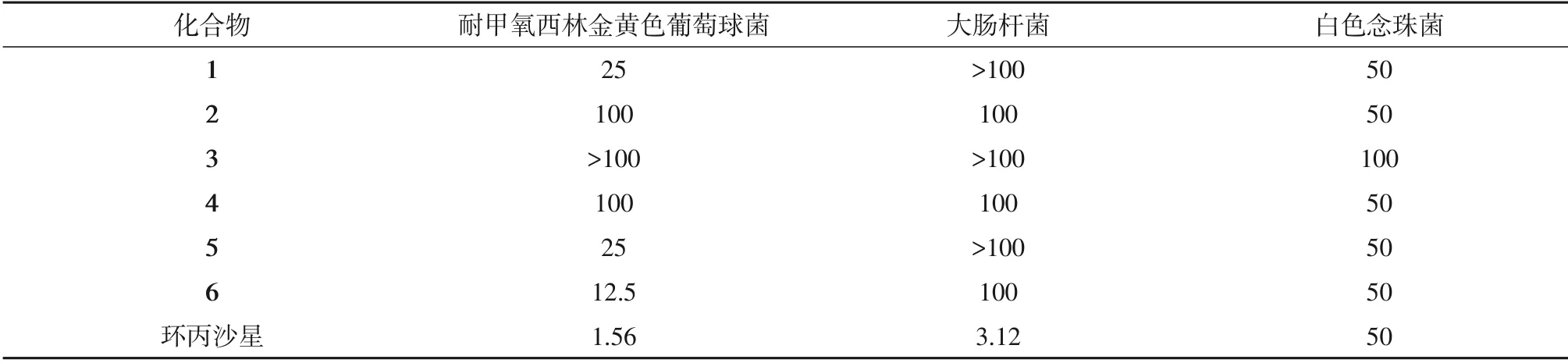
表1 化合物1~6抗菌活性Table 1 Antibacterial activity of compounds 1~6 (μg/mL)
3 结论
本文运用色谱、波谱等技术,从1株南美蟛蜞菊来源内生真菌Aspergillussp.PQJ-1中分离鉴定了6个化合物,包括1个二酮哌嗪类化合物(1),1个吲哚类化合物(2),2个甾体囊素类化合物(5、6),2个其他类化合物(3、4),并对所有化合物进行抗菌活性筛选,化合物1、2、4~6对耐甲氧西林金黄色葡萄球菌、白色念珠菌显示一定抗菌活性。本研究首次对南美蟛蜞菊内生真菌次级代谢产物进行研究,为充分开发利用该入侵植物内生真菌的次级代谢产物提供了科学依据。
