牛乳和驼乳中酪蛋白的差异蛋白组学分析
2022-07-26豆智华杨迎春姚怀兵杨洁
豆智华,杨迎春,姚怀兵,杨洁
(新疆大学生命科学与技术学院新疆生物资源基因工程重点实验室,乌鲁木齐 830046)
0 引言
近年来,人们对驼乳营养价值和保健功能的认知度越来越高,但驼乳产量低、奶源不稳定等因素造成巨大的供需矛盾和悬殊的价格差异,使得驼乳及其乳制品极易遭受掺假。到目前为止,对于驼乳及制品的真实性分析鉴定并没有明确的检测标准。因此,建立准确、快速鉴别驼乳及其乳制品中牛源性成分的检测方法,为保障骆驼产业的健康发展具有重要意义。目前已有多种技术运用于乳蛋白的分析,如毛细管电泳[1]、双向电泳[2]、反向高效液相色谱[3]、质谱[4]及液质联用[5]等,本文主要利用双向电泳技术对牛乳和驼乳中酪蛋白进行差异性分析,并利用质谱(MALDI-TOF/TOF-MS)来对差异性蛋白进行鉴定,并以此为标识物建立驼乳中牛源性成分的检测方法。
1 材料与方法
1.1 材料与试剂
选择新疆乌鲁木齐红雁池的哈族村自然放牧的10峰双峰骆驼乳,现场采集驼乳混匀后用低温保存带回实验室,-20oC中保存备用。牛乳采自新疆农十二师五一农场饲养的奶牛,低温保存带回实验室于-20oC中保存备用。
ImmobilineTMDryStrip pH3-10 NL(13cm),GE公司;IPG Buffer,GE公司;TEMED,Tris-base、SDS、Acr、Bis、硫脲、溴酚蓝、尿素、3-[(3-胆酰胺丙基)-二乙胺]-丙磺酸、二硫苏糖醇、碘乙酰胺、过硫酸铵、甘氨酸(Gly)、低熔点琼脂糖、午睡乙醇、冰醋酸、蛋白质染色试剂盒(SK3011),均购自上海生物工程有限公司;低背景银染试剂盒(BSP027),美国G-Biosciences;CHCA(货号:034K3707),Sigma;乙腈(A酪蛋白)(货号:1499230-935)。三氟乙酸(TFA)(货号:S6002262-009),Merck;Mass Standards Kit for Proteomics Analyzer(货号:43336 04),ABI。
1.2 仪器与设备
HeraeusMultifuge8R离心机,赛默飞世尔科技公司;ALPHA1-2LD真空冷冻干燥机,德国Martin CHRIST公司;MDD-U53V超低温冰箱,日本SANEYO公司;分光光度仪,UV1800,美谱达仪器公司;纯水仪,摩尔公司;超声细胞破碎仪,浙江新芝;SE-600全套电泳设备,GE公司;光密度扫描仪,GE公司;冷却水循环系统,GE公司。
1.3 方法
1.3.1 蛋白提取
取4oC冰箱中解冻的驼乳、牛乳样品100 mL,离心15 min(3 500 r/min),去除上层脂肪(可重复离心两次),得到脱脂乳;再用10%乙酸调pH至4.6,放置4oC冰箱过夜;12 000 r/min离心15 min,去除上层的脂肪,沉淀即为酪蛋白;冷冻干燥备用。利用试剂盒对电泳蛋白样品进行清洁,试剂盒为上海生工的Perfect-FOCUSTM2D试剂(786-124)。
1.3.2 蛋白定量
使用蛋白质浓度测定试剂盒(SK3071,上海生工生物工程股份有限公司)对蛋白样品的蛋白质含量的进行测定。将样品分装为60μg,-80℃保存。
1.3.3 蛋白样品的双向电泳
第一向等电点聚焦(IEF):采用预制IPG(Immobilized pHGradient)干胶条(pH 3~10,13 cm),蛋白上样量为60μg。将蛋白样品与水化液混匀后加入IPG水化盘,将IPG胶条完全放入样品溶液后,20℃左右过夜水化(至少20 h)后进行等电聚焦电泳,设置胶条等电点聚焦(IPGphor)仪器的运行依据。等电点聚焦参数见表1。

表1 等电聚焦电泳参数
第二向SDS-PAGE电泳:等电点聚焦结束后,将胶条分别放在10 mL的平衡液I(含100 mg DTT)和10 mL的平衡液II中(含250 mg碘乙酰胺)分别平衡15 min。平衡结束后,用电极缓冲液润洗1~2 s,进行SDS-PAGE。当溴酚蓝迁移至胶底部0.5 cm处停止电泳,然后进行凝胶染色,每个蛋白样品至少重复3次,用Image MasterTM2D Platinum进行2-DE图谱的分析。
1.3.4 蛋白斑点的脱色
使用ImageMaster(7.0)对于2-DE图谱进行扫描、斑点的检测、匹配和差异蛋白斑点的分析,将差异蛋白斑点从凝胶中扣取1~2 mm2大小的胶块放入Eppendorf管中。用超纯水冲洗胶块,冲洗2~3次,每次10 min。每管加入400μL碳酸氢铵(浓度100 mmol/L)或质量分数30%乙腈进行凝胶块的脱色。脱色结束后A酪蛋白脱水至白色后真空抽干。
1.3.5 MALDI-TOF/TOF-MS质谱分析
将冻干后的酶解样品加入到质量分数20%乙腈复溶,待样品完全溶解后取出1μL加样于样品靶上,使其自然干燥。质谱条件:Nd:YAG激光器光源波长为355 nm,肽指纹图谱质量扫描范围为800~4 000 u,加速电压为2 kV,采集数据,二级质谱激光需激发2 500次,2 kV碰撞能量时关闭CID,按单个样品点8个母离子的原则选择。
1.3.6 数据库检索及生物信息学分析
2-DE图谱用GPS软件进行检索,用MASCOT搜索引擎,在NCBInr 20131103数据库进行检索;用http://www.matrixscience.com/来分析和鉴定蛋白质的等电点和分子量等相关的信息。
2 结果与讨论
2.1 蛋白质的定量
如图1所示,通过图中的线性方程Y=-0.0092x+0.8736来进行蛋白质的定量分析。根据蛋白样品的吸光度值,计算待测样品的质量浓度,驼乳酪蛋白的质量浓度为2.23 g/L,牛乳酪蛋白的质量浓度为8.20 g/L。

图1 蛋白质量浓度定量标准曲线
2.2 驼乳和牛乳中酪蛋白的双向电泳
在相同条件下,利用2-DE技术对牛乳和驼乳中酪蛋白分别进行了分离分析,为提高实验的准确性和可靠性,每个酪蛋白样品至少重复了3次,获得的2-DE图谱具有较好的重复性,可以满足实验的要求。牛乳和驼乳中酪蛋白质的2-DE凝胶图谱如图2所示,驼乳、牛乳酪蛋白的2-DE图谱中蛋白斑点分布大致相同,可以满足比较蛋白质组学差异性分析的实验要求。经扫描成像及Image Master软件分析,在相同条件下进行的重复实验中,牛乳酪蛋白中可检测蛋白质斑点数为512,546,573;驼乳酪蛋白中可检测蛋白质斑点数分别为525,521,631如表2所示。

表2 牛乳和驼乳酪蛋白2-DE凝胶斑点数

图2 牛乳和驼乳中酪蛋白质的2-DE凝胶图谱
2.3 部分差异蛋白斑点的局部分析和表达量化柱状图
由双向电泳结果可知,与牛乳中的酪蛋白相比,驼乳酪蛋白中缺失33个蛋白点,且7个蛋白点显示为低表达,图3为牛乳与驼乳酪蛋白部分差异蛋白斑点的局部放大分析和表达量化图。由图3可知,驼乳和牛乳中酪蛋白的之间确实存在一定的差异性。用软件分析扫描后得到的图像、结合人工分析比对,发现牛乳和驼乳酪蛋白的2-DE凝胶图谱中,能够匹配且表达量比值高于2或低于0.5的差异蛋白斑点有40个。与牛乳酪蛋白相比,驼乳酪蛋白中有7个蛋白斑点表现为低表达,33个蛋白斑点表达缺失,其中10、11、13、16、63、64、127为驼乳中低表达的酪蛋白斑点。
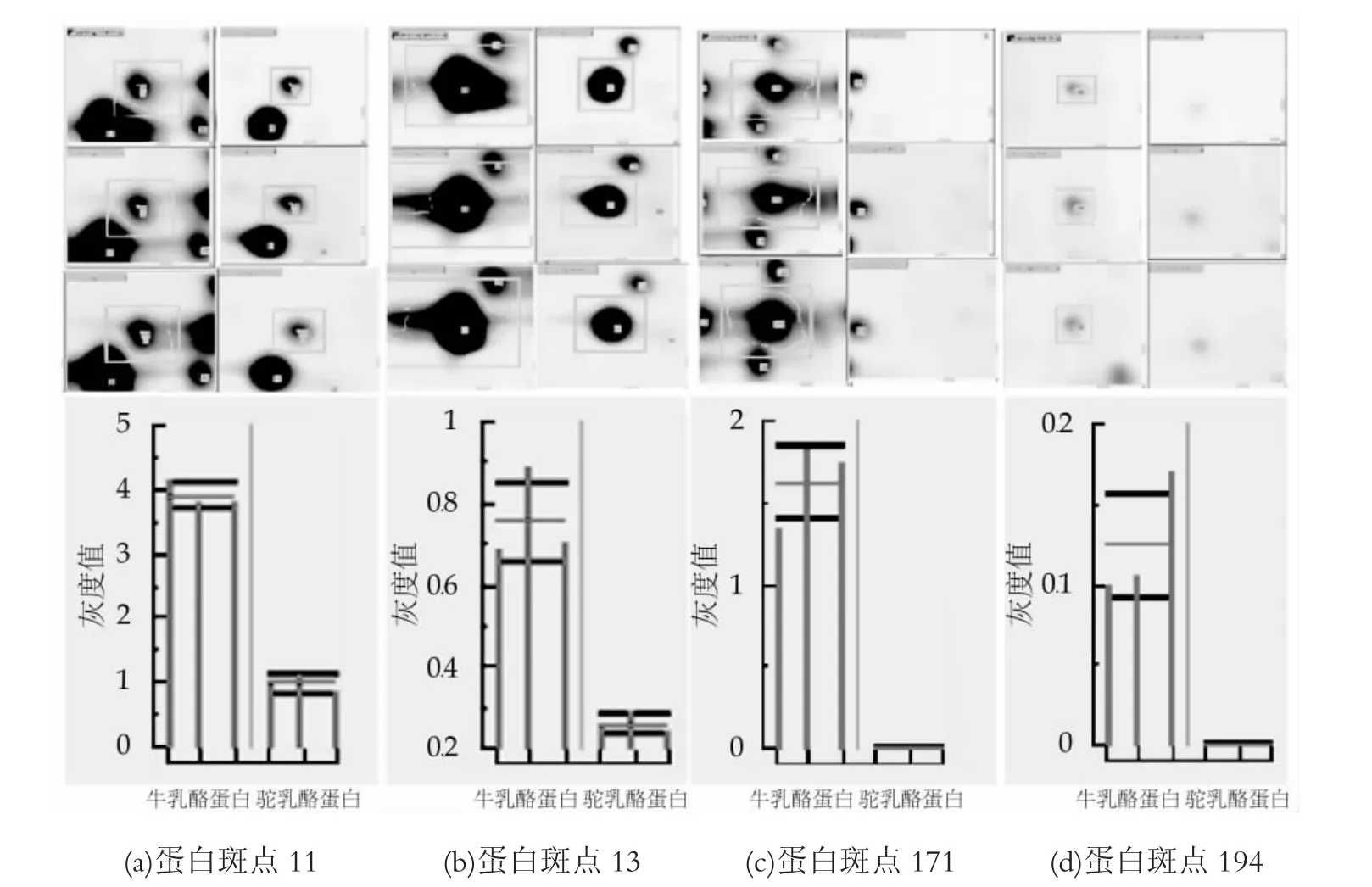
图3 部分差异蛋白斑点局部放大和表达量化
2.4 在驼乳酪蛋白中低表达蛋白质谱鉴定
与牛乳酪蛋白相比,在驼乳酪蛋白中低表达的蛋白斑点(10,11,13,16,63,64,127)进行质谱鉴定,我们成功回收考了马斯亮蓝染色的2-DE图谱中的5个蛋白斑点,经胶内酶解质谱鉴定,人工数据库比对后发现5个蛋白斑点为3种酪蛋白,分别是酪蛋白2、κ-酪蛋白A片段、β-酪蛋白见表3。
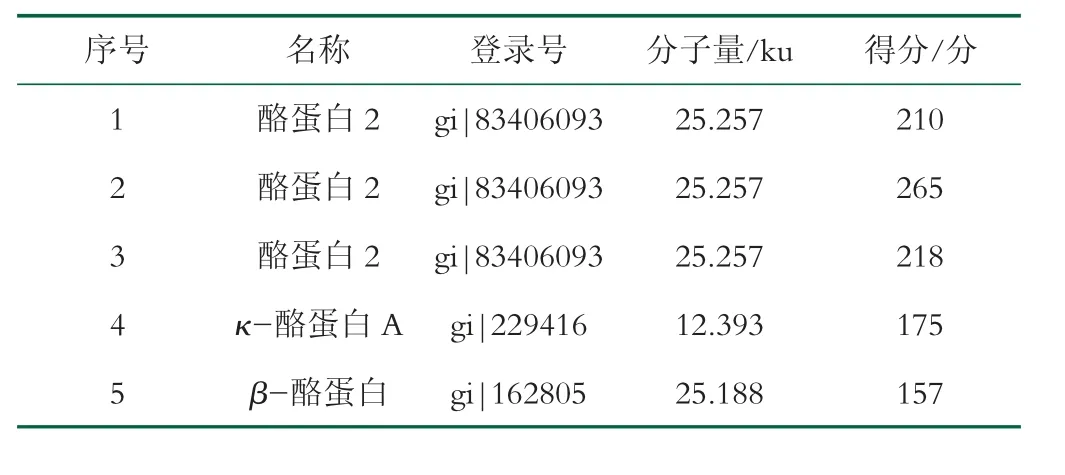
表3 驼乳酪蛋白中低表达酪蛋白斑点的质谱鉴定
3 讨论
文献记载,驼乳中酪蛋白质量分数一般为1.63%~2.76%,一般以β-酪蛋白(65%)和ɑs1-酪蛋白(21%)为主,其中β-酪蛋白质量分数(65%)要高于牛乳(36%),与人乳中β-酪蛋白含量相似[6]。同时与其他物种的乳相比,驼乳中含有丰富的α-乳白蛋白,缺乏β-乳球蛋白,具有与母乳相似的蛋白结构。因此驼乳的消化利用率更高且发生过敏反应的概率更低[7]。驼乳中酪蛋白与牛乳酪蛋白在一级结构上有所差异,但二级结构却极为相似,研究分析这可能与驼乳酪蛋白中具有高脯氨酸的含量有关[8]。Farah和Farah-Riesen等利用电泳技术发现单峰骆驼乳酪蛋白中含有α-酪蛋白和β-酪蛋白,却没有发现与牛乳中κ-酪蛋白相似的蛋白条带[9]。Naima Alim等研究证实阿尔及利亚单峰驼和Targui的单峰驼的驼乳中的驼乳酪蛋白中基本不含有κ-酪蛋白或含量极低[10]。Zhang等对发现内蒙古阿拉善双峰驼乳中含有ɑs1-酪蛋白,ɑs2-酪蛋白、β-酪蛋白,不含有κ-酪蛋白或含有少量的κ-酪蛋白[11]。
目前的研究表明驼乳酪蛋白中的主要生物活性成分为β-酪蛋白,Maryam和刘辰等分别发现驼乳中的酪蛋白和β-酪蛋白在与胃蛋白酶和蛋白酶的混合物水解后显示高ACE抑制活性[12-13]。因此认为骆驼乳中的β-酪蛋白可以作为一种天然的抗高血压和抗氧化的一种新型食物而发挥重要作用。苏德奇等研究发现驼乳酪蛋白和乳清蛋白及其降解产物可以对肝细胞起到一定的保护作用,主要是通过清除超氧化物、羟基自由基、和抑制脂类氧化等的作用来增加细胞内抗氧化的能力[14-15]。
4 结束语
本研究基于驼乳中酪蛋白含量丰富、稳定性高、特异性强,以驼乳和牛乳酪蛋白之间的差异蛋白为为掺假检测标识物,建立驼乳中牛源性成分的检测方法,来满足驼乳及其他乳制品的检测需求。利用酪蛋白检测驼乳中掺假的牛乳这一方法中旨在针对驼乳及乳制品真实性问题,建立准确、快速鉴别驼乳及其乳制品中牛源性成分的检测方法,制订驼乳真实性鉴别的相关标准,解决骆驼产业发展中的“卡脖子”问题,为保障驼乳产品的质量、维护消费者权益、遏制食品安全问题的发生、保障骆驼产业的健康发展具有重要意义。
