脑电图联合MRI在新生儿缺氧缺血性脑病诊断及预后的应用
2022-07-26徐学涛蒋晓宏曾利明任明会
徐学涛,蒋晓宏,曾利明,任明会
安徽医科大学附属巢湖医院儿科,安徽 合肥 238000
前言
新生儿缺氧缺血性脑病(Hypoxic-ischemic Encephalopathy,HIE)是新生儿在围生期因各种因素引起窒息进而引起脑缺氧缺血性损伤。流行病学研究显示新生儿HIE 是世界范围内造成患儿残疾的最大因素[1-2]。在我国,新生儿HIE 发病率达3%~6%[3]。在临床表现方面,由于脑组织对氧的依赖性以及不同患儿窒息程度不同,常导致患儿出现轻重不一的脑功能障碍表现,该疾病也是引起新生儿死亡和癫痫、智力低下等的重要原因之一[4-5]。由于新生儿HIE 临床表现轻重不一,其预后也有不同差异,早期识别和诊断以及预后过程中的评估极其重要[6]。在临床诊断方面,主要依赖患儿Apgar评分、呼吸抑制、肌张力和肌力异常、意识水平降低以及血气分析等手段对患儿窒息和HIE 严重程度进行判断[7]。磁共振成像(MRI)无电离辐射,在成像特点上具有良好的时间和空间分辨率,是诊断新生儿HIE较为敏感的影像学检查方法。动脉自旋标记技术是在无外源性造影剂的情况下以血液中水质子为标记物进行脑灌注标记,能够通过不同脑区的“过度灌注”等表现对新生儿HIE 进行识别和预后诊断[8]。振幅整合脑电图(amplitude-integrated Electroencephalography,aEEG)是一种从脑组织电活动上评价脑功能的方法,常作为HIE 患者脑功能分析和治疗评估的重要指标[9]。本研究拟采用aEEG 联合头颅MRI方法,以期从形态和功能角度对新生儿HIE进行诊断和预后评估。
1 资料与方法
1.1 一般资料
纳入安徽医科大学附属巢湖医院在2020年1月~2021年6月间收治的HIE足月患儿和健康足月新生儿各42 例,按照是否确诊HIE 分为观察组和对照组。观察组男性25 例,女性17 例,平均胎龄(39.1±1.7)周;对照组男性23例,女性19例,平均胎龄(39.4±2.1)周。两组患儿的一般资料无显著性差异,具有可比性。本研究所有患儿及家属经筛查无遗传性疾病、先天发育性疾病等。观察组纳入标准:(1)足月新生儿;(2)符合中华医学会儿科学分会新生儿学组制定的新生儿HIE 诊断标准[10];(3)患儿及患儿家长能够配合完成检查;(4)患儿家长知情同意并签署知情同意书。观察组排除标准:(1)患有新生儿低血糖、新生儿低血钙等;(2)患有神经系统感染性、发育性疾病者;(3)患有遗传代谢性疾病、先天性疾病及有相关家族史患儿。对照组纳入标准:(1)足月新生儿;(2)出生后各项评估为正常健康患儿;(3)患儿家长知情同意并签署知情同意书者。
1.2 检查方法与测量指标
1.2.1 aEEG 采集采用NIHON KOHDEN 脑电图信息采集工作站(日本光电工业株式会社,EEG-1200C)进行数据采集,按照国际标准电极安放系统,选取P3~P4为信号采集点,具体为双顶骨电极两点间距75 mm,两点连线中点位于头顶中央后50 mm,参比电极置于头顶中央前25 mm 的额中线上。所有观察对象均在出生后10~14 h 内完成aEEG 采集与处理。结果以振幅形式的波普带呈现,速度6 cm/h。
1.2.2 aEEG 数据评价标准按照aEEG 分类标准,振幅波谱带上边界>10 μV、下边界>5 μV 为振幅正常;振幅波谱带上边界>10 μV、下边界≤5 μV 为振幅轻度异常;振幅波谱带上边界<10 μV、下边界≤5 μV 为振幅重度异常。伴有痫样活动时,振幅正常者为正常aEEG;振幅轻度异常,或振幅正常伴有痫样放电为轻度异常aEEG;振幅轻度异常伴有痫样放电、振幅重度异常伴或不伴痫样放电为重度异常aEEG。本研究评价诊断性指标时,以正常aEEG 为阳性诊断标准,以所有非正常aEEG为阴性诊断标准。
1.2.3 动脉自旋标记MRI扫描方法MRI患儿在检查前15~20 min 以苯巴比妥5 mg/kg 肌肉注射,待入睡后,取仰卧位,将头部固定于头部线圈内,两侧以海绵垫固定,确保头部两侧解剖结构对称,全程由1 名儿科医生陪同,确保患儿呼吸状态正常。采用飞利浦Ingenia 3.0T 磁共振仪(飞利浦公司,Ingenia)进行扫描。采集线圈为16 通道线圈,扫描序列选择:T1WI,T2WI,DWI,3D-ASL 成像。其中T1WI扫描参数:TR=1 759 ms,TE=24 ms,FOV=16 cm×16 cm,层厚4.0 mm,层间距1.5 mm,翻转角111°,激励1 次;T2WI参数:TR=3 700 ms,TE=95 ms,FOV=16 cm×16 cm,层厚4.0 mm,层间距1.5 mm,翻转角111°,激励1 次;3D-ASL 成像参数:TR=4 372 ms,TE=10 ms,翻 转角111°,FOV=16 cm×16 cm,层 厚4.0 mm,PLD=1 025 ms,激励3次。
1.2.4 动脉自旋标记MRI数据处理以飞利浦工作站进行数据处理。所有测量与阅片工作均由本院影像中心2 名有3年以上工作经验的主治医师完成,测量双基底节区、双侧丘脑、双侧额叶、双侧顶叶的CBF值,ROI大小取(50±2)mm2,CBF 值取两位主治医师的测量均值,对各脑区取双侧脑区测量结果的均值。
1.2.5 预后指标统计对所有纳入研究的患儿随访至出生后6个月,记录其身高、体质量、神经系统发育情况(是否有神经系统发育异常或小儿癫痫等)和存活情况(存活/死亡),以出现生长发育异常、神经系统发育异常和死亡情况中的任意一项或多项评价为预后不良。
1.3 统计学方法
采用Excel 和SPSS20.0 进行数据整理和统计学分析。计量资料以均数±标准差表示,首先判断其是否符合正态分布,行双尾非配对t检验或t'检验。计数资料以n(%)表示,采用卡方检验。P<0.05 表示差异具有统计学意义。
2 结果
2.1 两组新生儿aEEG分度情况
采集到的正常和轻度异常的aEEG 如图1所示。对照组新生儿aEEG 分度均为正常。观察组患儿中,有12 例aEEG 为正常,20 例aEEG 为轻度异常,10 例aEEG 为重度异常。两组患儿aEEG 分度间存在统计学差异(P<0.05)。

图1 两组新生儿aEEG示例图Figure 1 Examples of aEEGs of the neonates in two groups
2.2 两组新生儿MR-ASL扫描结果
两组新生儿头颅MRI扫描结果如图2所示。观察组新生儿在基底节区、丘脑的CBF 值均高于对照组,在额叶的CBF 值低于对照组,差异有统计学意义(P<0.05,表1)。

图2 两组新生儿头颅MRI扫描结果Figure 2 Results of cerebral MRI of the neonates in two groups
表1 两组新生儿MR-ASL扫描的CBF值[±s,mL/(100 g·min)]Table 1 CBF values of the neonatal MR-ASL in the two groups[Mean±SD,mL/(100 g·min)]
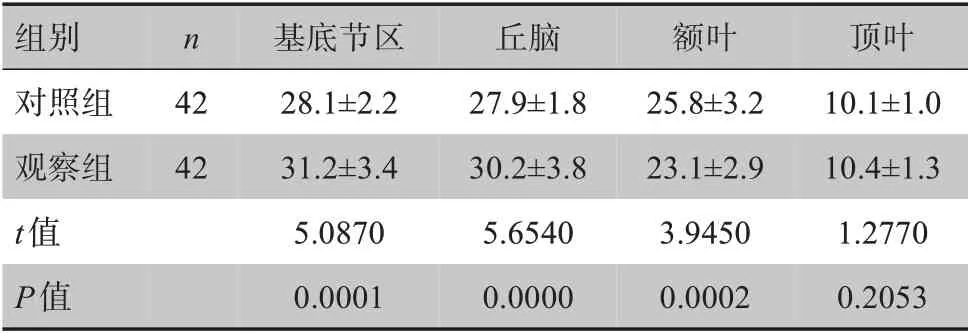
表1 两组新生儿MR-ASL扫描的CBF值[±s,mL/(100 g·min)]Table 1 CBF values of the neonatal MR-ASL in the two groups[Mean±SD,mL/(100 g·min)]
组别对照组观察组t值P值n 额叶25.8±3.2 23.1±2.9 3.9450 0.0002基底节区28.1±2.2 31.2±3.4 5.0870 0.0001丘脑27.9±1.8 30.2±3.8 5.6540 0.0000 42 42顶叶10.1±1.0 10.4±1.3 1.2770 0.2053
2.3 正常aEEG新生儿MR-ASL扫描结果
观察组正常aEEG 新生儿在基底节区、丘脑的CBF值显著高于对照组(P<0.05),两组新生儿在额叶和顶叶CBF值无统计学差异(P>0.05),见表2。
表2 正常aEEG新生儿MR-ASL扫描的CBF值[±s,mL/(100 g·min)]Table 2 CBF values of MR-ASL in neonates with normal aEEG[Mean±SD,mL/(100 g·min)]

表2 正常aEEG新生儿MR-ASL扫描的CBF值[±s,mL/(100 g·min)]Table 2 CBF values of MR-ASL in neonates with normal aEEG[Mean±SD,mL/(100 g·min)]
组别对照组观察组t值P值n 基底节区28.1±2.2 29.1±1.2 2.5780 0.0117 42 12丘脑27.9±1.8 28.8±1.5 2.4930 0.0147额叶25.8±3.2 25.0±3.7 0.9786 0.3306顶叶10.1±1.0 10.2±1.3 0.1550 0.8772
2.4 不同aEEG 分度患儿MR-ASL 扫描的CBF 值与预后关系
在aEEG 正常和轻度异常新生儿中,预后良好与不好患儿间CBF 值存在统计学差异(P<0.05);而在aEEG 重度异常新生儿中,预后良好与不好患儿间CBF值无统计学差异(P>0.05),见表3。
表3 不同aEEG分度患儿MR-ASL扫描的CBF值与预后分析[±s,mL/(100 g·min)]Table 3 MR-ASL CBF values and prognosis in neonates with different aEEG indexes[Mean±SD,mL/(100 g·min)]

表3 不同aEEG分度患儿MR-ASL扫描的CBF值与预后分析[±s,mL/(100 g·min)]Table 3 MR-ASL CBF values and prognosis in neonates with different aEEG indexes[Mean±SD,mL/(100 g·min)]
aEEG分度预后正常26.6±2.3 27.9±2.0 5.1340 0.0001良好不良t值P值轻度异常28.2±2.1 30.0±2.6 3.4520 0.0009重度异常30.1±1.8 30.5±2.9 0.9193 0.3006
3 讨论
新生儿HIE作为一种因窒息引起的脑缺血性疾病,常常由于缺血缺氧引起脑急性或慢性障碍,产生一系列近期或远期并发症[11-12]。早期诊断和干预对减少脑损伤和近、远期并发症的发生,改善患儿预后有重要作用[13]。在早期诊断中,主要通过Apgar评分初步判断窒息情况,通过临床表现等进行诊断[10]。本研究探讨aEEG与MRI在新生儿HIE诊断和预后中的应用价值。
放电是神经细胞执行功能的基础,神经网络的放电异常(如兴奋/抑制比异常、震荡周期异常等)常常标志着神经细胞功能的损伤[14-15]。本研究结果显示HIE患儿aEEG异常比例显著高于正常足月新生儿,提示缺氧缺血引起脑功能急性异常改变。相较于CT和MRI等影像学检查,脑电活动的异常出现时间更早,表明aEEG可作为早期明确HIE较为敏感的指标[16-17]。除功能性指标外,脑灌注水平也是早期诊断HIE的重要标志。本研究结果显示相较于对照组,观察组患儿在基底节区和丘脑区呈高灌注状态,而在额叶呈低灌注状态。有研究显示新生儿窒息伴发HIE常出现皮层下区域(丘脑、基底节区)异常的高灌注状态,而这一状态与不成熟状态下丘脑、基底节等区域神经元代谢水平显著高于正常组织、从而出现损伤后的高灌注状态有关[18]。额叶等区域的低灌注可能与额叶皮层等区域血供尚未完全恢复、较皮层下脑区呈低代谢状态有关[19]。在aEEG结果分析中,我们发现观察组患儿仍存在aEEG正常的情况,提示单独依靠aEEG不足以界定HIE的诊断。因此,本研究进一步分析两组新生儿正常aEEG组中脑灌注水平。结果显示与对照组相比,观察组患儿呈现丘脑、基底节区高灌注状态和额叶的低灌注状态,差异具有统计意义(P<0.05),这一结果提示脑MR-ASL扫描可能作为aEEG评估新生儿HIE的有效补充。由于HIE造成特异性脑区功能的损伤,常导致一系列近期或远期并发症。既往研究显示,常见并发症包括癫痫、神经功能异常、生长发育异常,严重者甚至导致患儿死亡[20-21]。早期预测不良预后的发生并给予及时干预能够有效降低并发症所带来的的损伤[22]。本研究结果显示,在aEEG分度为正常和轻度异常时,不同预后间的患儿CBF值存在显著性差异(P<0.05),提示aEEG联合脑MR-ASL扫描能够有效预测不良预后的发生,为早期干预提供依据。有研究结果显示脑组织缺氧缺血性损伤后异常的高灌注可能加重局部组织缺血-再灌注损伤程度,阻碍皮层新生血管的生长[23],这可能是高灌注与不良预后的病理生理学基础。
综上所述,aEEG联合头颅MRI能够显著提高新生儿HIE诊断的敏感性和对不良预后的预测效果,其神经生物学机制和诊断效能还有待进一步研究。
