血清HDAC3、HMGB⁃1 与非瓣膜性心房颤动的相关性研究
2022-07-26孙传奇姚卓亚康品方高大胜
孙传奇,姚卓亚,高 琦,徐 宁,康品方,高大胜
(蚌埠医学院第一附属医院心内科,安徽蚌埠 233000)
心房颤动(atrial fibrillation,AF)是以心房电活动紊乱继而导致心房机械功能减退为特征的一种快速心律失常,其患病率逐年升高,随着房颤持续时间的延长可导致不同程度的心力衰竭及血栓栓塞[1]。研究表明,非瓣膜病性房颤病人脑卒中发生率是正常人的4~5 倍[2-4]。但目前对于房颤的临床治疗仍是难点,其主要原因在于房颤发生的机制尚不甚明了,因此寻找能够影响房颤发生以及促进其进展的相关指标,不仅能促进对房颤发病机制的理解,还可能为以后的治疗提供新思路。
组蛋白去乙酰化酶3(HDAC3)属于第I 类组蛋白去乙酰化酶,通过去乙酰化修饰影响心肌细胞收缩、促进心肌肥厚、纤维化、自噬及凋亡,在心血管疾病的发生、发展过程中发挥着重要的调控作用[5-11]。研究证实,HDAC3 与维持心肌细胞电位稳定及能量代谢有关,其表达异常可能会导致心肌结构及功能的异常[12-15];高迁移率蛋白B1(HMGB-1)是一种结构上的非组蛋白染色质结合蛋白,参与调节转录、DNA 复制和修复等,细胞外HMGB-1 由坏死组织被动释放或应激细胞主动分泌[16-19]。研究证明HMGB-1 能降低心肌细胞收缩力、诱导心肌肥大、凋亡及促进心肌纤维化的形成[20-26]。鉴于上述机制,我们推测两者与心房颤动的发生及心肌重构相关。目前国内外对此报道较少,因此本文旨在探讨血清HDAC3 及HMGB-1 与非瓣膜性房颤的发生、发展及结构重构的相关性,以明确HDAC3 与HMGB1 在房颤发生中的作用。
1 资料与方法
1.1 一般资料
选取本院2019 年9 月~2020 年12 月收住入院,行24 h 动态心电图确诊心房颤动病人166 例为实验组。按照欧洲心脏病学会(European Society of Car⁃diology,ESC)制定的非瓣膜性心房颤动及其分型诊断标准[27],分为阵发性房颤组(阵发组,n=42)、持续性房颤组(持续组,n=63)、永久性房颤组(永久组,n=61)。选取本院同期体检健康窦性心律者50 例为对照组。
1.2 排除标准
(1)先天性心病、风湿性心脏病以及其他相关原因导致的心脏瓣膜异常(钙化、手术等);(2)各种类型的心肌病、肺源性心脏病;(3)心力衰竭(NTproBNP>125 ng/L);(4)合并严重感染、创伤、自身免疫性疾病;(5)近期3 个月内曾行手术者;(6)合并恶性肿瘤;(7)合并严重贫血营养不良等。
1.3 方法
采集入组患者静脉血5 mL,进行离心制备血清,并保存于−80°C 冰柜中。采购ELISA 试剂盒(上海羽朵),按照说明书测定HDAC3、HMGB-1 两者浓度。其它一般基础资料及心脏彩超由我院检验科和彩超室测定。
1.4 统计学处理
采用SPSS25.0 统计软件分析采集资料,计量资料正态分布以(±s)表示、非正态分布以M(P25,P75)表示,计数资料以百分构成比表示。组间比较选择t检验、秩和检验、卡方检验;相关性选择Pear⁃son 相关分析;采用多因素二元Logistic 回归探讨影响房颤发生的独立危险因素,P<0.05 为差异有统计学意义。
2 结果
2.1 实验组与对照组各临床资料对比
在年龄、性别、高血压、糖尿病、血常规、肝肾功能、血脂、CRP、EF%、NT-proBNP 等方面两组未见明显差异(P>0.05)。与对照组相比,房颤组在HDAC3、HMGB-1、LAD、LVEDD 的水平均显著升高;差异有统计学意义(P<0.05)。见表1。
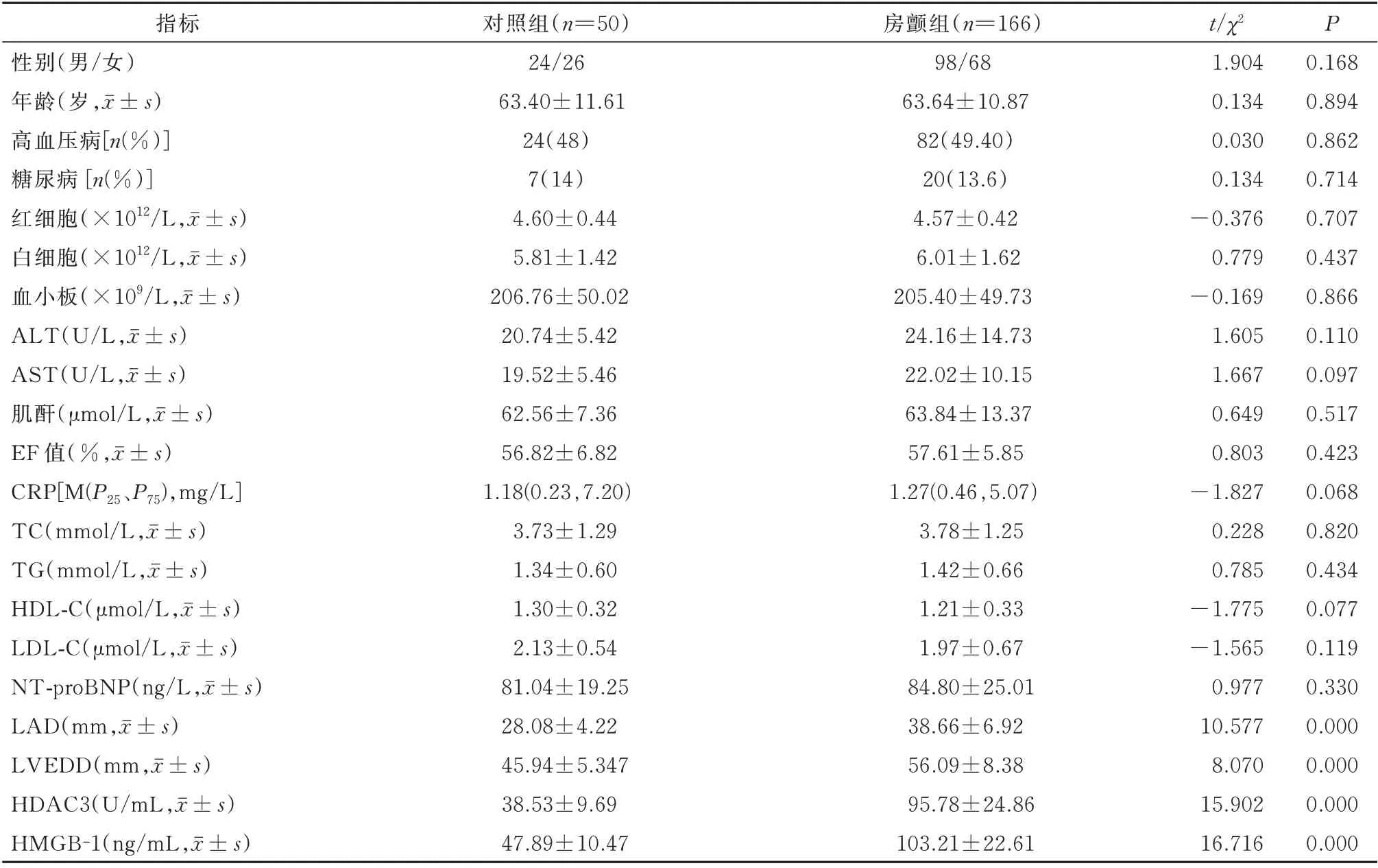
表1 两组临床资料对比Tab 1 Comparison of each clinical data between the control and AF groups
2.2 不同类型的房颤患者HDAC3、HMGB-1、LAD、LVEDD 水平对比
通过对不同类型的房颤患者HDAC3、HMGB-1、LAD、LVEDD 水平对比发现:永久组较持续组、阵发组HDAC3、HGMB-1、LAD、LVEDD 水平显著升高(P<0.05),且持续组较阵发组上述指标亦显著升高(P<0.05)。见表2。
表2 不同类型房颤患者HDAC3、HMGB⁃1、LAD、LVEDD 比较(±s)Tab 2 HDAC3,HMGB⁃1,LAD,LVEDD comparison among the experimental groups(±s)
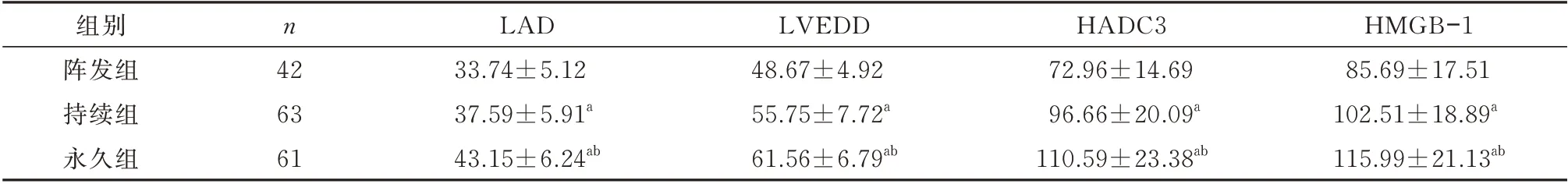
表2 不同类型房颤患者HDAC3、HMGB⁃1、LAD、LVEDD 比较(±s)Tab 2 HDAC3,HMGB⁃1,LAD,LVEDD comparison among the experimental groups(±s)
注:与阵发组比较,aP<0.05;与持续组比较,bP<0.05。
HMGB-1 85.69±17.51 102.51±18.89a 115.99±21.13ab组别阵发组持续组永久组n 42 63 61 LAD 33.74±5.12 37.59±5.91a 43.15±6.24ab LVEDD 48.67±4.92 55.75±7.72a 61.56±6.79ab HADC3 72.96±14.69 96.66±20.09a 110.59±23.38ab
2.3 房颤组HDAC3、HMGB-1、LAD 及LVEDD 间相关性分析
Pearson 相关分析显示,房颤组中HDAC3 水平与 HMGB-1 呈正相关(r=0.757,P=0.001);HDAC3 水 平 与 LAD(r=0.635,P=0.000)、LVEDD(r=0.651,P=0.000)呈正相关;HMGB-1水平与LAD(r=0.658,P=0.002)、LVEDD(r=0.569,P=0.000)亦呈正相关。见表3。

表3 实验组HDAC3、HMGB⁃1、LAD、LVEDD 相关性分析Tab 3 HDAC3,HMGB⁃1,LAD,LVEDD correlation analy⁃sis of the experimental groups
2.4 心房颤动有关危险因素二元Logistic回归分析
对所有入组患者,以是否发生房颤为因变量,以表1 中存在差异的变量(HDAC3、HMGB-1、LAD、LVEDD)为协变量,应用二元Logistic 回归分析,显示HDAC3(OR=1.712,95%CI:1.070~2.739,P<0.05)、HMGB-1(OR=1.287,95%CI:1.008~1.634,P<0.05) 、 LAD (OR=1.709,95%CI:1.095~2.666,P<0.05)是心房颤动发生的独立危险因素。见表4。
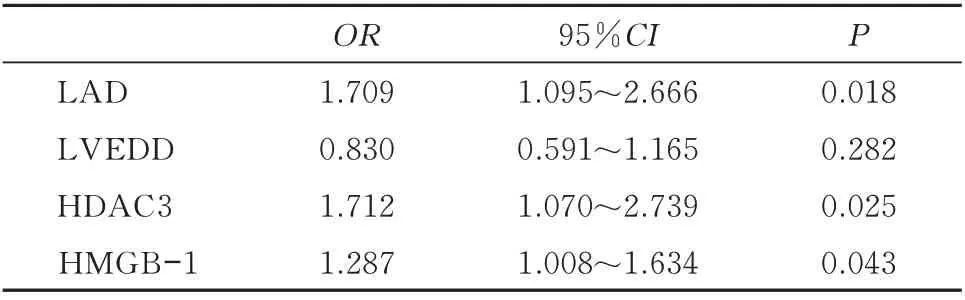
表4 心房颤动的多因素二元Logistic 回归分析Table 4 Multivariate binary Logistic regression analysis of atrial fibrillation
3 讨论
房颤作为临床上最常见的心律失常,其患病率与发病率逐年升高,因可导致缺血性卒中、体循环动脉栓塞、心力衰竭等危害,严重威胁人类健康[1]。鉴于对房颤发病机制不甚明了,目前房颤临床治疗存在诸多难点。电重构及结构重构目前认为是其发生、发展的重要病理基础,凡是能影响以上任何一个环节都能为房颤的发生提供病理基础,两者可以相互加重形成恶性循环最终导致疾病的进展[28]。早期电重构目前可以通过射频消融等方法得到改善,但结构重构目前尚无有效的治疗方法,这也为术后复发以及治疗上带来困难,因此积极寻找能够影响房颤发生以及促进其进展的相关指标尤为重要。
HDAC3 属于第I 类组蛋白去乙酰化酶,近来大量文献报道HDAC3 与心血管疾病的发生、发展密切相关,其通过去乙酰化修饰影响心肌细胞功能及能量代谢,是心血管疾病的重要调控因子[8-11]。研究发现肌动蛋白和肌纤维蛋白均是HDAC3 诱导的去乙酰化的底物,HDAC3 能够调节肌球蛋白重链脱乙酰化,使心肌收缩性能恶化,进而导致心肌细胞肥大结构重构;HDAC3 可直接与心肌细胞中肌动蛋白结合蛋白(CapZβ1)及肌原纤维相互作用,直接诱导心肌肥大,与心力衰竭的发生密切相关[29]。有研究发现,HDAC3 参与了钠钙交换器(Sodium calcium exchanger,NCX)的调节,与维持心肌细胞及心肌线粒体内外Ca2+平衡有关,HDAC3 过表达可使心肌内Ca2+浓度过载,进而影响心肌正常的电位活动及线粒体功能[13-15];另外HDAC3 已经证实参与心肌代谢重塑方面的调节,通过与Krüppel 样因子(KLF5)的相互作用来调节心肌脂肪酸代谢。KLF5 是过氧化物酶激活受体α(PPAR-α)心脏能量学的转录调节因子,HDAC3 的过表达抑制了KLF5依赖的内源性下游脂肪酸代谢相关基因的激活,从而导致脂肪酸摄取、脂肪酸氧化和电子传递/氧化磷酸化障碍,最终导致心肌心肌能量供应障碍、重构以及纤维化的发生[30]。本实验发现HDAC3 在房颤组中明显高于对照组,这提示HDAC3 的过度表达与房颤的发生可能相关;其内在原因可能是HDAC3 的过度表达干扰了心肌细胞内的钙离子平衡及能量代谢,使与之有关的心肌细胞电活动及结构发生异常,为房颤的发生提供病理学基础。另外,在不同类型的房颤组对比中,发现随着房颤疾病的进展HDAC3、LAD、LVEDD 水平逐渐增高且HDAC3 与LAD、LVEDD 呈正相关,这与国内外研究结果相符,表明HDAC3 可能通过介导房颤患者结构重构参与房颤疾病的进展。有研究显示,HDAC3 可通过抑制细胞周期依赖性蛋白激酶抑制物(Cdkn1a、Cdkn2a、Cdkn1b)促进心肌细胞增殖肥大,导致心肌重构[31]。
HMGB-1 是一种非组蛋白的核蛋白,细胞内外皆可存在。细胞外的HMGB-1 主要由坏死组织被动释放或应激细胞主动分泌,具有炎症因子的活性,可与不同的受体结合发挥促炎作用[16]。其主要受体有包括Toll 样受体(toll-like receptors,TLR)以及晚期糖氨化末端产物受体(receptor for advanced glycation end products,RAGE)等[17,18]。HMGB-1 与TLR-2 结合并激活α-平滑肌肌动蛋白(SMA)、下游有丝分裂原激活蛋白激酶(mitogen-activated pro⁃tein kinase,MAPK)、转化生长因子-β(TGF-β)和胶原蛋白(I 型和Ⅲ型),参与调节心肌成纤维细胞的增殖及活性,最终导致心肌细胞炎症和纤维化[32]。此外,HMGB-1 与RAGE 结合进而激活核因子κB(nuclear factor kappa-B,NF-κB)信号传导途径,可导致心肌细胞炎症、纤维化和心脏功能障碍[33-35]。HMGB-1 与受体TLR-4 结合增加了细胞凋亡蛋白和caspase-3 的表达,并减少了抗纤维化/抗炎细胞因子IL-33,致使心肌细胞凋亡及纤维化等形成[20]。本研究中房颤病人HMGB-1 水平明显高于对照组,说明HMGB-1 水平升高与房颤的发生可能存在一定的相关性;不同类型的房颤组比较,随着房颤疾病的进展其水平依次上升,这提示HMGB-1 与房颤疾病的发展可能相关。 且HMGB-1 与LAD、LVEDD 呈正相关,提示HMGB1 可能与房颤心肌结构重构有关,这与国内外研究结果相符,其内在原因可能是HMGB-1 作为细胞外炎症因子通过与其TLR、RAGA 等受体结合诱导心肌产生炎症、促进心肌纤维化及诱导心肌凋亡等,最终引起心肌细胞在组织结构及超微观结构等方面的异常,继而引起心肌细胞电重构或结构重构,为房颤的发生和进展提供了病理基础。此外,本实验发现HDAC3 与HMGB-1 两者血清浓度存在正相关,表明两者在心房颤动的发生及发展中存在协同作用,这可能与两者调节细胞凋亡有关,有研究证明HDAC3 通过调节HMGB-1 的释放,抑制凋亡相关通路[36]。最后行二元Logistic 回归分析显示HDAC3、HMGB-1、LAD 是心房颤动发生的独立危险因素,可作为预测心房颤动发生的影响因子。
综上所述,检测HDAC3、HMGB-1 两种因子对于探究心房颤动发病机制及疾病进展具有很大帮助,可能为今后房颤的临床治疗及改善预后提供一种新的方向。另外,本实验在得出以上研究结果之外,存在以下缺陷及思考,本次研究中收集的病例样本数有限,仍需要足量样本来验证;本研究属于回顾性研究,无法对同一个体进行连续性检测其病程节点中各个时期的HDAC3、HMGB-1 的数值,因此有待于进一步完善前瞻性临床试验研究。
作者贡献度说明:
高大胜、康品方:负责提出研究选题、设计研究方案、提供研究经费、指导性支持;孙传奇、徐宁、高琦:负责实施研究过程、采集整理数据;孙传奇:负责整理文献、设计论文框架、起草论文;高大胜、康品方、孙传奇、姚卓亚:修订论文、终审论文。
本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
