p38MAPK信号通路诱发糖尿病肾病的研究进展
2022-07-25卢奇奇余超汪志平
卢奇奇 余超 汪志平
(浙江大学原子核农业科学研究所 农业农村部核农学重点开放实验室,浙江 杭州 310058)
据世界卫生组织预测,2025年全球糖尿病患者将增至3亿人,其中75%将分布在中国、印度等发展中国家。糖尿病肾病(DN)作为糖尿病的最常见并发症,已成为引起老年人慢性肾衰竭的重要病因之一〔1,2〕。DN占终末期肾衰竭患者的比例在美国居第一位、在欧洲居第二位,在我国也已上升至15%〔1~3〕。DN病理上表现为细胞外基质(ECM)积聚、基底膜增厚、肾小球肥大和硬化、肾间质纤维化等。DN的发病机制十分复杂,至今尚未能全面解析,但众多研究与临床实践已表明,持续高血糖状态引起的代谢紊乱是DN发生的最主要诱因〔1,3〕。DN的发生涉及多样而复杂的细胞信号通路系统,如p38丝裂原活化蛋白激酶(p38MAPK)信号转导通路、c-Jun氨基末端激酶(JNK)、Wnt/β-连环蛋白、转化生长因子β/Smad蛋白(TGF-β/Smad)、磷脂酰肌醇3激酶/蛋白激酶β(PI3K/Akt)信号通路等。控制血糖是预防与治疗DN的基础〔1,2〕。桑叶、绞股蓝、黄芪、人参、地骨皮、黄连等中草药具有良好的降血糖功效〔4〕,且在控制血糖方面表现出多功能、多靶点、低毒副作用、安全可靠、作用温和持久等独特优势,能有效减缓DN的发生〔5〕。本文综述了基于p38MAPK信号通路介导DN发生的细胞分子生物学机制,并概述了20余味中草药通过干预p38MAPK信号通路减缓DN发生的研究进展。
1 p38MAPK信号转导通路
1.1p38MAPK信号通路 MAPK是一系列丝氨酸-苏氨酸蛋白激酶家族,主要包括p38MAPK、细胞外信号调节蛋白激酶(ERK)、应激活化蛋白激酶(SAPK)。MAPK信号通路的基本组成是经典的三级酶促级联反应,包括促分裂原活化蛋白激酶激酶激酶(MAPKKK)、促分裂原活化蛋白激酶(MAPKK)和MAPK,这3种激酶能依次激活,使靶蛋白磷酸化并活化,激活下游信号通路,共同调节着细胞增殖、分化、凋亡、炎症反应等多种重要的生理病理过程〔6〕。
p38MAPK是MAPKs家族的重要成员,由Brewster等〔7〕于1993年首次发现。p38由360个氨基酸残基组成,分子量为38 kD〔8〕。p38有α、β、γ、δ 4种亚型,其中p38α和p38β又各含2种异构体。Goedert等〔9〕发现p38α几乎分布于所有的细胞和组织;p38β主要分布于大脑;p38γ主要分布于骨骼肌;p38δ主要分布于内分泌腺;组织表达特异性及其结构的差异性决定了不同亚型的p38拥有不同的结合底物。p38MAPK在肾脏细胞的分布情况研究中,Sakai等〔10〕发现其分布在肾小管的上皮细胞、系膜细胞、内皮细胞和足细胞中。Omori等〔11〕研究发现p38MAPK在肾脏发育早期呈高表达,而在肾脏发育成熟期表达显著减少,早期时p38MAPK主要在输尿管芽细胞与肾脏芽细胞中丰富表达,肾小球中表达微弱。成熟期时其仅在肾小球脏层上皮、集合管和远端肾小管表达。
1.2p38MAPK信号通路的活化 高血糖、晚期糖基化终产物(AGEs)、活性氧(ROS)、炎症因子、细胞张力、TGF-β1、血管紧张素Ⅱ、内皮素-1等多种外界刺激因子可以刺激p38MAPK的活化。p38MAPK的激活也是经典的三级酶促级联反应,MAPK活化后,催化MAPK活化环内的两个苏氨酸或丝氨酸磷酸化,随即MAPK催化靶向MAPK保守区T-X-Y模块内的酪氨酸和苏氨酸残基同时磷酸化,最后MAPK将下游底物如磷脂酶A2、细胞周期素D1、细胞周期蛋白依赖性激酶抑制物、转录因子、CCAAT/增强子结合蛋白同源蛋白,p53和肌细胞增强因子2A等磷酸化〔12,13〕,激活相关信号通路,将细胞外刺激信号传递至细胞核,影响细胞的生长、分化、凋亡等〔14〕。
2 p38MAPK信号通路与DN
p38MAPK在DN发生发展过程中起着重要作用,通过激活不同下游因子影响着肾细胞的功能,主要有促进炎症因子的产生,介导炎症反应的发生,引起肾组织炎症损伤;调节基因的表达来促进CECM合成或者抑制ECM降解,导致肾系基底膜增厚,肾间质纤维化;调控细胞周期蛋白的表达以促进细胞增殖,引起肾体积肥大,肾小球硬化等〔6〕。
2.1p38MAPK影响核因子(NF)-κB 炎症是导致DN的重要机制,p38MAPK信号通路是DN发病机制中参与并激活巨噬细胞,发动组织炎症反应的重要途径〔15〕。DN发生时有大量的炎性细胞如巨噬细胞、单核细胞等和促炎细胞因子如白细胞介素(IL)-1、IL-6、肿瘤坏死因子(TNF)-α、干扰素(IFN)-γ等产生,Eizirik等〔16〕认为这些炎性细胞和促炎细胞因子在p38MAPK-NF-κB介导的促炎症反应和细胞凋亡途径中作用显著。
NF-κB是许多信号通路和基因表达途径的转录因子。NF-κB家族蛋白可分为RelA、RelB、C-Rel、P52和P50五种,主要以二聚体形式存在,其中P52和P50各自的二聚体作为一种抑制分子,在细胞内一般各自以P100、P105的前体形式存在〔15〕。NF-κB发挥生物学活性的主要种类是RelA、P50。一般情况下,NF-κB存在于细胞质中,与其抑制蛋白(I-κB)结合并以三聚体形式存在,呈现不活跃状态。NF-κB家族主要参与促使炎症细胞因子的产生、激活细胞炎症反应的发生,从而引起肾小球损伤并硬化等〔17〕。
如图1通路1所示,高血糖、AGEs、ROS、细胞因子等外界因素可以刺激p38MAPK的活化。活化的p38MAPK激活NF-κB二聚体,然后NF-κB易位进入细胞核,与DNA上的κB位点结合,转录酶启动基因表达程序,调节炎性因子的表达〔18〕。NF-κB会上调炎症因子如IFN-γ诱导蛋白(IP)-10和IL-15等的表达,并将单核-巨噬细胞等吸引到炎症部位诱发组织炎症。张晓雪等〔19〕研究发现高血糖可以促进p38MAPK磷酸化,进而促进肾小球内皮细胞表达并分泌 IL-6 、TNF-α,酶联免疫吸附试验(ELISA)显示,与对照组相比,20.0 mmol/L及40.0 mmol/L高糖组的肾小球内皮细胞分泌的炎性因子 IL-6 及TNF-α显著增加(均P<0.05),且40.0 mmol/L 高糖组效果更显著。余学清等〔20〕发现采用脂多糖(LPS) 可以刺激肾系膜细胞 p38MAPK的磷酸化,p38MAPK 在被LPS刺激 5 min 后活性逐渐升高,30 min达到活性高峰,且炎症因子IL-1β 在 3 h 后 的mRNA及蛋白表达水平显著升高。p38MAPK-NF-κB途径会产生大量炎症因子损坏肾组织,同时这些炎症因子又反激活p38MAPK,再一次促进炎症途径的发生以产生大量炎症因子,使炎症信号不断被放大、积累,恶性循环地加重肾组织炎症损伤〔21〕。
炎症引起DN的过程中,除了炎性因子IL-6 及TNF-α等作用外,单核细胞趋化蛋白(MCP)-1和骨桥蛋白(OPN)也起到了不可忽视的作用,这两种介质主要通过诱导单核-巨噬细胞浸润肾组织,促进炎症的发生。张宁〔22〕研究发现,p38MAPK-NF-κB通路可以直接上调OPN mRNA 、MCP-1 mRNA 的转录表达,进而促进炎症反应扩散。此外,p38MAPK诱导NF-κB进入细胞核后,还可以促使诱导型一氧化氮合酶(iNOS)基因的表达,促进一氧化氮(NO)的生成,导致细胞损伤甚至凋亡〔23〕。
2.2p38MAPK与TGF-β1 DN发生过程中的另一个显著特征是ECM蛋白如胶原蛋白和纤维连接蛋白(FN)等的形成。高血糖等因素可以刺激肾小球系膜基质中FN和胶原蛋白在系膜和肾小管间质中的过度生成与积累,这会导致上皮细胞向成纤维细胞转变,最终细胞纤维化〔24〕。TGF-β1参与调控ECM合成〔25,26〕,促进肾小球硬化和肾间质纤维化,从而加速糖尿病进程,大量的体外研究表明TGF-β1是最强的促纤维化关键细胞因子。哺乳动物中TGF-β有TGF-β1、TGF-β2、TGF-β3三种亚型,其中TGF-β1最为常见,且在肾间质纤维化中具有重要作用。TGF-β1诱导FN、Ⅰ、Ⅲ、Ⅳ型胶原等ECM的合成,同时抑制其降解,是诱导肾间质纤维化发生的重要原因之一。
Jiang等〔27〕已证实TGF-β1是p38MAPK的上游调节因子。一般情况下,TGF-β1 蛋白N端的二聚体潜在相关肽(LAP)以非共价形式与C端的二聚体成熟型TGF-β1相连,再与TGF-β1 结合蛋白(LTBP)相结合并以非活性状态存在。当受到高糖、氧化应激等刺激时,TGF-β1经蛋白酶切去N-末端的相关肽,复合物瓦解并释放具有生物活性的TGF-β1〔28〕,活化的TGF-β1与受体TβRⅠ、TβRⅡ型结合形成TβRⅡ-TGF-β1-TβRⅠ三聚体复合物,进而发挥生物活性。在建立的DN小鼠模型中,发现血糖值与TGF-β1呈正相关关系〔29〕。一方面,如图1通路2所示,由高血糖、氧化应激激活的TGF-β1-p38MAPK信号通路可进一步上调FN的表达〔30,31〕。在FN基因启动子的核苷酸位置-170处有一个磷酸化环腺苷单磷酸反应元件(CRE)调控元件,被TGF-β1激活的p38MAPK CRE结合蛋白(CREB)〔32,33〕,磷酸化的CREB再进入细胞核与CRE相互作用,增强FN mRNA的表达,最终导致系膜细胞产生大量FN,FN是ECM的重要组成部分,主要位于肾小球系膜基质、肾小球基底膜及其与肾小球细胞的连接处,FN的增加会引起肾系基底膜的增厚,使肾小球硬化,严重则会导致肾间质纤维化,加速DN发展。p38MAPK 与TGF-β1的作用是相互的,TGF-β1可以激活p38MAPK发挥其作用,p38MAPK也可以影响TGF-β1的生成,进一步影响DN的进程〔34〕。另一方面,活化的TGF-β1通过激活p38MAPK信号通路〔28〕,还能引起下游NF-κB活化,调节基因表达,促使大量炎症因子的生成,如IL-1、IL-6、IL-8、IL-10、TNF-α等,造成肾脏足细胞损伤与凋亡。
2.3p38MAPK影响早期生长反应蛋白(Egr)1 肾小球系膜细胞是肾脏细胞中的主要类型之一,高糖、血管紧张素Ⅱ和细胞因子等因素可以刺激系膜细胞的增殖。系膜细胞增殖是DN发生早期病理生理机制的重要诱因,最终会导致患者机体慢性肾衰竭〔35〕。因此,抑制系膜细胞增殖被认为是预防和改善DN的途径之一。
Egr1是属于锌指家族的转录因子,参与了多种重要的病理生理基因的激活〔36〕。Egr1在高糖诱导的系膜细胞增殖、肾纤维化及肾小球硬化中起关键作用〔37,38〕。Egr1表达受p38MAPK的激活调控〔36,39〕。
如图1通路3所示,溶血磷脂酸(LPA)可通过激活p38MAPK增加系膜细胞中Egr1的表达,活化的Egr1随即进入细胞核与细胞增殖相关的启动子Kruppel样因子(KLF)5上的专一位点结合〔36,40〕。KLF5可以直接调控p27Kip1 mRNA水平〔41,42〕,p27Kip1为细胞周期素依赖性蛋白激酶抑制因子,在调控细胞周期中具有重要作用。Liu等〔43〕发现在高糖刺激的DN大鼠模型的系膜细胞中检测到p27Kip1表达下调。此外经过增强p27Kip1表达的药物处理的系膜细胞中表现出较强的抗增殖活性〔44,45〕。正常生理状态下,周期蛋白(Cyclin)D1-细胞周期蛋白依赖性激酶(CDK)4复合物往往与p27Kip1紧密结合,处于非活性状态,抑制细胞的分裂与增殖〔46,47〕。CyclinD1与CDK4参与了G1/S期细胞增殖的调控机制,它们的过度表达会促进细胞的分裂与增殖〔48〕。Kim等〔40〕研究发现,经LPA处理的DN小鼠系膜细胞和肾脏皮质中KLF5 mRNA及其蛋白表达水平均升高;KLF5表达下调可增加p27Kip1的表达,进而抑制LPA引起的系膜细胞增殖作用;KLF5可直接降低p27Kip1的表达,上调CyclinD1与CDK4的表达,进而导致系膜细胞过度增殖,肾小球硬化,加速DN病理进程。
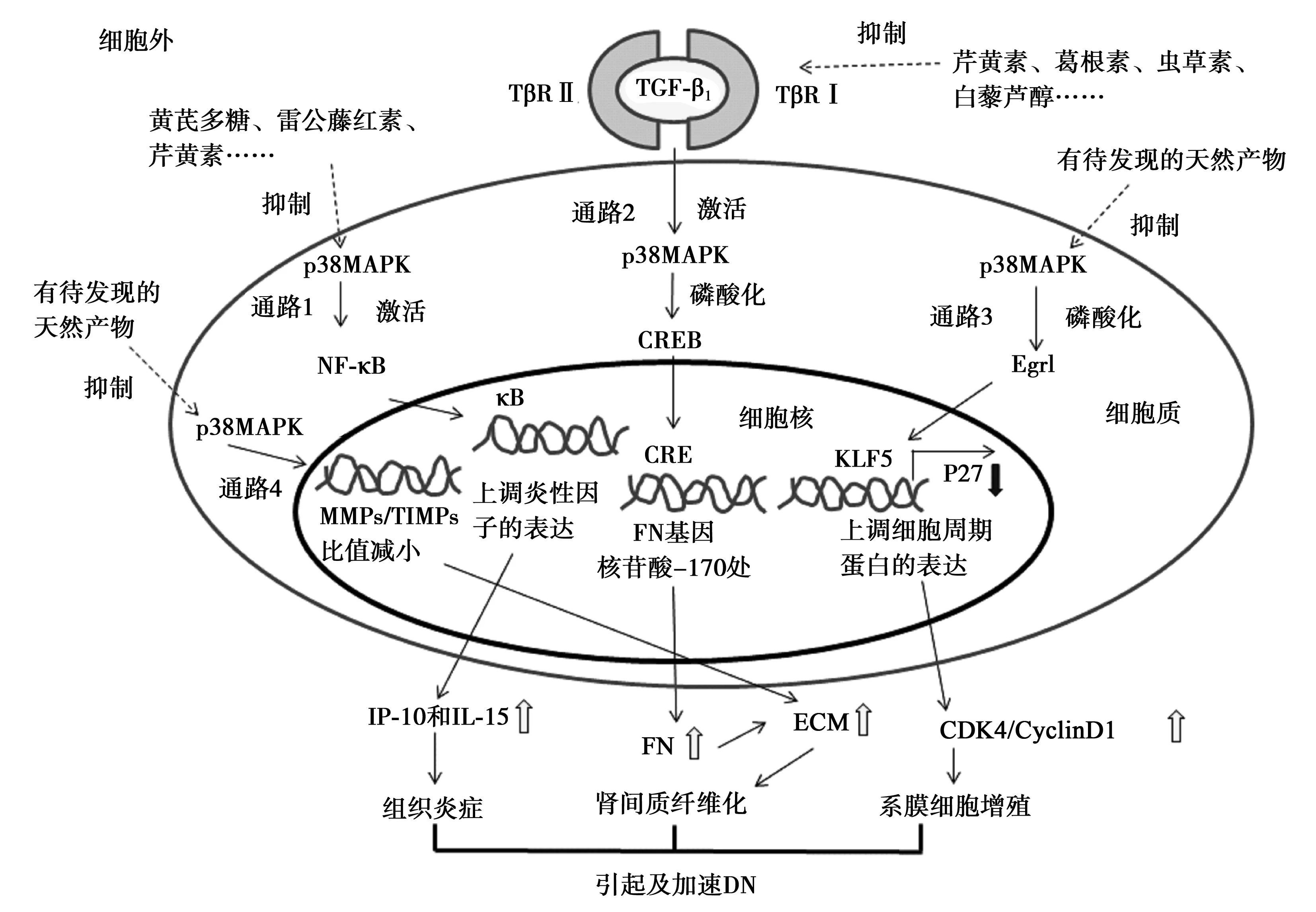
MMP:基质金属蛋白酶;TIMP:MMP组织抑制剂图1 p38MAPK介导的DN发生的信号通路及相关中草药活性成分的作用位点
2.4p38MAPK影响MMPs MMPs是一类Mg2+、Zn2+依赖蛋白,属于肽链内切酶家族。MMPs往往由5个不同的结构域组成,即疏水信号肽序列、前肽区、催化活性区、富含脯氨酸的铰链区与羧基末端区〔49〕。目前已鉴别出的MMPs有20余种,并根据其底物特异性分为六类,即胶原酶、明胶酶、基质降解素、间质降解素、膜型基质、其他MMPs。MMPs主要参与肾细胞ECM降解、转运,在正常生理状态下,它能与其内源性TIMPs调节肾细胞ECM合成与降解的动态平衡,从而保护肾细胞并维持其正常功能〔50〕。
研究表明,某些类型MMPs的活性受p38MAPK调节。聂春岩〔51〕发现在高糖诱导的DN小鼠模型中,其系膜细胞p38MAPK与TIMP-2 mRNA及蛋白表达水平升高,而MMP-2 mRNA及其蛋白表达水平降低,且MMP-2/TIMP-2比值减小,与高糖浓度变化呈一定的依赖性,通过添加p38MAPK抑制剂SB203580可以逆转MMP-2、TIMP-2 mRNA及其蛋白表达水平;郭娟娟〔52〕发现高糖可以诱导DN小鼠p38MAPK信号通路活化,从而使系膜细胞表达MMP-9与TIMP-1 mRNA平衡改变,MMP-9/TIMP-1比值减小,减少肾细胞ECM的降解,引起ECM大量聚集,加速DN进程。
3 基于p38MAPK活性调控减缓DN发生的主要中草药
近年来,越来越多的研究发现,一些中草药对p38MAPK活性具有显著的抑制作用,并可有效降低甚至阻止DN的发生。见图1。
黄酮类物质中,金银花提取物的绿原酸及金柚提取物的黄酮类化合物能通过抑制p38MAPK介导的炎症反应途径,减少肾组织中巨噬细胞表达,降低炎症因子表达,从而阻止DN发展〔53,54〕;洋葱、橙子、欧芹等中的芹黄素,可通过抑制p38MAPK-NF-κB-TNF-α和TGF-β1-p38MAPK-CREB通路,减少细胞凋亡、肾组织炎症和纤维化,从而减轻DN症状〔55〕;黄芩中的黄芩素可通过抑制p38MAPK 磷酸化、氧化-硝化应激等途径,抑制DN发生及恶化〔56〕;葛根中的葛根素可通过降低 TGF-β1的表达抑制p38MAPK活性,进而抑制DN〔57〕。
生物碱类物质中,蛹虫草、冬虫夏草中的虫草素,能抑制高糖介导的 p38MAPK 的磷酸化及 TGF-β1 的表达,减轻肾组织纤维化症状〔58〕;川芎、温莪术等中的川芎嗪,可抑制p38MAPK、ERK1/2磷酸化,减少炎症因子,减轻DN症状〔59〕。
多糖类物质中,黄芪多糖可通过抑制p38MAPK-NF-κB通路,减少细胞凋亡、肾组织炎症和纤维化,从而减轻DN症状〔60〕;枸杞多糖可抑制p38MAPK信号通路,减轻DN症状〔61〕;山药多糖可下调高糖激活的p38MAPK-CREB信号通路,减少肾ECM积聚,减轻肾脏纤维化程度,保护肾功能〔62〕。
酚酸类物质中,雷公藤和南蛇藤中的雷公藤红素,可通过抑制p38MAPK-NF-κB通路,减少炎症因子的产生,减轻DN症状〔63〕;五倍子、漆树、茶等中的没食子酸,可抑制p38MAPK磷酸化,降低DN的发生进程〔64〕。多酚类物质中,花生、葡萄、虎杖、桑椹中的白藜芦醇,可通过抑制p38MAPK磷酸化,减少 TGF-β1的表达来减少肾纤维化〔65〕。
此外,蒽醌类物质中,虎杖中的大黄素,可通过与p38MAPK结合抑制其活性,减缓DN进程〔66〕。核桃中所含的蒽醌类等物质,具有显著的降血糖作用,能有效防止DN发生或减缓病变进程〔67,68〕。
