沉默ASGPR基因对附子多糖靶向抗肝癌作用的影响
2022-07-25孙金霞马桂芳史卫红黄思怡杨李李启松吴芹
孙金霞 马桂芳 史卫红 黄思怡 杨李 李启松 吴芹
(江苏医药职业学院,江苏 盐城 224005)
肝细胞癌(HCC)致死率在肿瘤中居第三位,仅次于肺癌和胃癌〔1〕。目前针对HCC的治疗尚无有效办法,无论靶向药物或传统化疗方案均无法为HCC患者带来满意的治疗效果。附子作为“百药之长”,具有回阳救逆、补火助阳、散寒止痛之功效。研究发现,附子对肿瘤细胞SGC-7901具有抑制生长的作用〔2〕。研究发现,附子总生物碱能有效缓解小鼠诱导出现的乳腺癌身体冰冷、血块淤积等症状〔3〕。董兰凤等〔4〕发现,将附子多糖和阿霉素连用,能诱导肿瘤细胞凋亡,且连用能有效激活特异性T细胞免疫,从而起到抗肿瘤的效果。附子中主要化学成分有生物碱、多糖、苷类等〔5,6〕。附子多糖抗肿瘤作用日益被重视,主要成分是葡萄糖,另含有半乳糖、甘露糖等〔7〕,目前国内对附子多糖抗HCC作用及机制进行了初步研究〔8,9〕。本研究旨在探讨沉默去唾液酸糖蛋白受体(ASGPR)基因对附子多糖靶向治疗HCC的机制。
1 材料与方法
1.1细胞株与培养 293T细胞购自中国科学院上海生命科学研究院细胞资源中心,HepG2细胞购自美国ATCC公司。HepG2细胞和293T细胞均使用DMEM培养基(均含10%胎牛血清、100 U/ml双抗),培养条件为37℃、5%CO2细胞培养箱。
1.2动物与分组 24只雄性SPF级Balb/c裸鼠购自常州卡文斯实验动物有限公司,饲养于江苏医药职业学院实验动物中心;建立HCC模型后将动物按照体重随机分为4组:HepG2-NC siRNA+生理盐水(A组),HepG2-ASGPR siRNA+生理盐水(B组),HepG2-NC siRNA+附子多糖(C组),HepG2-ASGPR siRNA+附子多糖(D组),每组6只。
1.3附子多糖 采用文献〔7〕方法提取附子多糖。用于动物灌胃给药时,附子多糖采用研磨法生理盐水混悬使用;用于细胞实验时,附子多糖粉末用磷酸盐缓冲液(PBS)或无血清培养基配制成相应浓度的多糖溶液,细胞培养时使用0.22 μm无菌滤器过滤即可。
1.4试剂与仪器 慢病毒载体(GFP标签)购自苏州瑞昊生物技术有限公司,靶向沉默ASGPR的RNA干扰序列由苏州金唯智生物科技有限公司合成〔10〕。RPMI1640、DMEM培养基和胎牛血清购自美国Gibco公司,限制性内切酶和连接酶均购自日本TaKaRa公司,质粒抽提试剂盒购自美国Axygen公司,β-actin和ASGPR抗体购自美国Santa Cruz公司,CCK-8试剂盒、真核细胞蛋白提取试剂盒、抗体稀释液、聚偏氟乙烯(PVDF)/NC膜、ECL显影试剂和二抗等均购自碧云天生物技术公司,超净工作台购自苏净公司,CO2培养箱购自三洋公司,流式细胞仪购自美国BD公司,荧光显微镜购自日本Olympus公司,Western印迹电转设备购自美国伯乐公司。
1.5方法
1.5.1重组慢病毒干扰载体与病毒制备 以RNAi序列为正义链,以其互补链为反义链,分别在正、反义链之间加入Loop(UUCAAGAGA),同时在正义链5′端和反义链3′端加入不同酶切位点,从而形成siRNA发夹结构shRNA,将该shRNA序列及其互补序列利用连接酶与慢病毒载体进行基因重组,重组载体记为lenti-ASGPR siRNA组;阴性对照RNAi序列处理相同,记为lenti-NC siRNA组。使用质粒提取试剂盒制备重组慢病毒质粒,然后使用293T细胞进行慢病毒包装,12 h后更换新鲜培养基,继续培养48 h后,使用荧光显微镜观察荧光强度和细胞生长状态,收集病毒上清,-80℃冻存备用。
1.5.2HepG2细胞稳定沉默ASGPR细胞株 获得与鉴定慢病毒颗粒感染HepG2细胞,然后经流式细胞仪分选绿色荧光蛋白(GFP)阳性的细胞,扩大培养,流式细胞仪分析细胞GFP表达的阳性率,以确定是否稳定转染。然后提取细胞总蛋白,Western印迹检测ASGPR表达量,利用抗ASGPR2抗体(1∶1 000)进行一抗孵育,辣根过氧化物酶(HRP)标记的抗兔IgG二抗(1∶200)孵育,以确定ASGPR的表达是否成功被沉默。
1.5.3体外细胞增殖实验 分别收集对数期HepG2-NC siRNA和HepG2-ASGPR siRNA细胞,取少许进行台盼蓝计数,确定活细胞比例,确定生长良好后调节细胞悬液浓度按每孔加3×103个/100 μl细胞铺至96孔板,各设3个复孔,按照50 μg/ml添加附子多糖,置于37℃,5%CO2孵育48 h。每孔加入10 μl CCK-8溶液,继续培养3 h。酶联免疫检测仪测定OD450 nm时,各孔的吸光度值。
1.5.4裸鼠HCC原位移植瘤模型的建立 按照文献〔11〕方法,取对数生长期HepG2-ASGPR siRNA和HepG2-NC siRNA细胞,分别用PBS制成单细胞悬液,浓度为5×105/ml,每只小鼠注射的细胞量为1×106/2 ml PBS,利用高压水流动力学的注射方法在5~8 s内将细胞通过尾静脉注射到小鼠体内,注射后次日开始给予附子多糖(500 mg/kg)。4 w后处死小鼠,取出小鼠肝脏,计数肝脏肿瘤结节数并称重。
1.6统计学方法 采用GraphPad prism5.0软件进行方差分析、t检验,流式细胞仪分析结果使用FlowJo7.6 软件处理作图。
2 结 果
2.1慢病毒包装GFP阳性细胞 视野下细胞均表达荧光强烈,且细胞生长良好,见图1,说明病毒包装成功,收集病毒上清并用0.22 μm的无菌滤器过滤,用于HepG2细胞感染。
2.2HepG2不同转染组细胞中GFP和ASGPR的表达情况 lenti-NC siRNA组和lenti-ASGPR siRNA组HepG2细胞均成功表达GFP,转染效率高达99%以上。A组ASGPR蛋白表达水平(0.989±0.008)显著高于B组(0.473±0.011,P<0.001)。见图2。

图1 293T细胞包装慢病毒后的细胞荧光(×100)
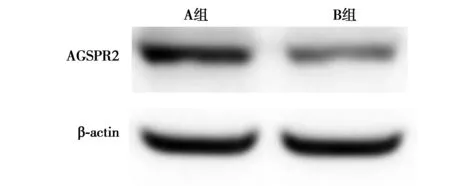
图2 Western印迹检测AGSPR2水平
2.3RNA干扰ASGPR表达后,附子多糖对肝癌细胞体外增殖的影响 A组与B组细胞株增殖无明显差异(P>0.05)。C组OD450值显著低于A组, D组OD450值显著低于B组(P<0.05),表明附子多糖对可显著抑制肝癌细胞的体外增殖。D组细胞的OD450值显著高于C组细胞的OD450值(P<0.05),表明ASGPR表达的缺失,使附子多糖的体外抑制肝癌细胞增殖的能力下降,推测ASGPR可能在附子多糖抗肝癌细胞增殖中发挥作用。见表1。
2.4RNA干扰ASGPR表达后,附子多糖对裸鼠肝癌成瘤的影响 利用高压水流动力学建立肝癌原位移植瘤模型,见表1和图3,模型建立成功。C组与A组相比, D组与B组相比,在肿瘤结节数、肝脏重量显著下降(P<0.05),表明附子多糖可显著抑制裸鼠肝癌成瘤。而D组肿瘤结节个数和肝脏重量显著高于C组(P<0.05),表明干扰ASGPR表达后,附子多糖的体内抑癌能力下降,该结果与体外抑瘤趋势一致,充分表明ASGPR在附子多糖抗肝癌中的重要作用。
表1 各组OD450、肿瘤结节数、肝脏重量比较

图3 附子多糖对各组HCC的影响
3 讨 论
温阳散寒中药对许多晚期癌症患者出现的阳虚寒凝临床表现有较好疗效。附子来源于毛茛科多年生草本植物乌头,有回阳救逆、补火助阳、散寒止痛的功效,临床用于治疗各种亡阳症、虚寒症、寒痹症等。附子多糖是附子的多糖类成分,是附子发挥作用的主要成分之一。
肝细胞表面存在多种糖链识别受体,如甘露糖受体、半乳糖受体等〔12〕。ASGPR是一种跨膜蛋白,是主要表达在肝窦状隙和基底外侧细胞表面的受体。人肝癌细胞系HepG2能高表达ASGPR,其表达的ASGPR约为22.5万个〔13〕,是研究ASGPR的理想细胞。ASGPR的胞外结构域含有糖识别结构域,能识别和结合半乳糖残基和 N-乙酰半乳糖胺残基,当与特异的糖残基结合后,即发生受体介导的胞吞作用〔14,15〕。有研究发现当归多糖可靶向肝脏富集,且可能通过 ASGPR 介导进入肝脏细胞〔16〕,从而影响肝癌细胞的生物学功能。
