靶向+化疗治疗EGFR+TP53共变的老年肺腺癌患者的临床疗效及安全性
2022-07-25张驰史清明顾康生
张驰 史清明 顾康生
(1安徽医科大学第一附属医院肿瘤内科,安徽 合肥 230022;2安徽省胸科医院肿瘤一科)
肺癌在我国具有较高的发病率及致死率,近几年由于早期精准诊断及个体化治疗,肺腺癌患者的预后及生存质量明显提高,特别是有表皮生长因子受体(EGFR)、间变性淋巴瘤激酶(ALK)等基因突变的肺腺癌患者较为明显〔1,2〕。但并非全部患者对靶向治疗、化疗治疗产生同样的反应〔3〕。随着测序技术兴起及快速发展,快速、高通量、全基因组检测为肺腺癌患者诊疗及预后效果评估提供更多资料。据报道,与单一基因突变对比,多个基因突变会导致患者治疗效果差,其中TP53尤为常见〔4〕。然而对于EGFR+TP53基因共突变对肺腺癌的影响尚不明确。本文拟探究靶向+化疗治疗EGFR+TP53共变的老年肺腺癌患者的临床疗效及安全性。
1 资料与方法
1.1临床资料 回顾2017年7月至2020年12月安徽医科大学第一附属医院收治的94例老年肺腺癌患者的临床资料,根据基因突变及治疗方式分为A组(n=24,EGFR突变,靶向治疗)、B组(n=20,EGFR+TP53共变,靶向治疗)、C组(n=24,EGFR突变,化疗+靶向治疗)、D组(n=26,EGFR+TP53共变,化疗+靶向治疗),一般资料中未吸烟定义:截至目前吸烟数≤100支。各组一般资料差异无统计学意义(P>0.05),具有可比性,见表1。
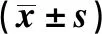
表1 各组一般资料对比
1.2纳入与排除标准 纳入标准:①符合关于国际抗癌联盟第8版肺癌诊断及TNM分期标准〔5〕,TNM 分期为Ⅲa 期或Ⅳ期;②年龄60~88岁;③CT引导下经皮肺穿刺活检样本经病理确诊为肺腺癌;④入组前未接受过放疗、化疗、靶向治疗;⑤预计生存>3个月;⑥无严重肺、肝、肾等基础疾病;⑦EGFR 基因检测结果显示阳性;⑧CT 检查存在可测量病灶;⑨美国东部肿瘤协作组(ECOG)评分0~2分。排除标准:①靶向、化疗禁忌证;②合并其他原发性肿瘤疾病者;③由于消化性溃疡、重症感染而中断服药者;④肝肾功能异常;⑤临床随访资料不齐全;⑥精神障碍或有明确精神药物滥用史;⑦随访期间发现死于肺腺癌或相关并发症以外的疾病;⑧失访或主动申请退出本研究,不能定期随访复查或依从性差者。
1.3治疗方法 埃克替尼125 mg/次,3次/d;奥希替尼80 mg/次,1次/d;吉非替尼250 mg(1片)/d;厄洛替尼40 mg/d;阿法替尼 40 mg/d。化疗药物:吉西他滨使用推荐剂量为1 000 mg/m2,静脉滴注30 min,1次/w,连续3 w。卡铂静脉滴注,一次给药法,每次300~400 mg/m2;培美曲塞500 mg/m2,第1天;顺铂75 mg/m2,第1天,每3 w 1次;多西他赛75 mg/m2,持续静脉滴入1 h,第1天;奈达铂75~80 mg/m2,静脉滴注2 h。
靶向+化疗〔6,7〕:化疗方案包括培美曲塞+顺铂培美曲塞+卡铂,培美曲塞,多西他赛,吉西他滨+卡铂,培美曲赛+奈达伯。1个疗程3 w,连续用药3个疗程后评估临床治疗效果。治疗期间定期监测全部病例的肝肾功能、血常规、心电图、肿瘤标志物、影像学情况。
靶向治疗药物:埃克替尼(商品名:凯美纳),规格:125 mg/片,批准文号:国药准字H20110061,生产企业:浙江贝达药业有限公司,125 mg/次,3次/d;奥希替尼(商品:泰瑞沙),规格:80 mg/片,生产企业: AstraZeneca AB,80 mg/次,1次/d;吉非替尼有两种,一种是商品名:易瑞沙,规格:每片250 mg,批号:1312121,阿斯利康(无锡)贸易有限公司生产;另一种商品名:易瑞可,规格250 mg/片,国药准字:H20163465,生产企业:齐鲁制药(海南)有限公司;厄洛替尼(商品名:特罗凯),规格:每粒150 mg,批号:SH0059/B2130,上海罗氏制药有限公司生产;阿法替尼(商品名:吉泰瑞),规格: 40 mg/片,生产企业:Boehringer Ingelheim International GmbH 。
化疗药物:吉西他滨(商品名:英择),国药准字 H20113252国药准字H20113286,规格1 g,生产企业:齐鲁制药(海南)有限公司,生产企业: Lilly France S.A.;培美曲塞注射液有2种,一种商品名:赛珍,规格0.2 g,国药准字H20103287,国药准字H20060672,企业名称:齐鲁制药有限公司;另一种商品名海玥,规格500 mg,国药准字H20173301,企业名称:四川汇宇制药有限公司;卡铂注射液(商品名:波贝),规格10 ml/50 mg,国药准字H20020181,企业名称:齐鲁制药有限公司。
1.4近期疗效评价
1.4.1用药2个周期后疗效评估 按照实体瘤疗效评价标准(RECIST1.1)〔8〕分为完全缓解(CR):病灶完全消失,且有效维持4 w以上;部分缓解(PR):病灶直径总和缩小30%以上,且有效维持4 w以上;稳定(SD):病灶直径总和介于PR与进展(PD)之间;PD:病灶面直径总和增大20%或出现新病灶;疾病控制率(DCR)=CR+PR+SD,客观缓解率(ORR)=CR+PR。
1.4.2安全性评价 安全性通过观察患者在治疗期间不良反应(白细胞减少、贫血、血小板减少、谷丙转氨酶、肌酐、皮疹、腹泻、口腔溃疡)评估,参照美国国立癌症研究所通用不良事件术语标准(NCI-CTCAE)〔9〕4.0标准,分为 0 ~Ⅳ级。
1.5远期疗效评估〔10〕治疗结束后,定期2个月到院复查相关指标,评估疾病进展情况。全部患者通过电话随访或定期来院随访,随访开始时间2017年8月,最短随访时间为20个月,随访至死亡或研究截止时间(2021年4月10日)。统计4组总生存期(OS)及无进展生存时间(PFS)。PFS指开始化疗或靶向治疗至疾病进展的时间间隔。OS指开始给予药物到研究截止日期或死亡。
1.6统计学方法 应用SPSS25.0软件进行方差分析、t检验、χ2检验。
2 结 果
2.1各组近期疗效比较 A组DCR、ORR明显高于B组,明显低于D组(P<0.05),C、D组PR、DCR、ORR明显高于B组(P<0.05),C组与D组对比差异无统计学意义(P>0.05)。见表2。

表2 各组近期疗效对比〔n(%)〕
2.2远期疗效评价 A组PFS中位数、OS为14个月、19个月,B组分别为10个月、12个月,C组分别为12个月、14个月,D组分别为16个月、22个月。A组PFS、OS较B组长,D组较B组长,差异有统计学意义(P<0.05)。
2.3安全性评价 4组均出现不同程度毒副反应,不良反应发生率组间对比无统计学意义(P>0.05)。A组发生不良反应20例(83.23%),其中2例为4级,其余为1~3级;B组16例(80.00%)均为1~2级不良反应;C组23例(95.83%)均为1~3级,D组23例(88.46%)中3例为4级不良反应,其余为1~3级。经对症处理或暂停减量后,绝大多数患者的不良反应可控,耐受性良好。
3 讨 论
肺腺癌早期无明显临床症状,常在胸部X线检查时而确诊,多表现为椭圆形或圆形肿块,生长较慢,但部分患者仍可能出现在发病早期已经出现转移。现阶段临床中对肺腺癌患者进行治疗时,若患者为发病早期则可采用手术切除方案作为首选,而晚期患者则仅可通过放化疗、靶向治疗。据报道,EGFR突变晚期患者采用EGFR 酪氨酸激酶抑制剂(EGFR-TKI)治疗,有效延长无病生存期,安全有效〔11〕。然而临床治疗中,不是全部EGFR基因突变患者都能从EGFR-TKI治疗中获益,不可避免发生继发性耐药或原发性耐药。据报道,20%~30%的EGFR基因突变患者产生原发性耐药〔9〕。对于EGFR+TP53基因共突变对化疗联合靶向治疗肺腺癌的影响尚不明确,进一步探究靶向+化疗对EGFR+TP53基因共突变肺腺癌患者的临床效果及安全性,能改善双基因共变患者的预后,最可能提高生存质量,延长生存期。
有研究表明〔12〕,靶向联合化疗治疗EGFR突变肺癌患者取得显著效果,延长生存时间,但其未能研究靶向联合化疗对双基因突变肺腺癌患者的影响。本研究结果说明TP53对肺腺癌患者靶向治疗有负向作用,EGFR+TP53双共变时靶向结合化疗更好,化疗改变TP53负向的影响,提高靶向联合化疗治疗效果。学者〔13〕探究一代EGFR-TKIs联合化疗对双突变肺癌患者的临床效果,张乾坤等〔14〕研究表明,EGFR+TP53双共变对接受EGFR-TKI治疗的肺腺癌患者疗效产生影响,认为TP53基因突变与疗效有关,所以TP53基因能够预测接受EGFR-TKIs治疗EGFR基因突变肺腺癌患者的临床疗效及预后。本研究结果与之相似。由此展望,化疗联合靶向治疗在双基因共变肺腺癌患者方面可能有比较好的作用。
综上,TP53对肺腺癌患者靶向治疗有负向作用,EGFR+TP53双共变时靶向结合化疗更好,而化疗改变TP53负向的影响,提高靶向联合化疗治疗效果,延长生存时间,安全性高。
