TACE联合卡瑞利珠单抗治疗中晚期肝细胞癌
2022-07-25于士龙刘东辉张东旭张北光
于士龙,刘东辉,王 储,张东旭,金 刚,张北光,陈 健
(吉林省肿瘤医院介入中心,吉林 长春 130012)
2020年,全球新发原发性肝癌约90.6万例,死亡约83.0万例,肝癌已成为世界第6位常见恶性肿瘤及第3位致死肿瘤[1]。我国肝癌新发病例和死亡病例分别占全球45.3%和47.1%[2-3]。大部分肝癌患者就诊时已为中晚期,可予手术切除者占比不足30%[4],TACE是公认的治疗中晚期肝细胞癌(hepatocellular carcinoma, HCC)的主要手段[5]。与欧美国家相比,我国接受TACE治疗的HCC患者分期更晚、肿瘤负荷更重,单一TACE治疗效果欠佳[6-7]。卡瑞利珠单抗为人源化抗程序性死亡受体1(programmed death 1, PD-1)单克隆抗体,已获批作为二线单药治疗晚期肝癌。本研究观察TACE联合卡瑞利珠单抗治疗中晚期HCC的有效性和安全性。
1 资料与方法
1.1 一般资料 回顾性分析2019年7月—2021年10月42例于吉林省肿瘤医院接受TACE联合卡瑞利珠单抗治疗的中晚期HCC患者(联合组),男36例,女6例,年龄30~88岁,平均(59.3±13.3)岁;26例存在多发HCC病灶,36例病灶最大经≤3 cm。纳入标准:①影像学或病理学诊断为HCC;②巴塞罗那临床肝癌(Barcelona clinic liver cancer, BCLC)分期为B/C期;③肝功能Child-Pugh分级为A/B级;④美国东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)评分为0~1分。排除标准:①弥漫性肝癌;②并发其他恶性肿瘤或其他严重疾病;③严重凝血障碍;④门静脉主干完全癌栓栓塞,且无法纠正;⑤临床资料不全。以R 4.0.1软件的Matchit包对同期150例仅接受TACE治疗的HCC患者进行倾向性评分匹配,分组比例为1∶1,卡钳值为0.05,共选出42例作为对照组,男36例,女6例,年龄31~81岁,平均(59.8±10.3)岁;26例存在多发病灶,36例病灶最大经≤3 cm。
1.2 仪器与方法 以Simmens Biplannar Artiz数字减影血管造影(digtal subtraction angiography, DSA)机作为引导设备。对2组患者均行TACE,常规消毒、铺巾、麻醉后以Seldinger技术穿刺右股动脉,置入5F导管鞘(Terumo),将5F RH导管(Terumo)置于腹腔干行肝动脉造影,必要时加行膈动脉、肠系膜上动脉及肾上腺动脉造影。明确诊断后,将微导管超选至肿瘤供血血管,分别缓慢灌注100 ml稀释糖化奥沙利铂(100~150 mg)及100 ml稀释水化雷替曲塞(4 mg),灌注时间>20 min,以5~10 ml碘化油及20 mg表阿霉素乳化剂进行栓塞后,再以明胶海绵栓塞微球进一步栓塞,以前向血流流速明显变缓及停止为栓塞终点。之后每隔1个月复查1次,发现新病灶或残留病灶时再行TACE,方法同前,记录TACE治疗次数。对联合组于TACE后3~7天复查血常规和肝肾功能,如无明显异常,则予静脉滴注卡瑞利珠单抗(200 mg),每3周1次,直至疾病进展或出现不可耐受的不良反应。
1.3 临床资料 记录2组患者临床资料,包括有无乙肝病毒感染、甲胎蛋白水平、Child-Pugh分级、BCLC分期、ECOG评分及有无肝外转移。
1.4 疗效评价 由2名具有3年以上工作经验的放射科医师针对TACE后12周的CT或MRI独立评价疗效,根据改良实体瘤疗效评价标准(modified-response evaluation criteria in solid tumors, mRECIST)将患者分为完全缓解(complete response, CR)、部分缓解(partial response, PR)、疾病稳定(stable disease, SD)和疾病进展(progressive disease, PD)。客观缓解率(objective response rate, ORR)=(CR+PR)/总例数×100%;疾病控制率(disease control rate, DCR)=(CR+PR+SD)/总例数×100%。
1.5 随访 随访至2022年2月11日,记录患者总生存期(overall survival, OS)及无进展生存期(progression free survival, PFS):OS定义为开始TACE治疗至任何原因引起的死亡或末次随访的时间间隔;PFS定义为开始TACE治疗至PD、任何原因引起的死亡或末次随访的时间间隔。参照美国癌症研究所《不良事件通用术语标准》4.03版判断并记录联合组患者不良反应出现时间、持续时间及其严重程度。
2 结果
2.1 基本资料 2组患者年龄(t=0.183)、临床分级等基本资料差异均无统计学意义(P均>0.05),见表1。联合组平均接受(4.2±1.0)次TACE治疗,对照组平均(4.1±1.2)次,差异无统计学意义(t=0.698,P=0.487)。
2.2 疗效分析 利用mRECIST评估治疗12周后的靶病灶,联合组CR、PR、SD、PD分别为6、20、13、3例,对照组分别为2、13、14、13例,联合组与对照组的ORR分别为61.90%(26/42)及35.71%(15/42),DCR分别为92.86%(39/42)和69.05%(29/42),差异均有统计学意义(χ2=4.765、6.254,P=0.029、0.012),与基线对比的最佳影像学评价见图1。
2.3 随访结果 随访时间2.5~26.2个月,中位时间20.2个月。随访截止时,联合组与对照组死亡例数分别为25例(25/42,59.52%)和24例(24/42,57.14%),疾病进展和死亡例数分别为32例(32/42,76.19%)和33例(33/42,78.57%)。联合组中位OS(19.3个月)长于对照组(13.6个月),差异有统计学意义(P=0.009)。联合组发生死亡事件的相对风险(hazard ratio, HR)为0.456,加用卡瑞利珠单抗使患者死亡风险降低54.40%;联合组中位PFS(12.9个月)长于对照组(8.4个月),差异有统计学意义(P=0.029),HR为0.579,即加用卡瑞利珠单抗使复发风险降低42.10%。见图2、3。
2.4 不良反应 联合组29例(29/42,69.05%)出现反应性皮肤毛细血管增生症(reactive cutaneous capillary endothelial proliferation, RCCEP),均为1级不良反应,用药后6个月内多数结节消退,仅1例因病灶位于眼睑处、影响正常生活而予手术切除;发生RCCEP患者的ORR为68.97%(20/29),未发生者ORR为46.15%(6/13),差异无统计学意义(χ2=1.132,P=0.288)。其他不良反应包括免疫性肝炎8例(8/42,19.05%)、甲状腺功能减退4例(4/42,9.52%)、食欲减退4例(4/42,9.52%)、免疫性结肠炎3例(3/42,7.14%)及腹泻1例(1/42,2.38%),未出现3/4级不良反应,无因不良反应而停药病例。
3 讨论
手术治疗中晚期HCC效果不佳,TACE虽然已被广泛应用,但远期疗效欠佳[8]。为提高疗效,TACE联合局部消融、外放射等治疗手段逐渐用于临床,并取得阶段性成果[9],使得系统性治疗成为中晚期HCC的研究热点。作为靶向药物,索拉非尼和仑伐替尼已在国内获批为一线药物用于治疗肝癌,但单药的疗效有限[10-11]。FOLFOX4方案(包括奥沙利铂、亚叶酸钙及氟尿嘧啶)已用于治疗不适合手术切除或局部治疗的局部晚期和转移性肝癌[12],三氧化二砷对中晚期肝癌具有一定姑息治疗作用[13]。在免疫治疗领域,纳武利尤单抗和帕博利珠单抗已在美国获批作为治疗肝癌的二线药物,其单药有效率为15%~20%[14-15]。单纯局部治疗或系统治疗均未取得理想效果,两者结合或可提升疗效。既往研究[16-17]显示,TACE联合靶向药物治疗中晚期HCC效果较为理想,且安全性较高;而TACE联合免疫治疗目前尚无大样本研究结果。本研究经匹配选择基线一致的观察对象,而联合组ORR和DCR显著高于对照组,提示联合治疗具有良好的短期疗效;同时,联合组和对照组的中位OS分别为19.3和13.6个月,中位PFS分别为12.9和8.4个月,表明联合治疗明显延长了HCC患者的OS和PFS。
RCCEP是卡瑞利珠单抗独有且高发的不良反应,目前对其发病机制尚不十分明确,可能卡瑞利珠单抗在逆转机体免疫抑制状态的同时可使促血管内皮生成因子与抑制血管内皮生成因子表达失衡而致RCCEP[18]。本研究联合组29例出现RCCEP,发生率为69.05%,但均为1级不良反应,未导致用药延迟或中断;该组出现RCCEP患者的ORR为68.97%,未出现RCCEP者ORR为46.15%,差异无统计学意义。肿瘤免疫治疗中,特定不良反应发生是否与疗效相关尚未可知,需要进一步研究。
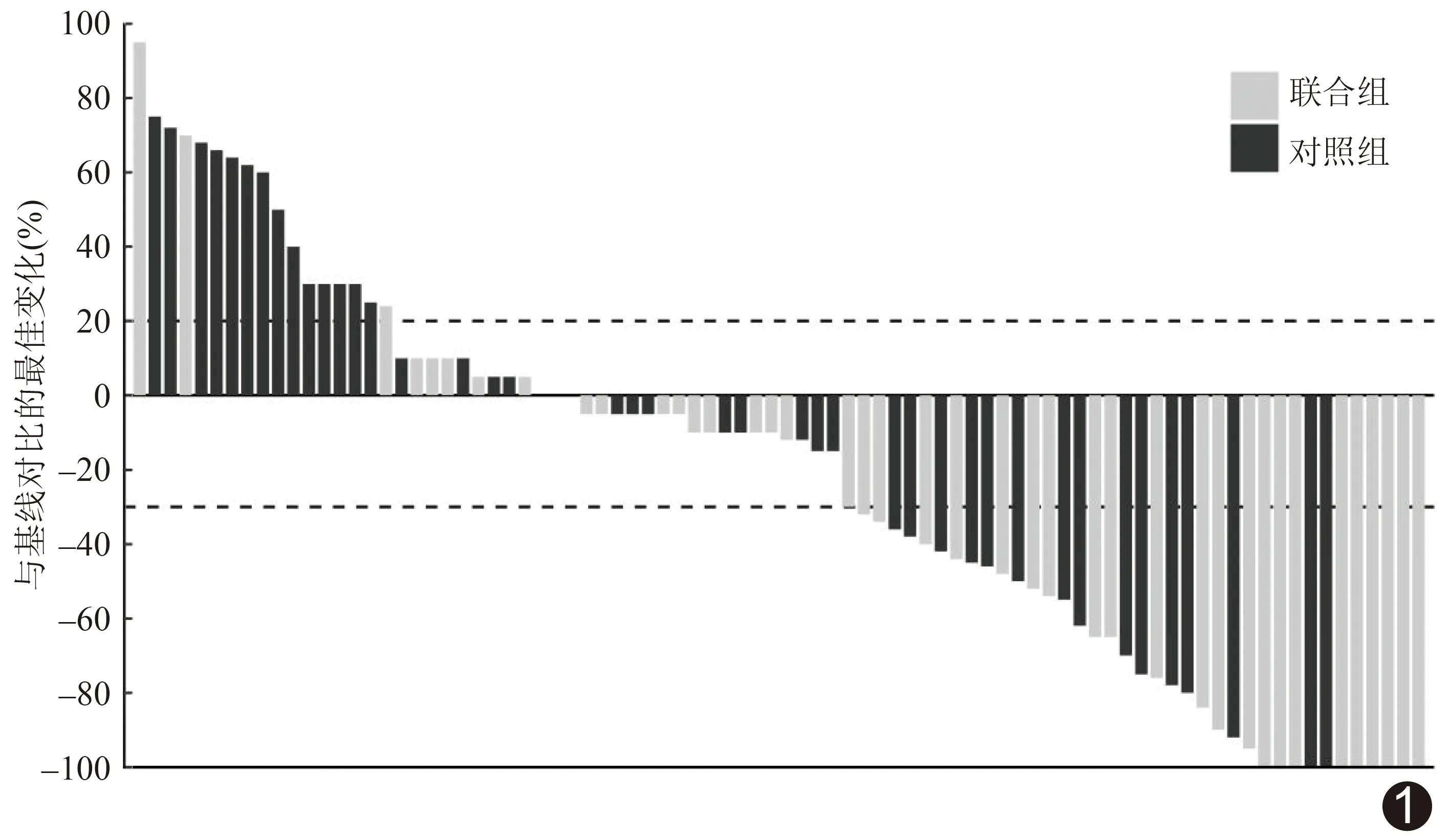
图1 联合组和对照组与基线对比的最佳影像学评价
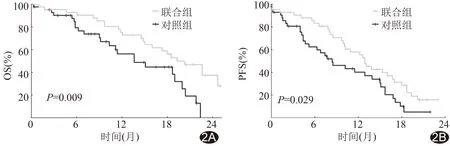
图2 HCC患者经TACE联合卡瑞利珠单抗治疗或TACE治疗后生存曲线 A.OS; B.PFS
综上,TACE联合卡瑞利珠单抗治疗中晚期HCC安全、有效。但本研究为单中心回顾性研究,样本量较小,有待后续进一步完善。
