猪β-防御素-2在黄曲霉毒素B1致仔猪空肠上皮细胞炎症反应中的作用
2022-07-25李庆豪彭雅婷
李庆豪,张 曼,孙 娟,彭雅婷,刘 勇,金 鑫*,李 奎*
(1.河南农业大学 动物医学院,河南 郑州 450046;2.河南牧业经济学院 动物医药学院,河南 郑州 450046;3.郑州大学 第三附属医院,河南 郑州 450052)
黄曲霉毒素(aflatoxin,AF)是由黄曲霉和寄生曲霉产生的一种具有强致癌、致畸、致突变的次生代谢产物,多见于霉变饲料中。目前已经成功分离的AF多达20余种并由其在紫外光下发出的颜色命名[1],其中以产毒黄曲霉所产生的黄曲霉毒素B1(aflatoxin B1,AFB1)所占比例最大、毒性最强,其毒性可达砒霜的68倍且稳定性极强[2]。研究表明,长期摄入一定量的AFB1对消化道有严重影响,破坏动物肠道菌群平衡,导致饲料转化率和日增重降低[3],影响动物健康,且影响我国动物产品出口,给生产养殖带来重大经济损失。目前解决黄曲霉污染的主要手段是使用抗生素[4-5],但抗生素的危害及耐药性问题极大地限制了其使用。因此使用天然抗菌肽作为药物或饲料添加剂缓解AFB1造成的影响,成为当前亟须解决的关键问题。
防御素(defensins)是动物自身产生的天然抗菌肽家族中最重要的一类,其分子中的半胱氨酸残基以二硫键连接使防御素分子形成稳定的二级结构,目前已经发现的哺乳动物防御素依据其分子空间结构的不同分为α-、β-和θ-防御素[6-7]。研究发现,防御素与多种肠道疾病关系密切[7],除具有抗菌和抗病毒的作用外,还能促进上皮细胞再生以修复机体损伤[8]。因此,在上皮和黏膜组织中高表达的防御素构成了机体抵抗外界的第1道防线[9-10]。目前猪源α-和θ-防御素鲜有报道,已经发现的猪源β-防御素有29种,其中以猪β-防御素-2(porcine β-defensin 2,pBD-2)在消化系统中的含量最高[5]。但其对AFB1所致的肠道损伤是否有缓解或治疗作用尚不明确。
为探究pBD-2在AFB1所致小肠上皮细胞炎症反应中的作用,选用体外培养的新生仔猪空肠上皮细胞(IPEC-J2),使用不同质量浓度AFB1及pBD-2处理细胞,找出对细胞造成显著影响的AFB1质量浓度及可用于细胞处理的pBD-2安全质量浓度,后使用不同质量浓度的pBD-2处理AFB1致细胞损伤模型,提取细胞总RNA和总蛋白,分别采用qPCR和Western blot方法在mRNA和蛋白水平检测炎性因子TNF-α和IL-1β的表达变化,以分析pBD-2是否对AFB1所致小肠上皮细胞的炎症反应具有缓解作用,为开发pBD-2作为预防AFB1对动物损害的药物或绿色饲料添加剂提供理论依据。
1 材料与方法
1.1 试验材料IPEC-J2细胞由河南农业大学动物医学院分子免疫学实验室惠赠。细胞培养所需FBS胎牛血清(BS1612)购自BIOEXPLORER公司;基础培养基(31800,11875)、PBS磷酸盐缓冲液(P1010)及胰蛋白酶-EDTA消化液(T1300)购自索莱宝科技有限公司;AFB1(A6636,assay:≥98%)购自Sigma公司;pBD-2(BP019197,purity:90.71%)购自武汉百意欣生物技术有限公司;细胞检测CCK-8试剂盒(GK10001)购自GLPBIO公司;RNA小量提取试剂盒(PID0360406)购自康宁生命科学有限公司;反转录试剂盒(11123ES60)、qPCR试剂盒(11202ES08)、SDS-PAGE蛋白上样缓冲液(20315ES05)及ECL化学发光超敏显色试剂盒(36208ES60)购自翌圣生物科技有限公司;RIPA裂解液(P0013)及PMSF(ST506)购自碧云天生物技术有限公司;Western blot所需β-actin抗体(WL01372)、TNF-α抗体(WL01581)、IL-1β抗体(WL00891)及辣根过氧化物酶(HRP)标记山羊抗兔IgG(WLA023a)购自万类生物科技有限公司。
1.2 IPEC-J2细胞培养取出冻存的IPEC-J2细胞,37℃恒温水浴快速融化后,使用含10% FBS的完全培养基,以1×105cells/cm2的密度接种至25 cm2细胞培养瓶,每瓶培养基总体积5 mL。置于37℃、5% CO2培养箱培养[11]。传代2~3次后,部分细胞于液氮中冻存备用,部分传代至12孔细胞培养板用于后续试验。
1.3 AFB1及pBD-2可用质量浓度筛选
1.3.1不同质量浓度AFB1及pBD-2处理IPEC-J2细胞 待细胞铺满培养孔面积的90%以上,取出12孔细胞培养板,使用PBS润洗细胞2遍,将培养体系中的完全培养基更换为基础培养基,使每孔最终体积为500 μL,在培养孔中分别加入梯度质量浓度(0,20,40,60,80,100 mg/L)的AFB1及梯度质量浓度(0,2,4,6,8,10 mg/L)的pBD-2处理IPEC-J2细胞12 h,每一质量浓度设置3次重复。
1.3.2CCK-8法检测细胞存活率 处理细胞12 h后,弃去培养基,使用PBS润洗细胞2次,换用基础培养基并加入基础培养基10%体积的CCK-8。置于培养箱孵育4 h后取出细胞培养板,使用酶标仪检测各培养孔的D450 nm,按照如下计算方法换算为细胞存活率,确认AFB1及pBD-2的安全质量浓度范围。

其中,Ds:试验组吸光度(含有细胞、基础培养基、CCK-8和AFB1或pBD-2);Db:空白组吸光度(含有基础培养基和CCK-8);Dc:对照组吸光度(含有细胞、基础培养基和CCK-8)。
1.4 AFB1致细胞损伤模型建立
1.4.1qPCR引物设计 qPCR所需引物参考NCBI基因序列使用Primer Premier 6软件设计并交由生工生物工程(上海)股份有限公司合成,引物序列见表1。

表1 IPEC-J2细胞炎性因子相关基因引物信息
1.4.2不同质量浓度AFB1处理IPEC-J2细胞 根据细胞存活率检测结果,使用安全的梯度质量浓度AFB1处理IPEC-J2细胞12 h,同时设立空白对照组。操作方法同1.3.1。
1.4.3细胞总RNA提取及cDNA反转录 处理细胞12 h后取出细胞培养板,PBS润洗2次,按照RNA小量提取试剂盒说明书提取各组细胞总RNA,使用多功能酶标仪检测RNA质量浓度与纯度,将质量良好的总RNA按照反转录试剂盒说明书操作获得cDNA。封口膜封口后置于-20℃保存备用。
1.4.4qPCR检测炎性因子mRNA表达变化 qPCR选用20 μL体系,其中包含 10 μL的Hieff®qPCR SYBR®Green Master Mix、7.2 μL的RNase-free ddH2O、0.4 μL的浓度为10 μmol/L的Forward Primer和0.4 μL的浓度为10 μmol/L的Reverse Primer及2 μL cDNA模板,扩增反应后通过扩增曲线及溶解曲线判断扩增效果及引物特异性,数据采用2-ΔΔCt法计算并分析TNF-α和IL-1β相对于β-actin的相对表达量及其变化情况,找出开始对IPEC-J2细胞造成显著影响的AFB1质量浓度,依据药物低中剂量原则[12],以此浓度的AFB1处理细胞,建立细胞损伤模型。qPCR扩增程序按照qPCR试剂盒说明书设置如下:95℃ 5 min,95℃ 10 s,60℃ 20 s,72℃ 30 s,40个循环。溶解曲线阶段使用仪器默认设置。
1.5 pBD-2在AFB1致IPEC-J2细胞炎症反应中的作用分析
1.5.1AFB1及pBD-2处理IPEC-J2细胞 根据细胞存活率检测及细胞损伤模型建立结果,使用可用梯度质量浓度的pBD-2处理AFB1致IPEC-J2细胞损伤模型,根据pBD-2质量浓度梯度设置多组试验组。同时设立单独使用AFB1和pBD-2处理的细胞作为阳性对照组和阴性对照组,未做任何处理的细胞作为空白对照组。所有对照组处理细胞12 h,试验组使用AFB1处理12 h后,分别换用不同质量浓度pBD-2处理12 h。操作方法同1.3.1。所有组均设置6次重复,分为2批处理,分别用于总RNA和总蛋白提取。
1.5.2细胞总RNA及总蛋白提取 细胞处理结束后,取出细胞培养板,与1.4.3相同操作提取细胞总RNA并反转录为cDNA。将RIPA裂解液和PMSF按照9∶1的比例混合,使PMSF的终浓度为1 mmol/L。取另一批细胞,PBS润洗2次,按照RIPA裂解液说明书操作提取细胞总蛋白,再按照每4 μL蛋白样品加入1 μL蛋白上样缓冲液(5×)的比例,给每个蛋白样品加入SDS-PAGE蛋白上样缓冲液。混匀后沸水浴5 min,使蛋白充分变性。封口膜封口后置于-20℃保存备用。
1.5.3qPCR检测炎性因子mRNA表达变化 方法同1.4.4,分析TNF-α和IL-1β相对于β-actin的相对表达量及其变化情况,在mRNA水平确定pBD-2在AFB1致IPEC-J2细胞炎症反应中的作用。
1.5.4Western blot检测炎性因子蛋白表达变化 SDS-PAGE蛋白凝胶按照分离胶10%、浓缩胶5%的浓度配制。按每孔等体积上样量10 μL,采用浓缩胶80 V、分离胶120 V的恒压设置,约150 min完成电泳。使用200 mA恒流模式转移蛋白至PVDF膜,再用5%脱脂牛奶封闭。孵育抗体后使用ECL化学发光试剂盒显影拍照,Image J软件分析蛋白条带灰度值,比值法计算TNF-α和IL-1β相对于内参蛋白β-actin的相对表达量。在蛋白水平确定pBD-2在AFB1致IPEC-J2细胞炎症反应中的作用。
2 结果
2.1 IPEC-J2细胞培养使用含10% FBS的完全培养基,将细胞置于37℃、5% CO2培养箱培养。培养结果如图1所示,细胞24 h可铺满培养瓶底部的80%以上,细胞状态良好,生长速度较快,可用于后续试验。

图1 IPEC-J2细胞体外培养24 h时观察结果
2.2 AFB1及pBD-2可用质量浓度范围筛选在AFB1或pBD-2处理过的细胞培养孔中加入基础培养基和CCK-8,同时设立对照组和仅含基础培养基及CCK-8的空白组,置于培养箱孵育4 h后,使用酶标仪测定各培养孔的D450 nm,计算细胞相对存活率。检测结果如图2所示,致细胞显著死亡的AFB1起始质量浓度为60 mg/L;pBD-2在10 mg/L时出现细胞毒性,细胞存活率显著低于空白对照组。因此,AFB1和pBD-2的使用质量浓度应分别低于60,10 mg/L。
2.3 AFB1致IPEC-J2细胞损伤模型的建立根据质量浓度筛选结果,使用梯度质量浓度(0,10,20,30,40,50 mg/L)的AFB1处理细胞12 h,提取细胞总RNA,使用qPCR方法检测TNF-α mRNA与IL-1β mRNA的表达变化。
2.3.1qPCR扩增反应 选用20 μL扩增体系,按照1.4.4中的参数设置进行扩增。扩增曲线及溶解曲线如图3所示,扩增曲线均表现为S形指数特征,表明扩增效果良好;溶解曲线均为单一峰曲线,且Tm值与设计值相同,未见多峰、主峰增宽或主峰位置不一致,表明引物特异性良好,不存在非特异性扩增。
2.3.2AFB1对TNF-α mRNA及IL-1β mRNA表达的影响 扩增反应结束后,采用2-ΔΔCt法计算数据并分析TNF-α和IL-1β相对于β-actin的相对表达量及其变化情况。结果如图4所示,不同质量浓度的AFB1处理IPEC-J2细胞,炎性因子TNF-α mRNA和IL-1β mRNA的表达存在剂量相关的变化,且AFB1自质量浓度30 mg/L起对细胞造成显著影响(P<0.05)。因此,后续试验使用30 mg/L的AFB1处理细胞,建立细胞损伤模型。

不含相同字母的组间存在显著性差异(P<0.05)。下同
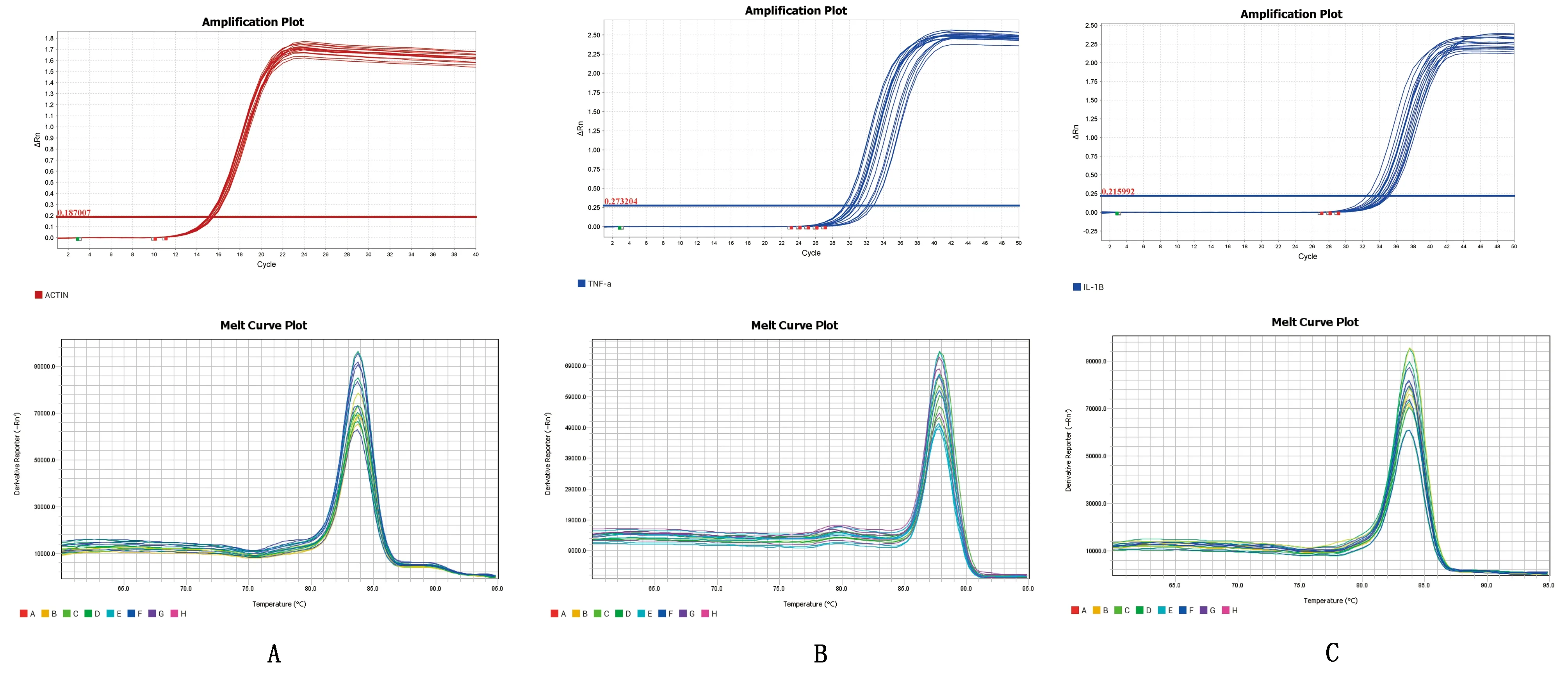
图3 β-actin(A)、TNF-α(B)和IL-1β(C)的扩增曲线及溶解曲线

与空白对照组(0 mg/L)相比,*P<0.05,**P<0.01
2.4 pBD-2在AFB1致IPEC-J2细胞炎症反应中的作用使用梯度质量浓度(2,4,6,8 mg/L)的pBD-2处理细胞损伤模型12 h,同时设立AFB1阳性对照组、pBD-2阴性对照组和空白对照组。提取各组细胞总RNA和总蛋白,分别使用qPCR和Western blot方法从mRNA和蛋白水平检测炎性因子TNF-α与IL-1β的表达变化。
2.4.1TNF-α的表达变化 qPCR与Western blot结果显示,2,4,6,8 mg/L的pBD-2对TNF-α mRNA的表达均无显著影响(P>0.05),但自4 mg/L起可显著上调TNF-α蛋白的表达(P<0.05);30 mg/L 的AFB1在两方面均将其显著上调(P<0.05)。使用不同质量浓度的pBD-2处理细胞损伤模型,当pBD-2为2,8 mg/L时显著上调了TNF-α mRNA的表达(P<0.05),在4,6 mg/L时将mRNA下调至空白对照组水平(P<0.05),蛋白方面TNF-α的表达均有显著降低(P<0.05),在8 mg/L时将其下调至显著低于空白对照组水平(P<0.05)。结果表明,AFB1可上调IPEC-J2细胞TNF-α的表达促发炎症反应,pBD-2可重新下调TNF-α的表达以缓解该炎症反应,且以6 mg/L的pBD-2缓解作用最佳(图5)。

0.空白对照组;2P~8P.阴性对照组(2,4,6,8 mg/L pBD-2);30A.阳性对照组(30 mg/L AFB1);A2P~A8P.试验组(30 mg/L AFB1+2,4,6,8 mg/L pBD-2)
2.4.2IL-1β的表达变化 qPCR与Western blot结果显示,2,4,6,8 mg/L的pBD-2对IL-1β mRNA的表达均无显著影响(P>0.05),但可逐渐上调IL-1β蛋白的表达(P<0.05);30 mg/L的AFB1在两方面均将其显著上调(P<0.05)。使用不同质量浓度的pBD-2处理细胞损伤模型,IL-1β mRNA及蛋白的表达均有显著降低(P<0.05),其中4,6 mg/L的pBD-2可重新下调IL-1β mRNA的表达至空白对照组水平(P<0.05);6,8 mg/L的pBD-2将IL-1β蛋白下调至空白对照组水平(P<0.05)。结果表明,AFB1可上调IPEC-J2细胞IL-1β的表达促发炎症反应,pBD-2可重新下调IL-1β的表达以缓解该炎症反应,且以6 mg/L的pBD-2缓解作用最佳(图6)。

0.空白对照组;2P~8P.阴性对照组(2,4,6,8 mg/L pBD-2);30A.阳性对照组(30 mg/L AFB1);A2P~A8P.试验组(30 mg/L AFB1+2,4,6,8 mg/L pBD-2)
3 讨论
AFB1是最常见且毒性最强的霉菌毒素,常见于霉变动物饲料,长期摄入一定量的AFB1对动物消化道会造成严重损伤[13],给养殖业造成严重威胁。pBD-2作为动物体内的天然抗菌肽,除具有广谱抗菌和抗病毒的作用外,还可增强动物免疫力、修复损伤和促进伤口愈合[14]。由试验结果可知,与空白对照组相比,60 mg/L及更高质量浓度AFB1组细胞显著死亡,表明60 mg/L及更高质量浓度的AFB1对小肠上皮细胞具有致命毒性,可对肠黏膜造成严重损伤;PESTKA等[15]研究表明,低摄入量、短摄入时间及单次频率的霉菌毒素刺激,具有上调免疫应答的作用。20 mg/L AFB1组细胞存活率显著高于空白对照组,表明低质量浓度的AFB1可能具有免疫刺激作用[16],激发了细胞的免疫反应以清除毒素并促进细胞增殖。唐吉等[17]研究表明,药物剂量是影响药物效应的重要因素。不同剂量的同一药物可能会产生不同的作用,过高剂量反而会出现不良反应。2,4,6,8 mg/L的pBD-2显著提高了细胞存活率,表明适宜质量浓度的pBD-2具有促进小肠上皮细胞生长的作用,但10 mg/L的pBD-2表现出细胞毒性,因此pBD-2在生产养殖中的使用务必注意使用剂量。
AFB1在30 mg/L时会显著影响IPEC-J2细胞炎性因子TNF-α及IL-1β的表达变化,pBD-2可调节这种变化来缓解细胞的炎症反应。TNF-α作为具有多种生物效应的细胞因子,其主要作用是促进炎症反应和调节机体自身免疫[18],随着AFB1质量浓度逐渐升高,TNF-α mRNA的表达先明显降低,后显著升高,表明低质量浓度的AFB1激起了细胞的免疫反应,高质量浓度的AFB1使TNF-α过度表达,促进了细胞的炎症反应,当AFB1上调其表达后,适宜质量浓度的pBD-2可将其重新下调至正常水平。IL-1β是IL-1家族中的一种,在细胞因子中处于关键地位,不仅在免疫应答中至关重要,且广泛参与感染状态和炎症反应[19],其表达随AFB1剂量升高逐渐上升表明细胞受到AFB1影响出现了剂量依赖性的免疫应答或炎症反应,后在pBD-2的作用下得到缓解。以上结果表明pBD-2可通过降低TNF-α及IL-1β的表达缓解AFB1导致的炎症反应。
李宇华等[12]研究表明,药物使用存在明确的量效关系,较低剂量或许无法达到应有效果并可能存在耐药问题,过高剂量甚至可能出现毒性作用,且过低剂量和过高剂量均可能出现与预期相反的效果。孔令云等[20]研究表明,具有剂量毒性的不同物质共同作用时可能出现混合毒性,且混合毒性作用一般至少高于其中一种物质单独作用。使用pBD-2处理AFB1细胞损伤模型,在mRNA水平下调TNF-α与IL-1β的表达时均出现两者的表达先降低后升高的现象,此结果的出现可能是由于过低质量浓度的pBD-2未能达到消除细胞炎性因子过量表达的作用,仅起到一定程度的缓解作用,而较高质量浓度的pBD-2与AFB1出现混合毒性,再次激起了细胞的免疫应答。蛋白水平未出现这一现象,考虑蛋白与mRNA的作用不同,蛋白的产生以mRNA的存在为前提,mRNA最终通过蛋白发挥作用,两者相互调控,且mRNA水平与蛋白水平的表达存在时空特异性,在相关机制下mRNA与蛋白的表达量可能呈非线性相关[21]。但TNF-α与IL-1β一致的变化趋势共同说明了AFB1对IPEC-J2细胞的影响以及pBD-2在修复细胞损伤和缓解炎症反应中的关键作用。
综上所述,适宜剂量的pBD-2可通过调控炎性因子的表达来缓解AFB1对小肠上皮细胞造成的炎症反应,在一定程度上缓解了AFB1对消化道的损害。本研究为开发pBD-2作为预防AFB1对动物损害的药物或绿色饲料添加剂提供了理论依据。
