氨离子对奶牛子宫内膜上皮细胞凋亡和容受性的影响
2022-07-25李晓宇
秦 雪,冯 瑞,李 琦,李晓宇,郑 鹏,赵 骞
(东北农业大学 动物科学技术学院,黑龙江 哈尔滨 150030)
奶牛机体组织中氨基酸代谢产生的氨、经呼吸道进入体内的氨、以及瘤胃和肠道微生物分解生成的氨均可进入血液形成血氨。一般来说,吸收的氨进入消化道的外周静脉血液中,与内脏器官外周静脉血液汇聚后经血液循环运输到门静脉,最终流入肝脏。在肝脏中经尿素循环生成无毒的尿素,经血液循环运送至肾脏随尿液排出[1]。奶牛分娩以后,为了提高产奶量,通常饲喂高蛋白饲料,饲料的蛋白质组成不合理或蛋白质水平较高都会使动物肝脏的脱氨基作用和肾脏的排泄增加,导致动物的血氨浓度明显增加。血液中的氨通过简单的扩散进入到奶牛的生殖器官,会改变子宫和输卵管的内环境,使奶牛出现受胎率下降、繁殖力降低的现象[2-4]。然而,目前尚不清楚氨离子在子宫中的生理和病理作用。
奶牛的胚胎附植需要处于活化状态的胚泡和处于接受态的子宫相互作用,使胚胎滋养层和子宫内膜建立联系,成功进行附植[5-6]。子宫内膜的接受态是指子宫内膜处于一种允许胚泡黏附,直至完成胚胎附植的状态。胚胎的成功植入取决于具有容受性的子宫内膜和具有侵入性胚胎之间的同步协调反应[6-8]。因此,本试验使用氯化氨处理子宫内膜上皮细胞,研究氨离子对子宫内膜上皮细胞凋亡及其容受性的影响,为进一步明确血氨对胚胎附植期间的奶牛子宫的影响,探明血氨降低奶牛繁殖力的机理等提供理论参考。
1 材料与方法
1.1 氯化氨浓度的筛选解冻牛子宫内膜上皮细胞(实验室保存)[5],使用DMEM/F12(Hyclone)+ 10% 胎牛血清(FBS)(Gibco)+ 1% 双抗(10 000 U/mL的青霉素和10 g/L的链霉素,Biosharp,中国),在37.5℃、5% CO2条件下培养。细胞生长到80%以上时,传代到60 mm培养皿内,培养24 h后,使用氯化氨(Sigma)处理24 h,观察细胞形态的变化。氯化氨的浓度为0,1,5,10,15,25 mmol/L。同时使用96孔培养板培养细胞,使用CCK8检测不同浓度的氯化氨对细胞活力的影响。
1.2 细胞活力测定使用CCK8试剂盒,按照说明书的操作步骤检测细胞活力。具体步骤为:将细胞传代到96孔培养板内(每孔104个细胞),培养12 h后加入氯化氨,24 h后加入10 μL的CCK8试剂,37℃孵育2 h,然后在450 nm波长下检测,根据D450 nm值计算细胞活力。
1.3 细胞培养与处理解冻牛子宫内膜细胞,使用DMEM/F12 + 10% FBS + 1% 双抗,在37.5℃、5% CO2条件下培养。细胞生长到80%以上时,传代到60 mm培养皿内继续培养。24 h后,将培养皿分为2组,每组使用3个60 mm培养皿,分别为对照组和氨离子组(使用5 mmol/L氯化氨处理),继续培养24 h,用于接下来的试验分析。
1.4 实时定量RT-PCR分析参照文献[9]的方法,步骤为使用TRIzol(Invitrogen)试剂提取牛子宫内膜上皮细胞的总RNA,进行反转录,采用实时定量RT-PCR检测p53、细胞色素C(Cyto-c)、促凋亡蛋白(Bax)、抗凋亡蛋白(Bcl-2)、Caspase-8、Caspase-9、Caspase-3、血管内皮生长因子(VEGF)、白血病抑制因子(LIF)、表皮生长因子(EGF)和β-actin的表达。检测基因的引物序列见表1,由华大基因公司合成,内参基因为β-actin,用2-ΔΔCt法计算靶基因的表达水平。

表1 引物序列
1.5 免疫分析参照文献[5]的方法,将处理后的细胞用PBS洗涤,用胰蛋白酶消化进行收集,再次用PBS洗涤细胞2次,去除上清液后,加入150 μL RIPA裂解缓冲液进行蛋白的提取。用BCA蛋白检测试剂盒检测蛋白浓度。采用10% SDS-PAGE电泳分离蛋白质,转膜后,用5%脱脂奶粉封闭1 h,然后与一抗(p53、Bax、Cyto-c、Caspase-8、Caspase-9、Caspase-3、VEGF、LIF和β-actin;1∶1 000,Bioss公司,中国)在4℃过夜孵育。清洗膜3次,每次10 min,用二抗(HRP标记,1∶3 000,Bioss公司,中国)在室温下孵育1 h。洗涤3次,用ECL-Western blot检测系统检测(Amersham Biosciences,USA)。用Image J软件进行灰度分析。

2 结果
2.1 氨离子对牛子宫内膜上皮细胞形态的影响使用不同浓度的氨离子处理牛子宫内膜上皮细胞,24 h后进行观察,细胞显示凋亡特征,细胞质出现空泡(图1),随着氨离子浓度的增加,细胞凋亡逐步明显。

A.~F.0,1,5,10,15,25 mmol/L
2.2 氨离子对牛子宫内膜上皮细胞活力的影响使用CCK8检测了不同浓度的氨离子对细胞活力的影响,结果显示,随着氨离子浓度的增加,细胞活力逐渐降低,5 mmol/L的氨离子显著降低了细胞的活力(P<0.05),因此,在后续试验中,使用5 mmol/L的氨离子作为处理浓度(图2)。

相同字母表示组间差异不显著,不同字母表示组间差异显著。下同
2.3 氨离子对子宫内膜细胞凋亡基因表达的影响RT-PCR分析显示,氨离子可显著增加Bax、Caspase-3、Caspase-8和Caspase-9的mRNA表达水平(P<0.05),并显著降低了Bcl-2/Bax比例,而Bcl-2和p53的mRNA表达并没有显著改变(P>0.05)(图3)。Western blot分析显示,氨离子显著上调了Bax、Caspase-3、Caspase-8和Caspase-9的蛋白表达水平(P<0.05),对p53蛋白的表达无显著影响(P<0.05)(图4)。

图3 氨离子对子宫内膜上皮细胞凋亡基因mRNA表达的影响

图4 氨离子对子宫内膜上皮细胞凋亡蛋白表达的影响
2.4 氨离子对子宫容受性相关因子表达的影响RT-PCR分析显示,氨离子显著增加了LIF、VEGF和EGF 的mRNA表达水平(P<0.05)(图5)。Western blot分析显示,氨离子显著上调了LIF和VEGF的蛋白表达水平(P<0.05)(图6)。
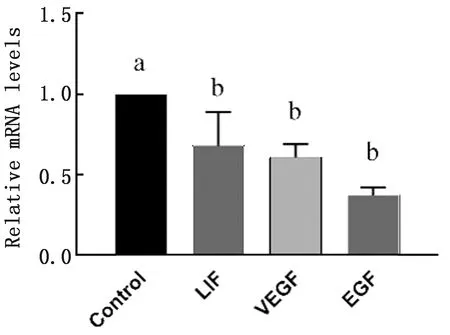
图5 氨离子对子宫内膜上皮细胞容受性相关基因mRNA表达的影响

图6 氨离子对子宫内膜上皮细胞容受性相关蛋白表达的影响
3 讨论
本研究以奶牛子宫内膜上皮细胞作为体外模型来研究氨对奶牛子宫的影响。用氨离子处理子宫内膜细胞24 h后,细胞显示凋亡特征,细胞质出现空泡,随着氨离子浓度的增加,细胞凋亡逐步明显。
RT-PCR分析显示,氨离子处理后,p53的mRNA和蛋白表达水平和对照组相比差异不显著,可能是5 mmol/L的氯化氨没有强烈的引起p53的激活。p53的mRNA和蛋白表达水平增加的趋势,也说明氨离子通过增强p53磷酸化水平增加了凋亡细胞的比例,p53的激活导致细胞周期停滞或上调促凋亡因子诱导细胞凋亡[10-11]。同时,Bcl-2/Bax比例显著下降,进一步说明氨离子可以诱导子宫内膜上皮细胞的凋亡,并且引起线粒体损伤。因为细胞凋亡途径是Bcl-2和Bax相互平衡的结果[12-13],在细胞稳定时,抗凋亡蛋白Bcl-2促使凋亡蛋白沉默,从而阻止细胞凋亡;在应激情况下,促凋亡蛋白Bax释放并转移到线粒体外膜,引起线粒体膜通透性增加及信号级联反应,最终导致细胞凋亡[14-15]。氨离子处理细胞后,Caspase-9和Caspase-3的表达和活化显著增加,是因为Bax诱导线粒体膜中Cyto-c释放,下游因子Caspase-9和Caspase-3被细胞色素C激活,引起线粒体凋亡途径而参与了细胞凋亡过程[16]。同时,氨离子处理细胞后,Caspase-8的表达显著增加,是因为细胞凋亡过程和外源性死亡受体通路有关,部分受体能够与Caspase-8结合并激活,构成了死亡诱导复合物,激活下游的Caspase-3和Caspase-9,进一步介导死亡受体诱导的细胞凋亡[17-18]。这些结果表明,氨离子通过Caspase依赖途径诱导奶牛子宫内膜上皮细胞的凋亡。
子宫内膜的容受性与内膜薄厚程度、内膜的形态和内膜的体积有关,同时又通过旁分泌及自分泌途径受很多生长因子的调控[19],各个因子之间相互作用构成一个复杂的网络体系,共同调节子宫内膜的各种变化,从而参与子宫内膜容受性的形成[20-22]。本试验结果表明,经过氨离子处理后,VEGF的mRNA和蛋白表达显著下降,表明氨离子显著降低了子宫的容受性,因为VEGF是子宫内膜再生的必不可少的关键因子,VEGF影响血管生成和血管通透性,子宫内膜容受性降低不利于胚胎着床[5]。LIF的mRNA和蛋白表达显著降低进一步说明氨离子降低了子宫内膜上皮细胞的容受性,因为LIF主要通过作用于子宫内膜上皮调节母胎免疫,使之对胚胎容受,是胚胎着床所必须的[23-24],LIF表达降低,进一步导致LIF相关通路功能紊乱或者免疫抑制和免疫不平衡状态,从而使子宫内膜容受性降低[24]。在胚胎附植期间,VEGF联系众多信号通路,子宫内膜微环境中的一些细胞因子,如 FGF、EGF和LIF等也可以通过自分泌和旁分泌的方式对VEGF的表达产生影响[25-27],因此,氨离子引起子宫内膜上皮细胞的凋亡和容受性降低的机制还需要进行更深入的研究。
综上所述,氨离子可诱导子宫内膜上皮细胞发生凋亡,从而导致子宫容受性的降低。
