禽腺病毒强毒(FAdV-4)WZ株对SPF鸡和SPF鸭的致病性比较
2022-07-25李利杰孙文杰王赛楠赵振超张世华陶明月高文明李新生
李利杰,孙文杰,刘 琳,王赛楠,赵振超,张世华,陶明月,高文明,李新生
(河南农业大学 动物医学学院,河南 郑州 450002)
包涵体肝炎-心包积液综合征(hepatitis hydropericardium syndrome,HHS)于1986年在巴基斯坦安卡拉地区首次报道,称为“安卡拉病”;因为心包积液后似荔枝,也称为“荔枝病”[1]。此后,该病在亚洲、南美洲、北美洲和欧洲等多个地区广泛传播。2015年,HHS在我国主要养鸡地区暴发[2]。给我国养禽业造成了巨大的经济损失。HHS主要引起3~6周龄仔鸡急性死亡,病死率为10%~80%,典型病变为:肝脏发生包涵体肝炎、心包内有淡黄色、胶冻样积液[3]。
在我国暴发的HHS是由高毒力禽腺病毒(fowl adenovirus,FAdV)引起的[4]。FAdV属于禽腺病毒科禽腺病毒属病毒,共分为Ⅰ、Ⅱ、Ⅲ 3个群[5]。其中Ⅰ群FAdV分为A、B、C、D、E 5个种,FAdV-1、FAdV-2、FAdV-3、FAdV-4、FAdV-5、FAdV-6、FAdV-7、FAdV-8a、FAdV-8b、FAdV-9、FAdV-10、FAdV-11共12个血清型[6]。12种血清型的FAdV均可引发禽类的肝炎、心包积液综合征或HHS。在我国鸡群流行感染引起HHS的病原属于Ⅰ群C种血清4型禽腺病毒(FAdV-4)[7]。
鸡是FAdV-4强毒最易感的自然宿主,包括肉鸡、商品蛋鸡和种鸡,在其他宿主中很少引起严重的临床发病和高病死率[8]。PAN等[9]从患有心包积液的病鸭体内分离出1株鸭源FAdV-4毒株,并在SPF鸡和SPF鸭上进行了致病性评价,发现其在鸡中可诱发严重的心包积液和导致10%的病死率,而在试验组鸭中均未观察到临床症状。FAdV-4强毒是否感染鸭并导致鸭发病和死亡还尚未见报道。因此,本试验分别经肌肉注射接种28日龄SPF鸭和28日龄SPF鸡高致病力鸡源FAdV-4毒株WZ株,对强毒攻击后鸡和鸭的临床症状、大体病变、存活率、体质量、组织病理学变化、内脏组织病毒载量以及泄殖腔排毒情况进行系统比较研究。
1 材料与方法
1.1 病毒和LMH细胞FAdV-4强毒WZ株由河南农业大学分离鉴定保存;LMH细胞购自ATCC(ATCC®CRL-2117TM)。
1.2 实验动物SPF种鸡蛋购自北京勃林格殷格翰维通生物技术有限公司;SPF种鸭蛋购自哈尔滨兽医研究所。种蛋均由本实验室按照相关标准孵化、饲养于SPF隔离器内。
1.3 病毒培养无菌条件下,将冻存的FAdV-4 WZ株肝组织剪碎,按质量比1∶4加入无菌PBS,充分研磨,制成20%肝组织匀浆,反复冻融3~5次后4 000×g离心10 min,取上清,加入青链霉素混合液使其终浓度分别为100 U/mL、100 g/L,4℃作用2 h,经0.45 μm和0.22 μm无菌滤器过滤后,取200 μL 20%肝组织上清接种至单层的LMH细胞,37℃感作1 h,弃去上清液,PBS清洗3次,加入一定量含2%胎牛血清的DME/F-12培养基,于37℃,5% CO2培养箱中培养,每24 h观察记录1次细胞病变情况,72 h后收获病毒液,反复冻融3次,离心去除细胞碎片后接种于新的LMH细胞。如此重复,在LMH细胞上连续传至F3代,收获病毒液,-80℃ 保存备用。
1.4 病毒毒价测定取上述F3代细胞病毒液用无血清DME/F-12培养基连续进行10倍倍比稀释(10-1~10-10)。取24 h左右长满单层LMH细胞的96孔细胞培养板,弃去原培养基,各稀释度分别接种8孔,每孔加入100 μL稀释好的病毒液,同时设置细胞对照孔。最后,每孔再加入100 μL含2%胎牛血清的DME/F-12培养基,37℃,5% CO2培养箱中培养。连续观察7 d,逐日记录细胞病变孔数,根据Reed-Muench法计算病毒的TCID50。
1.5 FAdV-4 WZ株对SPF鸡和SPF鸭的致病性取28日龄SPF鸡和SPF鸭各20只,分别随机分为攻毒组和对照组,10只/组,攻毒组胸部肌肉注射1 mL 含107.8TCID50的FAdV-4 WZ株F3代病毒液,对照组胸部肌肉注射1 mL PBS,各组均分开饲养,攻毒后连续14 d,每天称体质量、记录发病和死亡情况。死亡鸡只和鸭立即剖检,观察大体病变。
1.6 样品采集攻毒后1~14 d,随机抽取攻毒组和对照组各5只SPF鸡和SPF鸭,分别采集泄殖腔拭子。采集攻毒后病死鸡、鸭和攻毒后14 d未死亡鸡、鸭的心脏、肝脏、脾脏、肺脏、肾脏等组织样品,部分样品于室温下用4%甲醛溶液固定,剩余样品于-80℃保存备用。
1.7 病毒DNA提取和荧光定量PCR将1.6中-80℃ 保存的组织样品用PBS匀浆,4 000×g离心10 min,吸取组织上清;将1.6中采集的泄殖腔拭子分别用1 mL PBS于4℃浸泡1 h,8 000×g离心10 min,吸取上清液。根据说明书方法提取DNA。
参照文献[10]建立的FAdV-4 TaqMan实时荧光定量PCR方法,使用正向引物:5′-TCAGCAGGCCATCCAAC-3′,反向引物:5′-TGTCGAACA-CGCCATAGAG-3′,TaqMan探针:5′-FAM-ACCTGTGGACCATCCCGTTCAGT-TAMRA-3′。反应体系:2×Premix Ex Taq 10 μL,正、反向引物各0.4 μL,探针0.8 μL,模板DNA 2 μL,ddH2O 6.4 μL。反应条件:95℃预变性30 s,95℃变性5 s,60℃延伸20 s,共40个循环。测定SPF鸡和SPF鸭心脏、肝脏、脾脏、肺脏、肾脏等组织样品和泄殖腔拭子中FAdV-4的病毒载量,每个样品一式3份,进行荧光PCR方法鉴定。
1.8 组织病理学观察取1.6中固定的组织样品,进行常规处理,包埋于石蜡中,切成5 μm左右的薄片,经苏木精和伊红(HE)染色后使用光学显微镜观察各组织病理学变化。
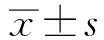
2 结果
2.1 F3代FAdV-4 WZ株可致LMH细胞稳定病变F3代FAdV-4 WZ株接种后24 h即可观察到LMH细胞皱缩变圆,折光性增强;接种后48 h可见细胞聚集成团状,似葡萄串,部分细胞崩解死亡(图1);接种后72 h约95%的细胞脱落崩解。

A..正常LMH细胞;B.接种后48 h LMH细胞
2.2 病毒毒价测定结果FAdV-4 WZ株经梯度稀释接种于LMH细胞,连续观察7 d,根据Reed-Muench法计算,F3代WZ株的TCID50为10-7.8/0.1 mL。
2.3 SPF鸡接种FAdV-4 WZ株后的临床症状和大体病变攻毒组SPF鸡在攻毒后1 d发病2只,死亡0只;攻毒后2 d全部发病,表现精神沉郁、羽毛蓬松、嗜睡、采食量减少和拉黄绿色稀便,并死亡8只;攻毒后3 d全部发病死亡(图2A)。攻毒后攻毒组体质量明显降低,与对照组SPF鸡相比差异显著(P<0.05)(图2B)。死亡鸡只剖检可见:心包内积有大量的水样或果冻样淡黄色渗出液,肝脏肿胀发黄、出血、易碎,肾脏肿大、出血(图3)。而注射PBS的对照组SPF鸡生长健康良好。
2.4 SPF鸭接种FAdV-4 WZ株后的临床症状和大体病变以同样剂量肌肉接种SPF鸭,攻毒后1~14 d,与注射PBS的10只对照组SPF鸭一样,攻毒组10只鸭精神、采食、粪便均正常,未表现出任何临床异常;体质量与对照组SPF鸭相比差异不显著(P>0.05);剖检也均未见病变(图2C,D,图4)。

A、B.分别为SPF鸡的存活和体质量曲线;C、D.分别为SPF鸭的存活和体质量曲线 *表示攻毒组与对照组SPF鸡的体质量差异显著(P<0.05)
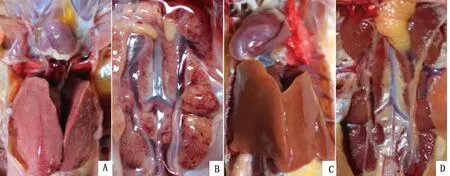
A.、B.攻毒组SPF鸡的心脏、肝脏和肾脏;C、D.对照组SPF鸡的心脏、肝脏和肾脏

A.、B.攻毒组SPF鸭的心脏、肝脏和肾脏;C、D.对照组SPF鸭的心脏、肝脏和肾脏
2.5 攻毒后SPF鸡和SPF鸭内脏组织病理学分析攻毒组SPF鸡的心脏、肝脏、脾脏、肺脏、肾脏和胸腺组织切片经HE染色可观察到明显的组织病理学损伤(图5)。心脏内可见心肌细胞周围间质性水肿、细胞间隙增大、中性粒细胞和单核细胞轻度浸润(图5A);肝实质细胞核内出现嗜碱性包涵体、间质出血、肝细胞核溶解坏死(图5B);脾脏间质广泛出血、淋巴细胞数量减少(图5C);肺部严重充血、终末细支气管扩张(图5D);肾间质大范围充血、肾小管上皮细胞从基底膜脱落坏死、淋巴细胞浸润(图5E);胸腺内淋巴细胞大量减少、局部坏死(图5F)。

A.心脏,间质性水肿、淋巴细胞浸润(100×);B.肝脏,出血、核内嗜碱性包涵体(400×);C.脾脏,淋巴细胞数量减少、广泛出血(100×);D.肺脏,严重充血(100×);E.肾脏,间质大范围充血、肾小管上皮细胞从基底膜脱落坏死(100×);F.胸腺,淋巴细胞大量减少、局部坏死(100×)
在攻毒组SPF鸭的内脏组织中均未观察到明显的组织病理学损伤(图6)。

A.~F.分别为攻毒组SPF鸭的心脏、肝脏、脾脏、肺脏、肾脏和胸腺组织
2.6 内脏组织病毒载量测定通过建立的TaqMan荧光定量PCR方法,在攻毒组SPF鸡的心脏、肝脏、脾脏、肺脏、肾脏、法氏囊、胸腺、气管、腺胃和小肠中均检出FAdV-4。肝脏的病毒载量最高,为4.66×107拷贝/μL,其次为小肠、肾脏、肺脏、脾脏、胸腺、腺胃、气管、法氏囊、心脏,且肝脏与其他组织的病毒载量相比差异极显著(P<0.01)(图7)。
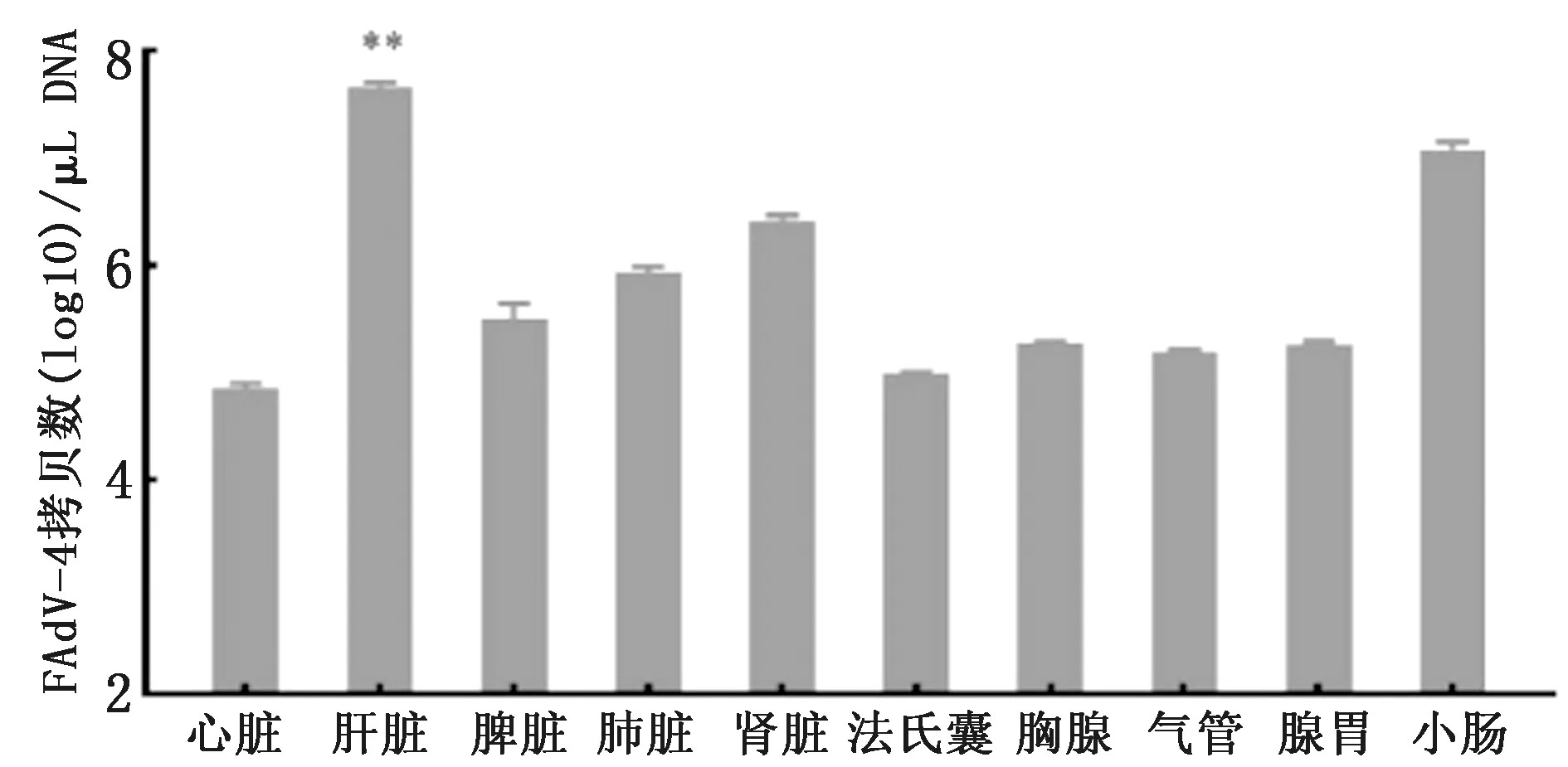
**表示肝脏与其他组织的病毒载量差异极显著(P<0.01)
而在采集的攻毒组SPF鸭内脏组织中均未检出FAdV-4。
2.7 泄殖腔排毒情况通过实时荧光定量PCR方法检测攻毒后1~14 d各组泄殖腔拭子中的病毒载量。攻毒组SPF鸡在攻毒后3 d内均可检测到排毒,且攻毒后2 d排毒量最高,为2.03×104拷贝/μL,对照组鸡均未检出FAdV-4排毒。攻毒3 d后攻毒组SPF鸡全部死亡(图8)。

图8 攻毒组SPF鸡泄殖腔拭子中FAdV-4的病毒载量
攻毒组SPF鸭在攻毒后1~14 d与对照组鸭结果相同,从拭子中均未检出FAdV-4排毒。
3 讨论
HHS是由FAdV-4引起的鸡的一种急性传染病,潜伏期为3~5 d,感染鸡只突然发病,急性死亡且死亡率高,具有异常激进的临床过程[11]。死亡鸡只剖检常见肝脏炎症和严重的心包积液,通常认为感染鸡大多死于心力衰竭[12]。2015年以来HHS在我国大范围暴发,给我国家禽业健康发展造成了巨大威胁。近来,SHEN等[13]报道在鸭、鹅、鸳鸯和鸵鸟中分离鉴定出FAdV-4,并且呈现出与鸡相似的临床症状。CHEN等[14]研究表明从樱桃谷鸭中分离的FAdV-4对25日龄左右的鸭具有高致病性。这些研究提示FAdV-4在不同动物种间存在跨物种传播的可能性。于是,很多养鸭企业开始使用FAdV-4灭活疫苗或亚单位疫苗免疫鸭,以预防鸭感染FAdV-4,从而避免损失。鸡属于动物界脊索动物门鸟纲鸡形目雉科,鸭属于动物界脊索动物门鸟纲雁形目鸭科鸭亚科[15]。鸡和鸭属于不同目,不同科,不同种动物。通常一种动物易感的病原,另一种动物可能并不一定易感,这样可以避免一种病原微生物同时对多种动物造成感染。例如,H5、H7亚型高致病性禽流感病毒,对鸡具有高致病性,可以导致易感鸡的发病率和病死率接近100%,而对鸭和鹅等则致病力较弱,尽管偶可感染,但较少导致发病和死亡[16]。
导致鸡高病死率的FAdV-4强毒是否对鸭也具有同样高的致病性,本研究选取28日龄的SPF鸡和SPF鸭,选择同样的最佳攻毒途径(肌肉注射)及高致死剂量,以评价当前流行的对鸡呈现强毒力的FAdV-4对鸭的致病性和致死率等。结果显示,鸡源FAdV-4强毒WZ株可致攻毒组SPF鸡发生严重的HHS,肝脏肿大,心包内聚积有大量的淡黄色渗出液;攻毒后体质量与对照组鸡相比显著降低(P<0.05);攻毒后3 d感染鸡只全部死亡。组织病理学观察可见肝细胞核内有嗜碱性包涵体,免疫器官脾脏和胸腺中淋巴细胞数量减少。攻毒后1 d即可在泄殖腔拭子中检测到排毒,攻毒后2 d检测到的排毒量最高,为2.03×104拷贝/μL。在攻毒组SPF鸡的心脏、肝脏、脾脏、肺脏、肾脏、法氏囊、胸腺、气管、腺胃和小肠中均可检出FAdV-4,其中,肝脏的病毒载量最高,为4.66×107拷贝/μL,表明FAdV-4可在鸡多种组织中快速入侵和复制,且肝脏是其主要的靶器官,这与YU等[17]的研究报道一致。而同样条件下,攻毒组SPF鸭在14 d的观察期内没有出现临床症状和死亡;体质量持续上升,且与对照组鸭相比差异不显著(P>0.05);剖检未见病变及组织病理学损伤;在其组织样品和泄殖腔拭子中均未检出FAdV-4。刘吉山等[18]报道鸭源FAdV-4可致30日龄鸡只死亡50%,鸭源FAdV-4可能在鸭体内多为缺乏临床症状的隐性感染,但在鸡体内则可引起严重的HHS和死亡。本研究结果表明,对SPF鸡具有强致病性且致死率高达100%的FAdV-4 WZ株,即使经肌肉注射,鸭也不感染,不发病。
综上所述,当前对我国养鸡业造成严重威胁的FAdV-4强毒株只感染鸡不感染鸭;在鸭群接种来源于鸡的FAdV-4流行毒株的灭活疫苗和亚单位疫苗预防鸭感染FAdV-4,缺乏完整的病原学和血清学等流行病学依据。对鸡呈现强毒力的FAdV-4毒株对鸭无致病性的内在机制,尚需进一步研究。
