BVDV Erns抗体ELISA检测方法的建立及初步应用
2022-07-25刘勃兴王利丽吴同垒高荣菊张志强史秋梅
刘勃兴,刘 畅,王利丽,付 祥,吴同垒,刘 洁,高荣菊,张志强*,史秋梅*
(1.河北科技师范学院 河北省预防兽医学重点实验室,河北 秦皇岛 066004;2.河北省唐山市乐亭县农业农村局,河北 唐山 063600)
牛病毒性腹泻病毒(bovine viral diarrhea virus,BVDV)属于黄病毒科瘟病毒属单股RNA囊膜病毒[1-3]。我国BVDV最早发现于1980年[4],给我国肉牛和奶牛养殖业造成了严重的经济损失。DIAO等[5]对1987—2019年国内牛群中的BVDV进行了Meta分析,发现我国牛群BVDV的感染率约为36.0%,其中,新疆地区BVDV感染率(67.5%)最高,西北地区样品中BVDV抗原阳性率最高。BVDV感染牛临床可出现消化道、呼吸道、生长繁殖异常等症状,病情严重时可导致病牛死亡,还可以造成无任何示病症状但危害更大的持续感染(persistently infected,PI),据估计,70%~90%的BVDV感染病例无临床表现[6-8]。
BVDV的检测方法大致可分为病原学检测和血清学检测两类,其中BVDV抗体血清学检测可辅助抗原检测,有助于牛群中PI鉴定和评估接种疫苗牛群的免疫接种效果。目前BVDV的血清学检测方法有ELISA、抗体中和试验和琼脂扩散试验等,其中ELISA是世界动物卫生组织推荐的BVDV检测方法之一,也是在实验室诊断中的常用方法。我国BVDV抗体ELISA商品化检测试剂盒的品牌和种类较少,导致BVDV抗体检测成本较高。国内对BVDV抗体ELISA检测方法已开展了大量的研究,其中基于BVDV结构蛋白E2[9-14]、Erns(E0)[9,15-17]这两种囊膜蛋白和非结构蛋白NS3[9,17]蛋白建立的间接ELISA方法居多,此外,抗BVDV纳米抗体双抗夹心ELISA[18]、PPA-ELISA[19]、Dot-ELISA[20]等ELISA类型也应用于BVDV的抗体检测。
为了解河北地区牛群BVDV抗体阳性率,本研究构建了BVDV HB-1株的Erns蛋白(gp48基因)的原核表达载体,并经原核系统表达了Erns蛋白,以该蛋白为包被抗原建立BVDV抗体间接ELISA检测方法,并应用该方法检测河北地区牛血清样品的BVDV抗体阳性率。
1 材料与方法
1.1 病毒株、质粒和血清BVDV HB-1株,分离自河北肉犊牛腹泻样品,由本研究室保存;pET-28a质粒、BVDV阳性血清和阴性血清、牛传染性鼻气管炎病毒(IBRV)阳性血清、牛布鲁菌阳性血清、牛轮状病毒(BRV)阳性血清、牛冠状病毒(BCoV)阳性血清、口蹄疫病毒(FMDV)阳性血清均由河北省预防重点实验室提供。
1.2 引物的设计与合成根据BVDV HB-1株的Erns蛋白基因(gp48)序列,应用Primer Premier 5.0软件设计用于Erns蛋白基因(gp48)扩增的引物。E-BamHⅠ:5′-CGGGATCCGAGAACATAACGCA-ATGGAACTTGC-3′;E-SalⅠ:5′-GCGTCGACTGCATATGCCCCAAACCATGTC-3′。
1.3 主要试剂病毒RNA快速提取试剂盒购自北京艾德莱科技有限公司;SalⅠ、BamHⅠ限制性内切酶购自NEB公司;明胶、牛血清白蛋白 BSA-V、IPTG、羊抗小鼠IgG-HRP购自北京索莱宝科技有限公司;SDS-PAGE Gel Kit、eECL Western blot Kit、His-Taggde Protein Purification Kit购自北京康为世纪(CWBIO)生物科技有限公司;兔抗牛IgG/HRP血清、鼠抗His tag antibody购自北京博奥森生物技术有限公司;Gel Extraction Kit、Plasmid Mini KitⅠ购自美国OMEGA公司;BVDV ELISA抗体检测试剂盒购自爱德士(IDEXX)瑞士生物科技有限公司
1.4 Erns(gp48)基因的PCR扩增、序列分析及原核表达载体构建与鉴定用病毒RNA快速提取试剂盒提取感染BVDV HB-1的MDBK细胞培养物中的病毒RNA,反转录为cDNA,以cDNA为模板,用合成gp48扩增引物进行PCR并回收纯化。将目的基因克隆至pMD19-T载体,构建重组质粒pMD19-T-gp48,转化至DH5α感受态细胞,涂布于含氨苄青霉素的LB培养基上培养,挑取单菌落用gp48基因扩增引物进行PCR检测,阳性菌落送至生工生物工程(上海)股份有限公司测序。从NCBI下载BVDV参考株的Erns基因序列并用Lasergene.v7.1中Editseq软件翻译为氨基酸序列,用Megalign软件进行同源性比对并建立发育进化树。在确认获得的gp48序列无移码突变后,将pET-28a和pMD19-T-gp48质粒经BamHⅠ和SalⅠ双酶切,回收目的片段构建pET-28a-gp48重组载体,转化至BL21感受态细胞,涂布于含卡那霉素的LB培养基,挑取单菌落进行双酶切与测序鉴定。
1.5 重组Erns蛋白的原核表达、纯化及Western blot鉴定将pET-28a-gp48/BL21接种于含卡那霉素的LB液体培养基在37℃恒温摇床培养至D600 nm值为0.4~0.6,加入IPTG至终浓度为1 mmol/L,37℃诱导6 h,离心收集菌液,用PBS重悬菌泥超声破碎,收集上清和沉淀,用SDS-PAGE鉴定重组蛋白的表达形式并用His-Taggde Protein Purification Kit纯化蛋白。以鼠抗His tag antibody(1∶1 000)为一抗,羊抗小鼠IgG-HRP血清(1∶5 000)为二抗,Western blot鉴定重组蛋白。
1.6 BVDV抗体间接ELISA检测方法的建立及优化采用方阵滴定法确定。蛋白包被质量浓度分别为每孔包被20,40,80,160,320 ng,血清按照1∶25,1∶50,1∶100,1∶200,1∶400进行稀释。基于上述的最佳条件,分别进行包被条件(37℃包被0.5,1.0,1.5,2.0 h,4℃包被过夜)、封闭液(5%脱脂奶、2% BSA和1%明胶)、封闭时间(37℃封闭0.5,1.0,1.5,2.0 h)、血清孵育时间(37℃孵育0.5,1.0,1.5,2.0 h)、二抗稀释度(1∶5 000,1∶10 000,1∶20 000,1∶40 000,1∶80 000)、二抗孵育时间(37℃孵育0.5,1.0,1.5,2.0 h)和显色时间(37℃显色5,10,15,20 min)的条件优化。



1.10 重复性试验分别验证建立的ELISA方法的批内和批间重复性。批内重复性试验:分别用同批次的重组Erns蛋白包被并封闭后的ELISA板检测4份BVDV阳性和4份BVDV阴性的牛血清;批间重复性试验:分别用重组Erns蛋白包被并封闭后1,14,28 d的ELISA板检测BVDV阳性和BVDV阴性的牛血清。每个血清做3个平行孔,测定D450 nm值,计算不同批次内的变异系数(CV),评估本研究建立的ELISA方法的批间重复效果。
1.11 与商品化试剂盒比较试验以建立的间接ELISA方法和IDEXX BVDV的ELISA抗体检测试剂盒同时检测河北某牛场的90份牛血清,比较2种方法检测结果并计算符合率,计算方法见表1。
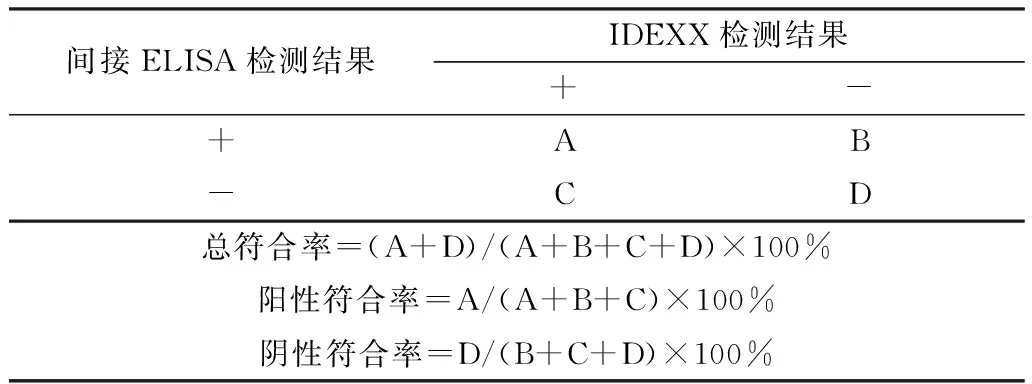
表1 符合率计算方法
1.12 临床样品的检测用本研究建立的间接ELISA方法检测河北地区牛场的血清样品477份,统计并分析牛血清样品的阳性率。
2 结果
2.1 Erns(gp48)基因的PCR扩增、序列分析及原核表达载体构建与鉴定以提取的BVDV HB-1株感染细胞的RNA,反转录合成cDNA,PCR扩增gp48基因。结果显示,在681 bp出现目的条带,与预期结果一致(图1A)。序列测定与比对分析结果显示,BVDV HB-1株与NCBI数据库国内的BVDV-1型参考株的Erns氨基酸序列同源率为96.0%~99.1%,与国外BVDV-1型的Erns氨基酸序列同源率为92.4%~95.6%,与国内外BVDV-2型的参考株Erns氨基酸序列同源率为79.1%~81.3%。进化树分析结果显示,BVDV HB-1株Erns氨基酸序列与国内的BVDV-1型的Erns氨基酸序列属于同一个大分支,且与相应参考株距离较近,其次距离较近的BVDV株为国外的BVDV-1型参考株,而国内外3株BVDV-2型的参考株处于另一个大分支且距离最远(图2)。序列分析结果表明,BVDV HB-1株Erns氨基酸序列与国内基因1型BVDV的同源性较高,具有作为诊断试剂研发实验材料的潜力。

M1.DL2000 DNA Marker;M2.DL5000 DNA Marker ;1.gp48 基因;2.阴性对照;3.pET-28a-gp48经 BamHⅠ/SalⅠ酶切产物;4.pET-28a

红色代表本研究BVDV毒株;蓝色代表国外BVDV毒株
构建的重组质粒pET-28a-gp48经BamHⅠ和SalⅠ双酶切,得到约681 bp的基因片段和约5 300 bp的质粒片段,与预期结果一致(图1B)。测序结果显示,基因序列无移码、突变,表明成功构建重组质粒pET-28a-gp48。
2.2 重组Erns蛋白的原核表达、纯化及Western blot鉴定将pET-28a-gp48重组质粒转化至BL21(DE3)感受态细胞,经IPTG诱导后用SDS-PAGE鉴定。结果显示,在约33 kDa处有目的蛋白条带,与预期蛋白大小一致,重组Erns蛋白以包涵体形式表达(图3A)。用His-Taggde Protein Purification Kit纯化蛋白,结果显示,纯化后仅在33 kDa出现目的条带,无杂带(图3B)。Western blot鉴定结果显示,在33 kDa处出现目的条带(图3C),表明成功获得重组Erns蛋白,且试剂盒纯化蛋白效果较好。

M.蛋白Marker;1.经IPTG诱导后菌体裂解物;2.菌体裂解物上清;3.菌体裂解物沉淀;4.阴性对照;5.纯化前的Erns 蛋白;6.纯化后的Erns 蛋白;7.阴性对照;8.重组 Erns
2.3 BVDV抗体间接ELISA检测方法的建立及优化以重组的Erns蛋白作为包被抗原建立的BVDV抗体间接ELISA检测方法经条件优化试验,最终确定的Erns蛋白包被、封闭、血清、二抗(兔抗牛IgG/HRP血清)及显色条件见表2。

表2 BVDV抗体间接ELISA检测方法反应条件优化结果
2.4 临界值的确定用优化后的间接ELISA方法检测临床30份BVDV阴性血清,结果显示,30份阴性血清D450 nm呈正态分布,经计算临界值为0.326,即待检血清D450 nm高于0.326判定为阳性,D450 nm低于0.326判定为阴性(图4)。
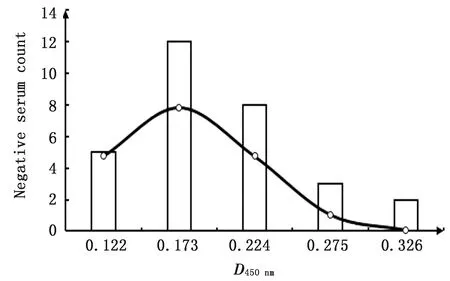
图4 30份阴性血清D450 nm的正态分布图
2.5 特异性试验特异性试验结果显示,除BVDV阳性血清样品(D450 nm=1.204)检测结果为阳性,其余病原阳性血清检测结果(D450 nm<0.326)均为阴性(图5),表明本研究建立的间接ELISA抗体检测方法具有较强特异性,能特异性检测出BVDV阳性血清。

图5 特异性试验结果
2.6 敏感性试验用建立间接ELISA方法分别检测不同稀释度的BVDV阳性血清。结果显示,经1∶1 600稀释BVDV阳性血清后检测结果仍为阳性(图6),表明本研究建立的间接ELISA抗体检测方法具有较高的敏感性。
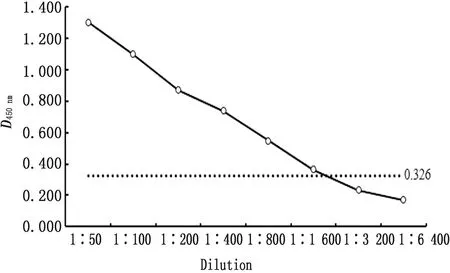
图6 敏感性试验结果
2.7 重复性试验用4份BVDV阳性血清和4份BVDV阴性血清分别进行批内和批间重复性试验。结果显示,8份血清检测数据的批内CV为1.88%~9.61%,批间CV为0.82%~9.36%,重复性试验的CV均低于10%(表3),表明本研究建立的间接ELISA抗体检测方法具有较好的重复性。

表3 重复性试验结果(n=8) D450 nm
2.8 与商品化试剂盒比较试验分别用建立的间接ELISA方法和IDEXX BVDV 的ELISA抗体检测试剂盒对河北某牛场的90份牛血清进行检测。结果显示,IDEXX试剂盒检出阳性样品72份,阴性样品18份,本研究建立的方法检出阳性样品72份,阴性样品18份。2种方法的总符合率为93.33%,阳性符合率92.00%,阴性符合率71.43%(表4)。结果表明,本研究建立的方法与IDEXX试剂盒符合率较高,具有较高的准确性。
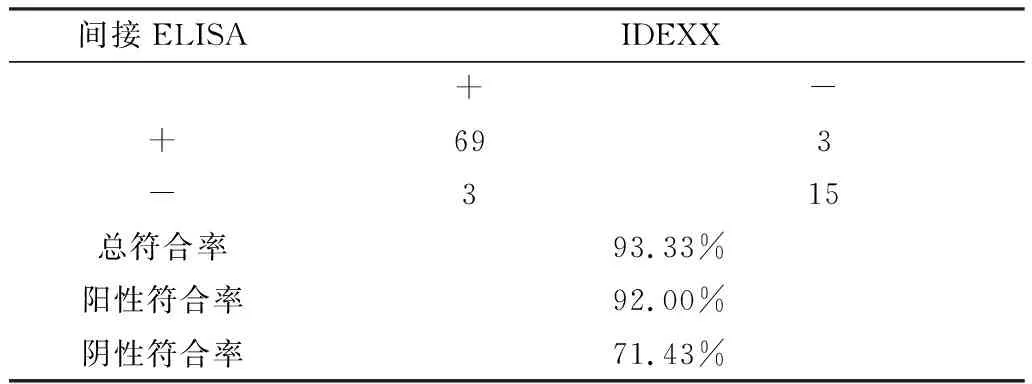
表4 与商品化试剂盒比较结果
2.9 临床样品的检测结果应用建立的间接ELISA方法检测河北地区牛场的血清样品。结果显示,接种BVDV疫苗免疫牛场的牛血清样品BVDV抗体检测阳性率为30.43%~92.86%,而未接种BVDV疫苗免疫牛场的牛血清样品BVDV抗体检测阳性率为0%~100%(表5),表明建立的BVDV抗体ELISA检测方法能应用于临床样品检测。在接种疫苗免疫的牛场BVDV抗体阳性率明显高于未接种疫苗免疫的牛场,未接种BVDV疫苗免疫的牛场检测出BVDV抗体阳性血清,表明存在BVDV感染。

表5 临床样品检测结果(n=477)
3 讨论
BVDV-1b基因型是全球检出率最高的BVDV基因型,在我国,该基因型也是BVDV主要流行的基因型之一,因此,该基因型常作为疫苗和诊断试剂的试验株。Erns是BVDV的囊膜蛋白之一,在病毒吸附宿主细胞、抑制宿主IFN的产生等方面有着重要的作用[21]。更重要的是,Erns可诱导宿主产生中和抗体,据报道,在PI动物的血清中Erns抗体质量浓度可高达50 μg/L[22]。因此,Erns是BVDV疫苗和诊断试验研制的靶位蛋白之一。本试验BVDV HB-1株分离自河北肉犊牛腹泻样品,基因型为我国主要流行的基因型BVDV-1b,具有作为诊断试剂研发的潜力。进一步对HB-1株的Erns氨基酸序列进行分析,发现BVDV HB-1株的Erns氨基酸序列与NCBI上国内BVDV-1型的参考株同源率为96.0%~99.1%,同源性极高,可作为BVDV抗体ELISA检测方法的包被抗原。因此,本研究构建了pET-28a-gp48,在BL21(DE3)感受态细胞进行原核表达,成功获得了重组Erns蛋白。
本研究以重组Erns蛋白作为包被抗原建立BVDV抗体间接ELISA检测方法。经条件优化试验,最终确定ELISA反应条件:重组Erns包被质量浓度为40 ng/孔,包被温度和时间为4℃过夜;封闭液为1%明胶溶液,封闭时间为2 h(37℃);血清稀释倍数为100倍,血清孵育时间为1 h(37℃);二抗稀释倍数为40 000倍,二抗孵育时间为0.5 h(37℃);显色时间为10 min(37℃);临界值为0.326(D450 nm)。进一步对该方法的特异性、灵敏度和重复性进行验证,结果显示:该方法能特异性识别BVDV阳性血清和阴性血清,而对BRV、IBRV、FMDV、BCoV、牛布鲁菌共计5种在牛常见的细菌和病毒性病原阳性血清检测结果均为阴性,表明该方法具有较好的特异性;当血清经1∶1 600稀释后结果仍为阳性,表明该方法具有较高的灵敏度;批内和批间重复试验的CV均低于10%,表明该方法具有较好的重复性。用IDEXX的BVDV抗体检测试剂盒与本研究中建立的方法同时检测某牛场的血清样品,2种方法的总符合率为93.33%,阳性符合率92.00%,阴性符合率71.43%。在国内同样基于Erns蛋白建立的BVDV抗体ELISA检测方法中,本研究建立的方法敏感性与肖盛中等[15]和丁金花等[16]建立方法的敏感性(1∶1 600)相同,比陈瑞红[9]建立方法的灵敏度(1∶640)高;重复性上,本研究和研究报道[9,15-16]的重复性数据相似,批内和批间CV均小于10%;与其他方法进行符合试验,本研究(93.33%)高于肖盛中等[15](86%)、丁金花等[16](88.67%)、陈瑞红[9](88.1%)建立的方法。但阴性符合率(71.43%)偏低,与阴性样品数量少有关。
应用建立的间接ELISA方法初步对河北地区18个牛场的477份血清样品进行检测。其中,18个牛场中有4个奶牛场,且均接种了BVDV灭活疫苗(占比100%,4/4),而仅有2家肉牛场接种疫苗(占比11.76%,2/14)。在接种疫苗的牛场中,抗体阳性率为30.43% ~ 92.86%,表明在接种疫苗的牛场中,BVDV抗体阳性率和抗体水平存有不同,部分牛场的抗体阳性率低于50%,需及时补免。BVDV灭活疫苗在我国上市时间较短,应用的范围较小,但奶牛场对该病的预防接种意识明显高于肉牛场。在未接种疫苗的14个肉牛场中,阳性血清占比明显低于接种免疫后的牛场,其中6个肉牛场的阳性血清占比为0%,仅有1个承德肉牛场的阳性血清占比达100%,其余阳性血清占比均低于50%。在未接种BVDV疫苗的牛场中检测到BVDV抗体,表明该场可能存在感染BVDV或PI牛,应结合RT-PCR等检测方法进一步确认这些牛场的肉牛是否存在BVDV感染。
