不同佐剂伪狂犬病病毒主要抗原决定簇gBb亚单位疫苗免疫小鼠安全性及免疫效力测定
2022-07-25郭广君吕素芳王文秀李振伟谢金文张翠花沈志强
郭广君,韩 强,吕素芳,王文秀,李 峰,李振伟,谢金文,张翠花,沈志强
(1.山东省滨州畜牧兽医研究院 山东省畜禽用蜂胶疫苗研究开发推广中心,山东 滨州 256600;2.山东绿都生物科技有限公司,山东 滨州 256600)
伪狂犬病(pseudorabies,PR)又称奥耶斯基氏病(Aujeszky's disease),是由伪狂犬病病毒(pseudorabies virus,PRV)引起的包括多种病畜和野生动物共患的一种急性传染病[1]。猪是该病的自然宿主和贮存者,可引起新生仔猪大量死亡,育肥猪引起明显的呼吸道症状,妊娠母猪流产,产死胎和木乃伊胎等症状。该病可造成巨大的经济损失,成为严重危害养猪业的重大传染病之一。自1902年发现以来,PR在全球范围内流行,欧、美等国家20世纪90年代启动根除计划,先后经历30多年,成效显著。在我国,已开展实施PRV净化工作。PRV基因组可编码70种蛋白,目前已经鉴定了11种糖蛋白,其中gB(glycoprotein B)是疱疹病毒中最为保守的蛋白和最主要的保护性抗原之一,能刺激机体产生补体非依赖性的中和抗体及特异性细胞免疫应答反应[2],对病毒入侵细胞、病毒复制、细胞融合及细胞间传播来说是必需的;同时gB糖蛋白也是重要的靶标抗原,参与病毒抗体中和、补体介导的抗体依赖性细胞的溶解及抗体依赖性细胞毒性[3-5]。
随着世界范围内动物福利要求和我国养猪业集约化水平的提高,工业化水平的迭代升级和大规模生产成本的下降,下游纯化工艺的日臻成熟,亚单位疫苗的研发和新型免疫佐剂的筛选愈加迫切。基因工程亚单位疫苗主要通过克隆表达病原菌保护性抗原,通过分离、纯化、修饰或包装等,加入免疫增强剂或佐剂而制成。这类疫苗含有病原菌主要保护性抗原成分。该类疫苗优点在于降低临床副反应、节约生产成本、提高经济效益。亚单位疫苗抗原常用的表达系统包括大肠杆菌、酵母菌和昆虫杆状病毒载体等[6-9]。gB基因在疱疹病毒成员中属于最保守的糖蛋白基因,在不同的疱疹病毒之间,gB蛋白的功能可相互取代[10]。其基因大小约2.8 kb,编码913个氨基酸。gB蛋白C端的99个氨基酸位于跨膜的与细胞质接触的一侧。gB蛋白N端58个氨基酸为信号肽序列,成熟的gB蛋白C端有3个疏水区,其中最后一个疏水区为跨膜区(74~808 aa)。gB以二硫化物连接的三聚糖蛋白复合体形式存在,即gBa、gBb和gBc,大小分别为855 aa(59~913 aa)、444 aa(59~502 aa)和411 aa(503~913 aa)。gBb和gBc是gBa剪切后的产物[11-12]。根据gB蛋白特点,本试验以gBb为靶标进行原核表达,通过不同佐剂配制PRV gBb亚单位疫苗,评价其安全性及免疫效力,探讨其作为候选亚单位疫苗的技术指标,为PR防控和净化提供新的思路和方法。
1 材料与方法
1.1 实验动物体质量18~22 g SPF级昆明小鼠,购自济南朋悦实验动物繁育有限公司。
1.2 毒株及血清PRV SA强毒株为实验室分离、鉴定并保存备用。PRV阳性血清、阴性血清购自中国兽医药品监察所,由山东省兽医生物技术重点实验室保存备用。
1.3 主要试剂T4DNA-ligase-内切酶、BamHⅠ和SalⅠ购自New England Biolabs(NEB)公司;Primix TaqTM(LA TaqtmVersion 2.0)购自TaKaRa 公司;pET-28a表达载体购自北京全式金生物技术有限公司;大肠杆菌BL21感受态细胞由实验室自制;卡那霉素、辣根过氧化酶标记的抗猪IgG购自Sigma公司;病毒DNA提取试剂盒、胶回收试剂盒和质粒提取试剂盒均购自Omega公司;白油佐剂购自爱得温特生物科技(北京)有限公司;铝胶佐剂(M402)购自成都依思康医药科技有限公司;蜂胶佐剂、霍乱弧菌菌影(VCG)由山东绿都生物科技有限公司提供;Poly I:C佐剂(PIC)由加拿大萨斯喀彻温大学安德鲁教授提供。
1.4 gB主要抗原决定簇的表达与鉴定
1.4.1引物设计 根据已发表的Bartha K-61株全基因序列,GenBank登录号:JF797217.1,设计1对特异性引物扩增PR SA强毒株gB基因片段,在上、下游引物分别加BamHⅠ和SalⅠ酶切位点。引物序列gB-F:5′-CGCGGATCCATGGCGGCCGTGA-CGCGGGCCGCCTCGGCCT-3′;gB-R:5′-ACGC-GTCGACCTAGCTCCACCTGCTGGAAGCGCC-CGGG-3′。引物由上海捷瑞生物工程有限公司合成。
1.4.2重组表达质粒的构建 以PRV SA强毒株基因组为模板,gB-F、gB-R为上、下游引物,进行PCR扩增,获得gB基因片段。经BamHⅠ和SalⅠ进行双酶切,连接到原核表达载体pET-28a中,构建原核重组表达质粒pET-28a/gB,转化至BL21感受态细胞,备用。
1.4.3gB主要抗原决定簇的原核表达及鉴定 将阳性单菌接种于10 mL LB/K+培养液中,37℃、180 r/min过夜培养;将过夜培养菌液按1∶100接种于1 L LB/K+培养液中,37℃、180 r/min培养至菌液D值为0.5时,加入终浓度为0.2 mmol/L的IPTG 25℃诱导4 h,4℃、12 000 r/min瞬时离心收集菌体。样品经超声破碎、高速离心,取上清及沉淀制备样品,经SDS-PAGE电泳,考马斯亮蓝染色检测蛋白的表达情况。利用BSA法进行蛋白含量测定。利用Western blot鉴定目的蛋白的反应原性。
1.5 疫苗的配制利用gB蛋白和不同佐剂,配制亚单位疫苗。gB-白油佐剂(gB/Oil)按1∶3比例;gB-纳米铝胶佐剂(gB/M402)按1∶3比例,其中氢氧化铝终质量浓度为2.5 g/L;gB-蜂胶佐剂(gB/Propolis)按1∶3比例,其中蜂胶含量为9.0 g/L;gB-VCG菌影佐剂(gB/VCG)按1∶3比例,其中VCG含量为500.0 mg/L;gB-Poly I∶C佐剂(gB/PIC)按1∶3比例,其中Poly I∶C含量为200.0 mg/L;gB-复合因子佐剂(gB/rINF)按1∶3比例,其中rINF含量为250.0 mg/L。同时gB蛋白组及PBS组做对照,各疫苗组gB蛋白终质量浓度为250.0 mg/L。各疫苗组加入7/10 000甲醛灭活,无菌检验合格,4℃保存备用。
1.6 疫苗免疫昆明小鼠选取体质量18~22 g SPF级昆明小鼠230只,疫苗组每组10只,对照组10只。具体分组及免疫按表1进行。疫苗组①组免疫1次;②组于15 d进行第2次免疫,35 d后进行攻毒PRV SA强毒株,皮下注射病毒液0.2 mL(含有100 TCID50)。
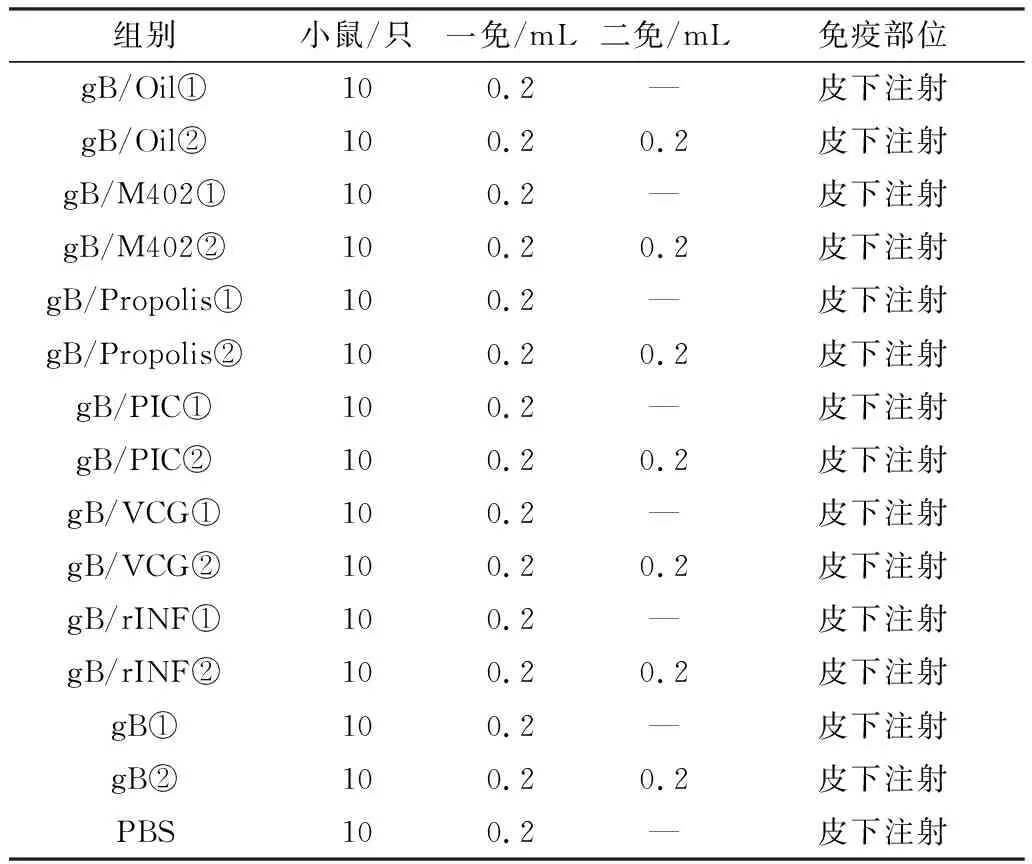
表1 小鼠试验分组及免疫程序
1.7 临床症状观察与体质量测定观察小鼠的精神、采食情况42 d。分别在免疫前、后 7,14,21,28,35,42 d对试验小鼠分别测体质量,统计并分析各组增重情况。
1.8 免疫效力评价
1.8.1利用ELISA方法检测疫苗免疫后不同时间体液抗体水平情况 PRV gB蛋白按照100 ng/孔包被96孔板,用于小鼠血清ELISA检测。分别在免疫前、后 7,14,21,28,35,42 d通过断尾方法采血,分离血清,-40℃保存备用。用PRV阳性血清和PRV阴性血清做对照,PBS缓冲液作为空白对照。取gB蛋白,按照100 μg包被ELISA酶标板,备用。按照常规方法进行,在波长630 nm下测定和记录每孔的D值。结果判定:P/N值≥2.1,判定该检测样品为阳性;P/N值<2.1,判定该检测样品为阴性。
1.8.2利用PRV SA强毒株进行攻毒保护力试验 取疫苗②组小鼠35 d进行攻毒,每小鼠皮下注射攻毒菌液0.2 mL(100 TCID50)。按照《中国兽药典》相关规程,攻毒后观察7 d,观察各组临床症状并统计小鼠死亡数。
1.9 数据统计分析使用SPSS统计分析软件,对上述数据进行统计分析。
2 结果
2.1 目的蛋白的表达与鉴定电泳结果显示,用 gB基因特异引物从PRV SA株基因组DNA中扩增出1条约1 440 bp的特异条带,与预期扩增的DNA片段长度相符(图1)。将重组表达质粒pET-28a/gB用BamHⅠ和SalⅠ双酶切,酶切结果大小正确(图2)。送生工生物工程(上海)股份有限公司测序,测序结果正确,表明表达质粒构建成功。目的蛋白以包涵体形式表达。将目的蛋白纯化后得到45.0 kDa条带单一的蛋白,符合预期大小(图3)。PRV阳性血清为一抗,抗猪IgG的辣根过氧化物酶标抗体为二抗,对目的蛋白进行Western blot鉴定,结果表明,表达的目的蛋白具有反应原性(图4)。

M.DL15000 DNA Marker;1.阴性对照;2.gB基因PCR扩增产物

M.DL15000 DNA Marker;1.pET-28a;2.pET-28a/gB双酶切产物(BamHⅠ+SalⅠ)

M.蛋白Marker;1.目的蛋白
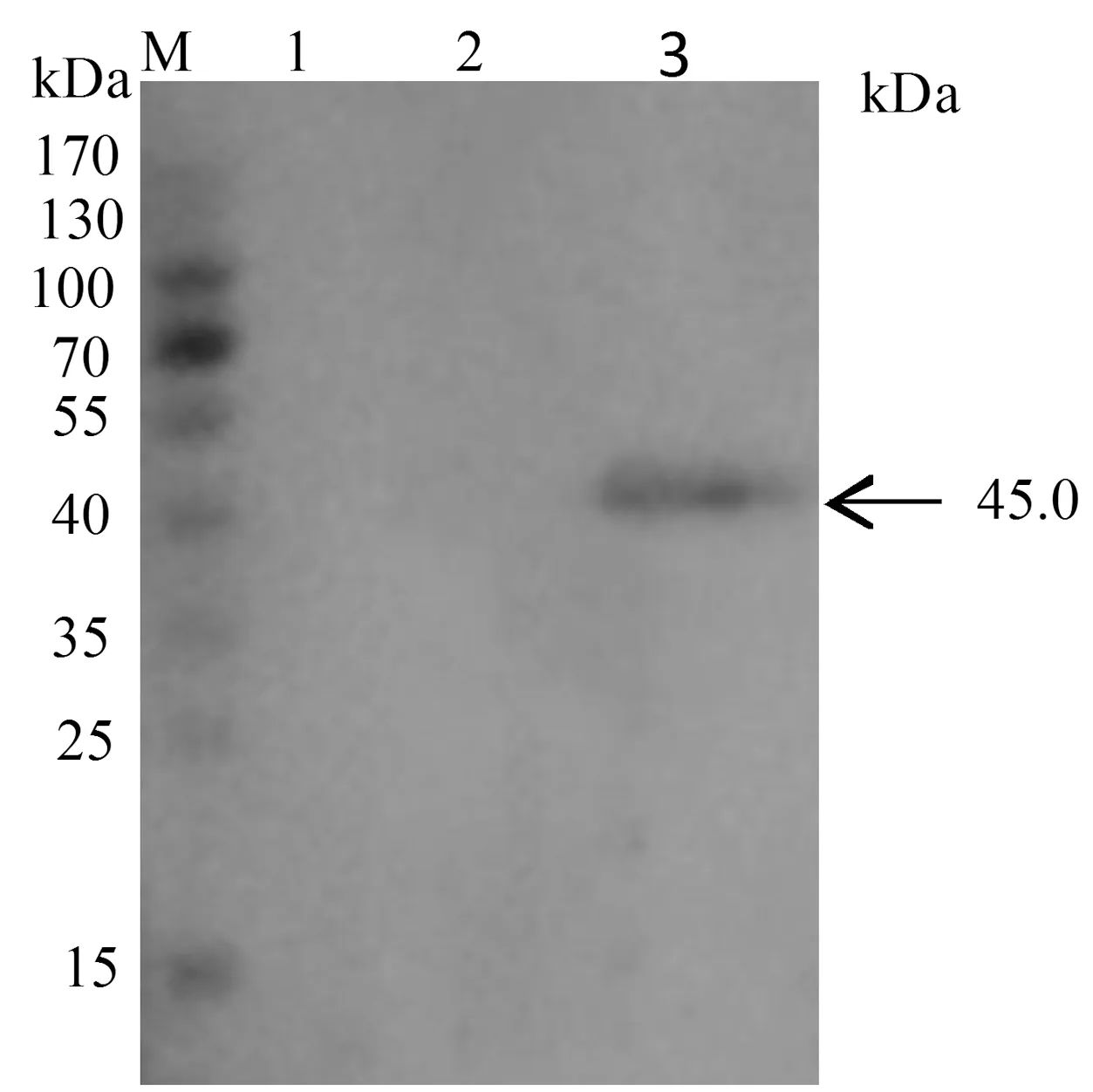
M.蛋白Marker;1.空载体pET-28a对照;2.pET-28a/gB未诱导表达;3.pET-28a/gB诱导表达
2.2 疫苗安全性评价在观察的42 d内,一免各组小鼠精神、食欲、体温正常。期间喂养严格定时定量饲喂,于7,14,21,28,35,42 d各测1次体质量,并记录每组的平均体质量。免疫后各组之间体质量增长无明显差别,研究表明各佐剂亚单位疫苗对小鼠生长影响差异不显著(图5)。
图5 免疫后小鼠体质量变化
2.3 小鼠血清抗体测定由小鼠血清抗体检测结果(表2、图6)可看出,一免后14 d,各疫苗组抗体水平显著提高,在21~28 d时抗体水平达到最高,之后开始出现下降,其中gB/Oil①、gB/M402①和gB/PIC①组较其他组升高显著,gB/Propolis①、gB/VCG①、gB/rINF①和gB①组较对照组稍有提高但不显著,对照组无明显变化,二免后抗体显著提高。

图6 小鼠抗体曲线图

表2 小鼠血清抗体检测结果 D630 nm值
2.4 免疫攻毒保护试验免疫攻毒组②组,35 d攻毒,每组10只小鼠,每只小鼠皮下注射0.2 mL(含有 100 TCID50),按照《中国兽药典》相关规程,观察7 d,测定攻毒保护效果。效力检验试验结果表明,gB/Oil②组保护率为60%;gB/M402②和gB/PIC②组保护率为40%;gB/Propolis②和gB/VCG②组保护率为20%;对照组全部死亡(表3)。

表3 疫苗保护效果评价结果
3 讨论
佐剂作为免疫增强剂可增强抗原的免疫应答反应,作为载体来递送抗原到相应的免疫细胞,降低抗原的降解,以此增强机体的免疫保护[13-14]。复合佐剂是将两种或多种不同免疫效果的佐剂按一定比例进行搭配,以发挥各种佐剂的最大效果,可进一步调节或增强免疫应答,起到更强的免疫保护作用。
PIC是20世纪60年代由美国默克公司研制。在小鼠试验中,PIC是IFN-α诱生剂,有抗病毒活性[15-16]。细菌菌影(bacterial ghosts,BG)是革兰阴性菌被噬菌体q-X174裂解基因E编码的裂解蛋白在菌体细胞内表达后形成的产物,是无细胞浆和核酸的细菌体[17]。细菌菌影疫苗作为一种新型疫苗,既可诱导机体产生体液免疫与黏膜免疫,又能产生细胞免疫。近年来,利用细菌菌影可递送载体的特性,构建重组多价亚单位疫苗、DNA疫苗及药物递送的应用越来越受到人们的重视[18]。蜂胶是一种天然的免疫增强剂,大量的研究表明蜂胶可做为疫苗和菌苗的免疫佐剂来增强疫苗的免疫效果[19-20]。铝胶佐剂是一种广泛用于人类疫苗和兽用疫苗的佐剂,具有抗原吸附力强、缓释、副作用小等特点[21]。白油佐剂对体液免疫和细胞免疫系统具有很强的激活作用,其优点是价格相对低廉,制备工艺完备,利于大规模生产。利用各种表达系统表达出的病原微生物的保护性抗原,具有成分单一、抗原纯净、安全性高等特点。同时也存在一些缺点,如免疫原性弱、半衰期短等。要增强抗原在机体内的免疫应答能力,延长其半衰期,提高抗原免疫效力,必须筛选合适的佐剂。
PRV糖蛋白B(gB)可诱导体液和细胞免疫[22]。近年来对gB研究较多。CODY等[23]研究发现,gB+MF59佐剂亚单位疫苗可有效预防产后和青春期女性人巨细胞病毒(HCMV)感染;MARIJA等[24]研究了EB病毒(epstein-barr virus,EB)gB蛋白结构域特点,为研究EB病毒的特异性及gB亚单位疫苗作用机制提供了理论基础;田克恭等[25]发明了一种PRV亚单位疫苗,将gB、gC、gD、gII和gC蛋白混合后加入佐剂配成疫苗,可对仔猪产生免疫保护作用。gB和 gD 糖蛋白是 PRV 重要的免疫原性蛋白,PRV 的gB和 gD 蛋白的编码基因是开发 PRV 的重组载体疫苗的目标基因[26]。本研究使用白油佐剂、PIC佐剂、复合佐剂、铝胶佐剂、VCG佐剂和蜂胶佐剂与gB蛋白主要抗原决定簇gBb经过乳化制成疫苗。通过超剂量免疫体质量18~22 g昆明鼠,免疫后小鼠精神、采食及体温等均正常,注射部位未见异常,体质量无明显变化,疫苗免疫对小鼠生长无影响。研究发现,gB/Oil、gB/PIC和gB/M402疫苗保护率达到40%~60%,gB/VCG和gB/Propolis疫苗保护率达到20%。为进一步研究PRV疫苗引起的免疫机制和新型亚单位疫苗及新型免疫佐剂研究提供了依据。其中针对不同佐剂gB蛋白主要抗原决定簇免疫作用的机制还有待进一步研究。
