高分子脲醛缓释肥料降解菌的筛选及降解酶性质初探
2022-07-25胡培毅郄浩然仝迎芳刘子超郭仕伟郭建峰刘亚青
王 芳 胡培毅 向 阳 郄浩然 仝迎芳 刘子超郭仕伟 郭建峰 刘亚青*
(1.中北大学 化学工程与技术学院,太原 030051; 2.纳米功能复合材料山西省重点实验室,太原 030051; 3.山西省高分子复合材料工程技术研究中心,太原 030051)
脲醛(UF)肥料是高分子聚合材料的1种,由不同长度链的聚合物组成。全球每年有30多万t脲醛用做树脂、粘合剂、绝缘材料和用于绿色植物、草坪或生物修复过程的控释氮肥。脲醛肥料是最早的缓释肥料,可在自然环境中逐步降解,缓慢释放所含氮肥。脲醛肥料中氮等肥料的精准受控释放是肥效增高的关键,温度、水分、pH等理化因素都会影响其降解过程以及肥效。
其他高分子聚合材料,如聚乙烯(PE)、聚苯乙烯(PS)的生物降解是环境保护研究的热点。已有研究表明黄粉虫的幼虫(Tenebrio
molitor
Linnaeus
)可以降解PE等塑料材料,其肠道中特定微生物以及微生物分泌的降解酶是降解塑料的主要酶。土壤中富含多种微生物,理论上,土壤中可能存在一些微生物,会影响高分子脲醛缓释肥料(PSRF)的降解过程。有研究表明脲醛缓释肥与土壤中微生物具有复杂的相互作用:一方面土壤中的微生物参与降解脲醛肥料,提高氮源的释放速度;另一方面缓释复合肥对土壤中微生物有促进作用,可以提高土壤微生物种类和含量,减弱对微生物生存环境的胁迫。Ikeda等研究发现洋葱和甜菜中细菌多样性的近30%的差异是由于施肥条件造成的,而且2种植物的群落结构在脲醛肥料作用下单向移动。微生物降解高分子聚合材料的难易程度主要取决于聚合物分子的大小和结构、微生物的种类以及微生物的生活环境条件。对聚合物而言,一般可被微生物降解的化学结构顺序为:脂肪族酯键、肽键>氨基甲酸酯>脂肪族醚键>亚甲基。此外,相对分子质量大、分子结构排列规整、疏水性大的聚合物,不利于微生物的生长和作用,也就不利于生物降解。高分子聚合材料的结构依据分子在空间排列的规整性可分为结晶型、部分结晶型和无定型(非晶态)三类;高分子材料中除了晶态结构外还有无定型(非晶态)结构。与无定型区域相比,高分子材料的晶体结构区域结构更致密更难降解;与因光、热等物理因素部分降解的片段相比,不溶性高分子聚合材料从头降解更难降解。脲醛高分子材料在光、热、水分等因素作用下可以先将大分子降解为小分子片段,降解后的中小分子片段比较容易被微生物利用。Jahns等筛选出了能够生物降解脲醛高分子缓释肥经部分降解后的小分子中间物,如亚甲基脲、二甲基三脲、异丁烯二脲和丁烯二脲。菌种Ralstonia
paucula
能够产生降解亚甲基脲的MDUase;菌种Burkholderia
sp.能够产生降解MDU(亚甲基脲)、DMTU(二甲基三脲)的MDUase;菌种Rhodococcus
erythropolis
能够产生降解IDU(异丁烯二脲)的IDUase;菌种Rhodococcus
sp.能够产生降解CDU(丁烯二脲)的CDUase.以上微生物能够利用脲醛小分子中间代谢物作为生长所需的唯一氮源。但是,目前对于不能热解的、水不溶性的脲醛大分子肥料尚无生物降解的相关报道,而对不易自然降解的大分子进行从头降解微生物及相关酶是更彻底的、源头性生物降解,对生物降解的研究更有意义。已有研究筛选得到亚甲基脲等中间代谢物的降解菌及降解酶,然而脲醛高分子肥料的微生物降解过程尚未进行研究。因此,本研究拟以含磷和钾元素的脲醛高分子缓释肥料(PSRF)为研究对象(图1),利用SEM、激光粒度分布、乙酰丙酮分光光度法和钼酸铵分光光度法,研究高分子脲醛缓释肥料中不易热解的、不溶性高分子团聚颗粒部分的生物降解过程,以期为脲醛缓释肥的生物从头降解途径提供及应用参考。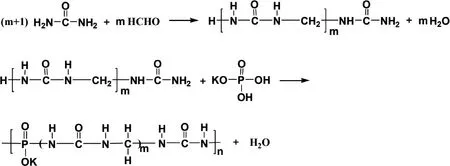
图1 高分子脲醛缓释肥料(PSRF)的合成途径[21]Fig.1 Synthesis of polymer urea-formaldehyde slow-release fertilizer (PSRF)[21]
1 材料与方法
1.1 试验材料
1
.1
.1
菌株和PSRF肥料样品本研究中使用的菌株P.
rubens
23229 分离自中北大学连续2年施用PSRF肥料(每年施肥1次,每次种植时施用11.84 g肥料)的盆栽(长120 cm×宽40 cm×深28 cm)土壤(土壤深度为20 cm)样品,现为本实验室保存菌株。所使用的含氮磷钾生物降解高分子脲醛缓释肥料(PSRF肥料)由山西省高分子复合材料工程技术研究中心提供。1
.1
.2
培养基和主要试剂无机盐母液的配制:FeCl·4HO 1.8 g,CoCl·6HO 0.25 g,NiCl·6HO 0.01 g,CuCl·2HO 0.01 g,MnCl·4HO 0.70 g,ZnCl0.1 g,HBO0.5 g,NaMoO·2HO 0.03 g, NaSeO·5HO 0.01 g,蒸馏水1 L。配制好后放于冰箱4 ℃保存,使用时取1 mL定容到1 L作为无机盐溶液使用。
复合维生素母液的配制:生物素0.1 g,烟酸0.35 g,盐酸硫胺素0.3 g,对氨基苯甲酸0.2 g,盐酸吡多胺0.1 g,泛酸钙0.1 g,维生素B0.05 g,蒸馏水1 L。配制好后放于冰箱4 ℃保存,使用时取7.5 mL定容到1 L作为复合维生素溶液使用。
筛选培养基:PSRF 10 g、无机盐溶液1 mL、复合维生素溶液7.5 mL、蒸馏水1 000 mL。
察氏培养基(Czapek):硝酸钠3 g、磷酸氢二钾1 g、MgSO·7HO 0.5 g、KCl 0.5 g、硫酸亚铁0.01 g、蔗糖30 g、蒸馏水1 000 mL。
磷酸缓冲液的配制(0.2 mol/L pH 7.0):A液(NaHPO·HO 3.161 g),B液(NaHPO·HO 2.760 g),分别溶于蒸馏水,定容至100 mL;A液与B液按61∶39体积比混合。
戊二醛溶液(2.5%):取25%戊二醛水溶液10 mL和磷酸盐缓冲液(0.2 mol/L pH 7.0) 50 mL,用蒸馏水定容至100 mL。
1.2 试验方法
1
.2
.1
PSRF降解菌富集筛选土壤采集:采集施用过高分子缓释肥料PSRF的土壤,用取样铲将表层土壤3 cm左右的浮土除去,采取深度5~10 cm处的土壤,装入预先灭菌的采样袋中,混合均匀。称取5 g土壤,溶解于1 000 mL蒸馏水中,接入含有肥料PSRF的液体筛选培养基中(筛选过程中设置了3个重复),置于28 ℃恒温智能生化培养箱中培养10 d。将对PSRF富集的菌液按10~10倍梯度稀释后,分别涂布于筛选平板上,28 ℃倒置培养4~5 d。挑选PSRF降解菌株,在筛选平板上多次划线直至得到纯菌落。
1
.2
.2
降解微生物菌落形态特征观察肉眼观察降解菌在固体筛选培养基(PSRF)上的菌落形状、颜色、透明度、隆起和边缘特征等。挑取菌种于载玻片上,用光学显微镜(SK 160,麦克奥迪实业集团有限公司,中国)进行进一步观察。
1
.2
.3
ITS 基因序列鉴定和系统发育分析采用omega HP真菌DNA提取试剂盒(E.Z.N.A.TM High Performance (HP) Fungal DNA Kit)法提取菌体总DNA。利用ITS1/ITS4(真菌)引物ITS1:5′-TCCGTAGGTGAACCTGCGG-3′和ITS4:5′-TCCTCCGCTT ATTGATATGC-3′扩增所筛菌株的序列,将所获得的扩增片段利用 DNAMAN 软件进行拼接,使用Contig Express拼接测序结果,并去除两端不准的部分。测序结果与 NCBI 数据库进行比对,利用MEGA-X软件进行多序列比对分析并构建系统发育树。
1
.2
.4
抗热解PSRF(rPSRF)肥料的制备称取100 g PSRF于500 mL三角瓶中,加入200 mL去离子水,置于25 ℃下水浴搅拌30 min,使用中速滤纸进行过滤;弃去滤液,将剩余的PSRF用2 L去离子水洗2次,加入500 mL去离子水重悬,于75 ℃水浴搅拌30 min,使用中速滤纸进行过滤;弃去滤液,将剩余的PSRF用2 L去离子水洗2次,加入500 mL去离子水重悬,于100 ℃水浴搅拌30 min,使用0.45 μm的滤膜进行抽滤,用100 mL去离子水水洗2次;最后将过滤器上的PSRF在40 ℃干燥箱中烘干,备用。
1
.2
.5
无菌发酵液的制备分别在察氏培养基(Czapek)和PSRF筛选培养基中接种产红青霉,28 ℃ 100 r/min震荡培养10 d,取发酵液在转速4 000 r/min,4 ℃的条件下,离心10 min,弃去沉淀,将上清液过0.45 μm的混合滤膜,得到无菌的Czapek发酵液以及PSRF发酵液。
1
.2
.6
微生物及酶从头降解性能研究以热处理过的抗热解高分子肥料(rPSRF)为唯一碳源和氮源,分别接种产红青霉或无菌发酵液于30 ℃共培养7 d,rPSRF肥料降解分组见表1:
表1 本研究rPSRF肥料降解分组
Table 1 Anti-pyrolytic PSRF fertilizers used in this study
组别Group处理方式Processing mode空白对照 CK20 g rPSRF肥料+200 mL无菌水产红青霉组 Penicillium rubens group20 g rPSRF肥料+200 mL无菌水+微量元素0.2 mL、维生素1.5 mL+产红青霉菌种2 mLCzapek发酵液 Czapek fermented liquid group20 g rPSRF肥料+200 mL Czapek无菌发酵液PSRF发酵液 PSRF fermented liquid group20 g rPSRF肥料+200 mL PSRF无菌发酵液
以上样品每24 h取一次样,检测pH、甲醛、磷含量以及电导率。连续监测7 d。甲醛含量的检测采用乙酰丙酮分光光度法。磷含量检测采用钼酸铵分光光度法。电导率用电导率仪(DDSJ-308F,上海仪电科学仪器股份有限公司,中国)测定。
1
.2
.7
降解颗粒粒度分布检测产红青霉菌对抗热解肥料降解15 d后,将液体摇匀后取样15 mL,使用激光粒度分布仪(Bettersize2600,丹东百特仪器有限公司,中国)对粒度分布进行检测。
另外取5 mL样品以0.22 μm的水相滤膜过滤,使用Zeta电位及激光粒度分析仪(Zeta Plus,布鲁克海文仪器公司,美国)进行纳米粒度分布检测。
1
.2
.8
抗热解肥料降解的显微观察产红青霉菌组样品共培养15 d后,挑取残余PSRF肥料于载玻片上,使用荧光显微镜(Axio Vert A 1,卡尔蔡司公司,德国)进行观察。同时将另一部分肥料置于1.5 mL离心管内,加入2.5%的戊二醛溶液(固定液加满离心管,使样品完全浸没在固定液中),放置于4 ℃保存,等待SEM使用前的预处理。
SEM样品预处理:倒掉固定液,用0.1 mol/L,pH 7.0的磷酸缓冲液漂洗样品3次,每次15 min;用1%的锇酸溶液固定样品1~2 h;小心取出锇酸废液,用0.1 mol/L,pH 7.0的磷酸缓冲液漂洗样品3次,每次15 min;用梯度浓度(包括30%,50%,70%,80%,90%和95%五种浓度)的乙醇溶液对样品进行脱水处理,每种浓度处理15 min,再用100%的乙醇处理2次,每次20 min。用乙醇与醋酸异戊酯的混合液(V
(乙醇)∶V
(醋酸异戊酯)=1∶1)处理样品30 min,再用纯醋酸异戊酯处理样品1 h或放置过夜。临界点干燥。镀膜,观察。处理好的样品以生物电镜(Nova Nano 450,FEI公司,美国)观察。1.3 统计分析
本研究数据的统计分析(汇总统计、相关性、方差分析和t
检验)在Origin 2019 b中进行。2 结果与分析
2.1 PSRF肥料降解菌的筛选及分离
在选择性培养基上筛选具有潜在降解PSRF功能的菌株的结果见图2(a)。可知:菌落圆形,菌落面平坦,中心呈深绿色,边缘白色,质地绒状或兼轻微絮状。光学电子显微镜下观察到菌丝和分生孢子(图2(b)),分生孢子面绿色;菌丝体白色,无渗出液,反面初期为黄绿色或淡黄色;有帚状枝,分生孢子链状。从形态上观察与青霉属菌种相似。

图2 PSRF培养基上生长菌落的形态(a)和菌体在光学显微镜下图像(b) (400×)Fig.2 Colony morphology on PSRF media (a) and image of under light microscope (b) (400×)
2.2 菌株鉴定及系统发育树构建
利用NCBI-BLAST对降解菌的ITS rRNA基因进行同源性分析发现,分离得到的菌种与Penicillium
rubens
CBS 129667(序列号NR_111815.1)相似度最高,去除首尾多余序列后同源性达 100.00%。采用Geneious和MEGA软件构建筛选菌株的系统发育树如图3所示。因此,结合该降解菌菌落形态、菌体大小和生理生化等特征,确定该菌种为P.
rubens。菌株送至中国微生物菌种保藏管理委员会普通微生物中心进行专利菌种保藏,保藏号CGMCC 23229。
红框区域是本研究筛选到的菌株P. rubens 23229;图标中0.010表示代表每1 000个核苷酸/氨基酸中有10个不同。The red box area is the strain P. rubens 23229 identified in this study. The value 0.010 below the scalebar represents 10 different nucleotides/amino acids per 1 000 nucleotides/amino acids.图3 PSRF降解菌株基于ITS rRNA基因序列的系统发育树Fig.3 Phylogenetic tree of PSRF degradeted microorganisms based on ITS rRNA gene sequence
2.3 P. rubens 23229对PSRF抗热解部分降解的形态观察
P.
rubens
23229对PSRF抗热解部分降解的形态观察结果见图4。图4(a)为PSRF抗热解肥料的空白组在荧光显微镜下的观察结果,可以看出肥料平整。P.
rubens
23229与抗热解肥料培养基在室温下共培养10~20 d后,三角瓶中出现白色团状菌丝;挑取部分团状菌丝,在荧光显微镜下观察(图4(b))。与无菌的空白组(图4(a))中只有均匀分布的肥料相比,图4(d)中可以观察到肥料上有菌丝缠绕。用生物扫描电镜进一步观察与P.
rubens
23229共培养组中rPSRF肥料的碎块和P.
rubens
23229互相交错(图4(c)),图4(c)中的1和2分别代表rPSRF肥料降解产生的碎块和P.
rubens
23229的菌丝,图4(d)中的3、4分别代表图4(c)中红色圆圈放大后的P.
rubens
23229的菌丝和rPSRF肥料降解产生的小碎屑。以上显微观察结果表明,P.
rubens
23229能在水不溶性的抗热解脲醛高分子肥料rPSRF上附着生长,并通过生物降解将其从致密的大块结构分解为小块甚至更小的碎屑。
(a)PSRF在荧光显微镜下放大100倍的图(CK);(b)P. rubens 23229对rPSRF降解在荧光显微镜下放大100倍的图;(c)和(d)P. rubens 23229对rPSRF降解在生物扫描电镜下的图,放大倍数分别为500和10 000倍。(d)和(c)红圈区域的放大图。1和4表示PSRF被P. rubens 23229降解后产生的碎块;2和3表示P. rubens 23229生长产生的菌丝。(a) The 100 fold magnification of PSRF under fluorescence microscope(CK). (b) A 100 fold magnification of the degradation of rPSRF by P. rubens 23229 under fluorescence microscope. (c) and (d) The images of P. rubens 23229 degrading rPSRF under biological scanning electron microscope, with magnification of 500 and 10 000 times, respectively. (d) The enlarged image of the area outlined in red in (c). 1 and 4 represent fragments generated by degradation of PSRF by P. rubens 23229. 2 and 3 are P. rubens 23229 mycelia.图4 P. rubens 23229 对rPSRF部分降解的形态观察Fig.4 Morphological observation of P. Rubens 23229 on the anti pyrolysis partial degradation of rPSRF
2.4 Penicillium rubens 23229对PSRF抗热解部分降解粒度分布
用激光粒度仪检测P.
rubens
23229对rPSRF部分降解的微米级颗粒大小分布结果见图5(a)。可见未经处理的空白对照和经过产红青霉处理的样品,其颗粒直径均集中在197.8 μm附近,但分散性有显著差异。经过P.
rubens
23229处理的样品在低于197.8 μm处的累积分布达到75.83%,对照组为67.31%,比对照提高了8.52%,说明P.
rubens
23229存在时小颗粒数增加;试验组在大于567.4 μm处的累积分布为0.28%,对照组为2.18%,比对照降低了1.90%,说明P.
rubens
23229存在时肥料大颗粒数目减少。图5(a)微米级颗粒大小分布结果表明P.
rubens
23229加强了抗热解肥料PSRF分解为小颗粒的程度。图5(b)为加入产红青霉菌前后抗热解肥料上清液中小于0.22 μm的纳米级颗粒大小分布图。从图中可以看出,与P.
rubens
23229共培养后,样品粒度分布较空白对照朝中轴有一定的收缩趋势,其有效直径为693.7 nm,与对照(705.2 nm)相比降低了1.63%。图5(b)纳米级颗粒大小分布结果说明了P.
rubens
23229将rPSRF进一步降解为纳米级颗粒。
图5 Penicillium rubens 23229对rPSRF肥料作用的不同颗粒大小的粒度分布Fig.5 Particle size distribution of Penicillium rubens 23229 on rPSRF fertilizer
2.5 P. rubens 23229 对rPSRF的降解产物分析
PSRF经热处理后,剩余的部分为抗热解肥料(rPSRF)。研究P.
rubens
23229 与rPSRF共培养期间,甲醛、磷含量以及电导率随时间的变化趋势,结果见图6。从图6(a)中可以看出,在rPSRF肥料中加入了产红青霉后,溶液中磷的含量在24 h内显著升高至0.791~19.228 μg/mL;2~7 d内磷的含量趋于稳定,溶液中的磷含量最高达21.520 μg/mL。相比较而言,空白对照组在0~7 d时间中磷含量变化区间为0.127~1.573 μg/mL。磷是PSRF高分子肥料的组成部分,游离磷含量的增加,说明肥料在降解过程中释放了磷酸根。空白组经过热处理,自然降解速率较低,磷含量较低,而有P.
rubens
23229存在时,显著提高了肥料大分子的降解速度。磷酸根是菌种生长的重要物质,从第1天之后产红青霉组磷含量虽有波动,但总体保持在18.187~21.520 μg/mL范围内,这可能是磷酸根在肥料降解和菌种利用速度之间达到的一种动态平衡。甲醛是PSRF合成的单体之一,也是其降解的终端产物之一。从图6(b)可以看出,空白对照组在试验期内甲醛含量无显著变化,含量均低于0.001 8 mg/mL。有P.
rubens
23229存在时,体系中甲醛含量从0.015 7 mg/mL迅速增加到0.134 0 mg/mL,并在随后的5 d内持续增加,最高达到0.213 0 mg/mL,提高到初始甲醛含量的13.6倍,与对照相比差异显著(P
<0.05)。与磷酸根一样,甲醛也是微生物生长可利用的营养物质,尤其在无其他碳源存在的情况下,甲醛是重要的碳源,甲醛含量理论上是肥料降解和微生物利用之间的动态平衡结果。以上结果说明P.
rubens
23229可以降解rPSRF肥料并利用其作为营养素生长繁殖。在rPSRF中加入了产红青霉后,电导率变化情况见图6(c)。在第1天,电导率由123.3 μS/cm增加到220.0μS/cm,增加了96.7 μS/cm,是空白对照(CK)的电导率在1 d中增加量28.9 μS/cm(31.2~60.1 μS/cm)的3.35倍,差异显著(P
<0.05)。试验组2~6 d的变化趋势比较平缓,可能是由于P.
rubens
23229的大量繁殖对溶液中离子消耗,6~7 d,试验组的电导率又有了上升趋势,菌种繁殖相对饱和对抗热解肥料降解的离子小于消耗的离子,故电导率开始增加。试验组的整体趋势与磷含量变化比较一致,说明了磷酸根离子的对电导率的变化有一定的影响。对照组整体上趋势比较平缓,说明了抗热解肥料自身的缓慢降解,导致电导率的逐步增加。
图6 Penicillium rubens 23229与rPSRF肥料共培养过程中磷含量(a)、甲醛含量(b)以及电导率(c)随时间的变化趋势Fig.6 Changes of phosphorus content (a), formaldehyde content (b) and electrical conductivity (c) of Penicillium rubens 23229 on rPSRF fertilizer
2.6 P. rubens 23229 无菌发酵液性质初步分析
利用钼酸铵分光光度法检测磷含量分析P.
rubens
23229无菌发酵液对rPSRF的降解能力,结果见图7(a)。可知:与对照组磷含量(0.127~0.832 μg/mL)相比,加入以PSRF肥料培养P.
rubens
23229无菌发酵液后,rPSRF和P.
rubens
23229无菌发酵液混合体系中磷含量持续增加,最高达10 057.143 μg/mL,差异显著(P
<0.05)。说明在无菌的发酵液中含有rPSRF降解酶,而且该酶为菌种产生的胞外酶。无菌发酵液中磷含量的最大值远高于有菌存在时的量(21.520 μg/mL),证实了菌体在降解后对其中磷元素的利用。相反,察氏培养基培养P.
rubens
23229的无菌发酵液与rPSRF共培养后,系统中磷含量增加很少(最大值87.054 μg/mL)。究其原因可能是察氏培养基配方中本身含有的磷元素,在此过程几乎没有因为肥料降解而新增的磷。以上结果表明在不含PSRF的察氏培养基中无降解酶产生,也即降解酶的产生必须有PSRF的存在,受PSRF诱导产生。利用乙酰丙酮分光光度法检测甲醛含量分析P.
rubens
23229无菌发酵液对rPSRF的降解能力,甲醛含量变化结果见图7(b)。可见:以PSRF肥料培养P.
rubens
23229无菌发酵液中甲醛的含量随着时间的变化整体呈上升趋势,由0.169 0 mg/mL增加到最高值0.200 0 mg/mL;Czapek无菌发酵液中甲醛的含量由0.037 8 mg/mL增加到最高值0.139 0 mg/mL;空白对照中甲醛含量无显著变化,均低于0.001 8 mg/mL。PSRF肥料无菌发酵液中,最初的甲醛含量比Czapek无菌发酵液的甲醛含量高,是由于发酵液中含有初期降解PSRF肥料产生的甲醛,而PSRF肥料无菌发酵液中的诱导酶要优于Czapek无菌发酵液。最终稳定后,PSRF肥料无菌发酵液中最高的甲醛含量0.200 0 mg/mL高于Czapek无菌发酵液中最高的甲醛含量0.139 0 mg/mL,说明不同发酵液中的酶种类含量不同,所能降解rPSRF的产生甲醛的结构有限,故降解稳定后,PSRF肥料无菌发酵液中的酶降解rPSRF生成甲醛的能力优于Czapek无菌发酵液。溶液电导率的变化趋势见图7(c)。Czapek无菌发酵液的电导率增加量为280 μS/cm,是空白对照(CK)的电导率在7天中增加量182 μS/cm的1.538倍;PSRF肥料无菌发酵液的电导率增加量为1 890 μS/cm,是空白对照(CK)的电导率增加量182 μS/cm的10.385倍,差异显著(P
<0.05)。以上结果说明在有PSRF存在时其降解酶活性更强,受PSRF诱导产生。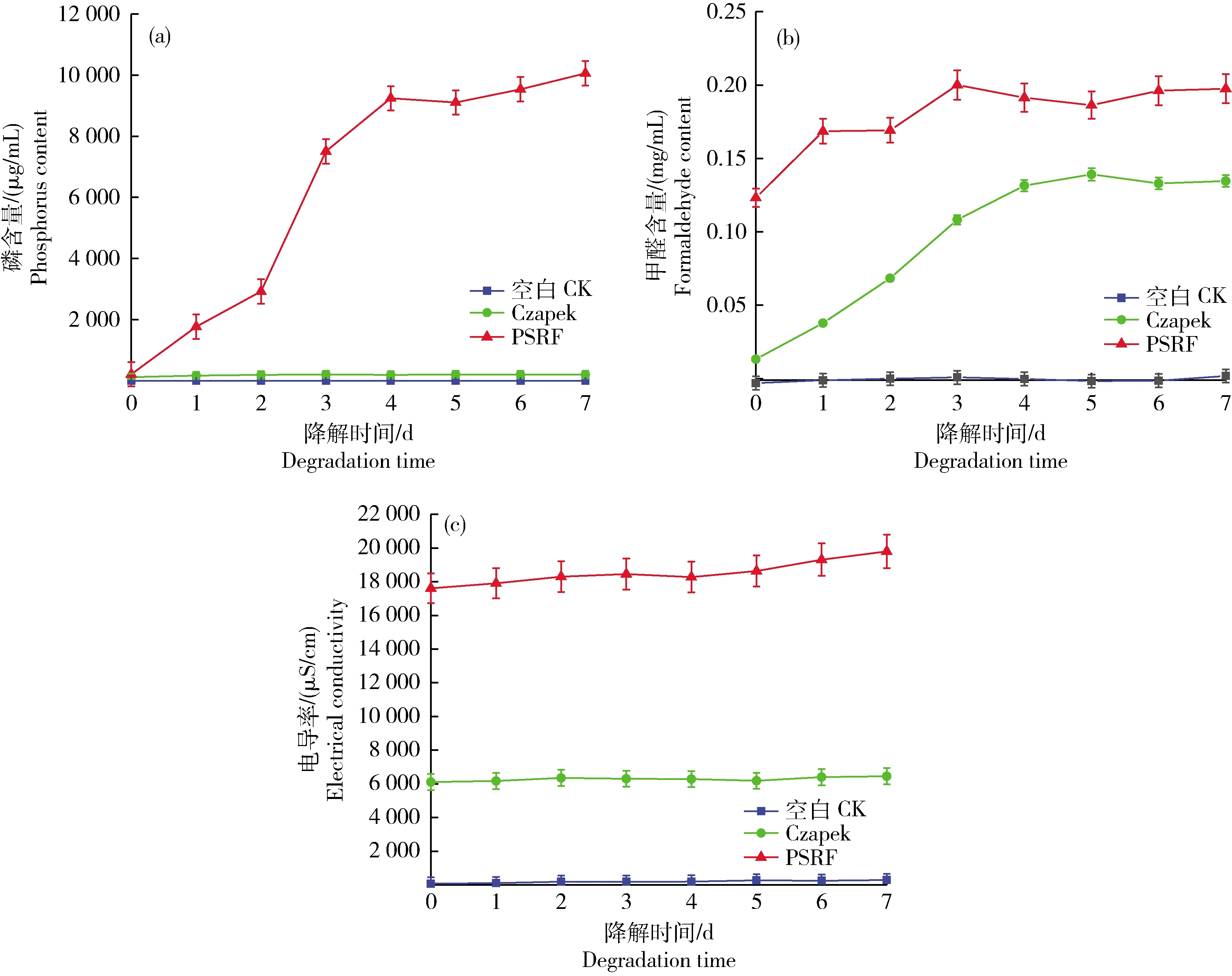
图7 无菌发酵液对PSRF肥料作用的磷含量(a)、甲醛(b)以及电导率(c)的变化情况Fig.7 Changes of phosphorus content (a), formaldehyde contend (b) and the electrical conductivity (c) of sterile fermentation broth on PSRF fertilizer
3 讨 论
本研究以高分子缓释肥料PSRF为唯一碳源和氮源,从土壤中筛选出1株高分子脲醛降解菌,经鉴定为产红青霉Penicillium
rubens
CGMCC 23229。产红青霉菌广泛存在于土壤、海藻、食品等样品中,该菌以发霉的哈密瓜、未发酵的葡萄汁、啤酒瓶盖残留物质等作为营养来源。产红青霉菌的次生代谢产物包括青霉素等,另外有些萜烯类、聚酮类、酰胺类化合物等次生代谢物还可刺激植物生长发育、制备西瓜霜等。高分子材料降解菌包括降解塑料的Marinomonas
、降解脲醛的低聚物亚甲基脲等的菌种Ralstonia
paucula
、Burkholderia
sp.和Rhodococcus
sp.等,主要为细菌,真菌报道不多。本研究首次筛选到的脲醛高分子降解菌产红青霉为真菌,一方面丰富了高分子材料生物降解菌的种类;另一方面,在十几份土壤样本近百个筛选样品中最终只筛选分离到产红青霉,没有筛选到他微生物尤其是已有报道的细菌降解菌,分析其原因如下:一方面可能是能够以脲醛肥料为唯一碳源和氮源进行生长的微生物较少;另一方面也可能是产红青霉在筛选培养基这种营养贫瘠的条件下生存时由PSRF诱导同时产生了青霉素等抗生素,抑制了土壤中原本可能降解代谢脲醛高分子肥料的其他微生物,包括某些细菌的生长繁殖。高分子聚合材料的降解受光、热、酸等物理化学的影响,生物降解通常从无定型区开始,对结构紧密的结晶区较难发挥作用。脲醛高分子肥料中间代谢物如亚甲基脲、二甲基三脲、异丁烯二脲、丁烯二脲等,此类化合物分子量小、溶解性高,易为微生物利用,筛选到的降解菌也主要为细菌。对于结构紧密、分子量更大、溶解性小高分子聚合材料,微生物降解难度增大,尚未见报道。为了解决大分子降解的问题,有研究先使用酶解将高分子材料降解为微生物可以利用的聚合物单体,进而再进行微生物降解研究。本研究筛选得到的P.rubens
23229能够对高分子抗热解肥料(rPSRF)进行降解,并对其降解酶进行初步研究,试图探究高分子脲醛缓释肥料从高聚物到中间代谢物再到甲醛和尿素的生物降解的全过程。根据本研究结果推测脲醛在土壤中可能存在一条完整的生物降解链,即:1)由青霉菌等真菌产生降解酶对不溶性的大分子脲醛肥料进行第一步降解;2)产生小分子中间代谢物后,再由土壤中细菌类降解菌进一步降解。微生物是土壤生态的重要组成部分,对肥效及植物生长至关重要。阐明微生物对肥料的降解机制及影响因素对于缓释效果及肥效有一定的理论意义与应用价值。4 结 论
以含氮磷钾的高分子脲醛缓释肥料(PSRF)为唯一碳源和氮源分离和筛选得到1株脲醛高分子肥料降解菌,经鉴定为Penicillium
rubens
CGMCC 23229;该菌可将结构紧密的抗热解不溶性大颗粒PSRF降解为小分子碎片,释放出含磷、甲醛等小分子化合物;该菌株产生的降解酶可分泌至发酵液中,且受PSRF诱导产生。